URG11基因介导Wnt/β-catenin信号通路调控EMT参与非小细胞肺癌转移的分子机制研究
2021-10-27刘哲亮彭豪邬娇李旭吴冠宇陈跃军王林纤郭慧李跃进
刘哲亮,彭豪,邬娇,李旭,吴冠宇,陈跃军,王林纤,郭慧,李跃进
( 1.中南大学湘雅医学院附属肿瘤医院 湖南省肿瘤医院胸外科, 湖南长沙 410013;2.湖南大学数学院,湖南长沙 410082; 3.中南大学湘雅医学院附属肿瘤医院 湖南省肿瘤医院麻醉科, 湖南长沙 410013; 4.中南大学湘雅医学院附属肿瘤医院 湖南省肿瘤医院检验科,湖南长沙 410013; 5.中南大学湘雅医学院附属肿瘤医院 湖南省肿瘤医院病理科,湖南长沙 410013)
肺癌是与癌症相关的最常见的致死原因,全世界每年新增确诊肺癌人数约为220万, 每年新增肺癌死亡人数约为179万[1]。 非小细胞肺癌(non-small cell lung carcinoma, NSCLC)占原发性肺癌的85%[2]。 尽管化疗和分子靶向以及免疫治疗的效果已有很大改善,Ⅰ期的NSCLC患者的5年生存率可以达到80%, 但Ⅱ期和Ⅲ期的NSCLC患者的5年生存率仍为13%~60%[3-5]。因此,当务之急在于揭示NSCLC致癌和进展的分子机制。上调基因11(up-regulated gene 11, URG11)是一种通过乙型肝炎病毒X蛋白上调的基因,编码蛋白质分子为70 kDa, 含有5个富含半胱氨酸的条索样重复片段和1个C型凝集素结构域[6]。这些结构参与了细胞粘附、迁移和细胞-基质间相互作用[7-9]。 以前的研究表明URG11在肿瘤发生和发展中起重要作用。有学者报道了URG11在胰腺癌标本中高表达,敲除URG11可以减少胰腺癌细胞侵袭[10]。 另一项研究表明URG11在胃癌中高度表达,通过小干扰RNA(small interference RNA, siRNA)敲除URG11可以显著抑制胃癌细胞的增殖、侵袭和转移潜能[11]。然而,URG11在人NSCLC发病中的作用尚不清楚。
上皮-间质转化(epithelial-mesenchymal transition, EMT)是癌症转移的重要事件[12],它可以增强癌细胞的侵袭能力[13-15],被认为是肿瘤细胞侵袭和转移的关键机制。EMT与肿瘤扩散的频率和肺癌切除术后复发的高风险相关[16], 其影响了肺癌手术和药物治疗的效果,导致患者预后不良。因此,对EMT分子机制的研究可以为肺癌的治疗策略提供参考[17]。然而目前尚未发现URG11介导NSCLC发生EMT的相关报告,也没有相关研究涉及URG11在相关肿瘤中引起EMT的机制。因此,需要进一步研究URG11的靶基因及其诱导NSCLC发生EMT相关机制的分子基础。
笔者等前期研究结果提示敲除基因URG11能显着抑制NSCLC的增殖,迁移和侵袭能力[18]。基于笔者等的研究结果,笔者等推测URG11对NSCLC的促进作用有可能在于其反式激活Wnt信号通路的枢纽蛋白β-Catenin并促使其向细胞核内转移,从而导致β-Catenin/TCF靶基因表达上调,引起上皮细胞向间质细胞转变(即EMT),最终通过EMT增强癌细胞侵袭能力。
1 材料和方法
1.1 设计
体外细胞学实验。
1.2 时间及地点
实验于2018年10月至2021年4月在中南大学湘雅医学院附属肿瘤医院肿瘤研究所完成。
1.3 材料
1.3.1 样品收集
NSCLC组织标本和邻近的非肿瘤标本来自中南大学湘雅医学院附属肿瘤医院的手术病例。患者术前没有进行局部或全身治疗。所有标本切除后立即储存在液氮中备用。所有患者都签署了参与本研究的知情同意书。该研究由湘雅医学院附属肿瘤医院伦理委员会批准。
1.3.2 NSCLC细胞系
人NSCLC细胞系A549购自美国组织培养库(ATCC,Manassas,VA,USA)。
1.3.3 实验动物
雌性Balb/C裸鼠(5~6周龄),体质量18~22 g,购自上海新莱克实验动物有限责任公司(上海,中国)。饲养在无特定病原体(specefic pathogen free, SPF)级实验动物房。相关动物实验中南大学经湘雅医学院附属肿瘤医院伦理委员会批准。
1.4 实验方法
1.4.1 细胞培养
人NSCLC细胞系A549,用DMEM(Gibco BRL,Life Technologies,Grand Island,NY,USA)培养,其中含有10%胎牛血清(FBS;Invitrogen,Carlsbad,CA,USA),100 μg/ ml链霉素(Sigma-Aldrich,St.Louis,MO,USA)和100 IU/ml的青霉素(Sigma-Aldrich,St.Louis,MO,USA),培养箱环境:37℃,5%CO2,95%湿度。
1.4.2 细胞转染
针对URG11的短发夹RNA(shRNA)(shURG11:5’ GCACCTACACAGGCAGAATCTCTCGAGAGATTCTGCCTGTGTAGGTGC-3’)由上海基因药物化学有限公司合成。对A549细胞通过Lipofectamine 2000(Invitrogen, Carlsbad, California, USA)系统转染shURG11,以敲除URG11基因。经shRNA质粒转染48 h,敲除URG11后,收集细胞行后续实验。分为实验组(经shRNA质粒转染敲除URG11)和对照组(未经shRNA质粒转染敲除URG11)。
1.5 主要观察指标
1.5.1 Western blotting测定β-Catenin及其下游基因cyclinD1、c-myc的蛋白表达
使用RIPA裂解缓冲液提取细胞蛋白质[100mM NaCl,50mM Tris-HCl(pH7.5),1%Triton X-100,1mM EDTA,10mM β-甘油磷酸盐,2mM钠钒酸盐和蛋白酶抑制剂]。具体步骤:收集细胞,PBS洗涤3次,加入细胞裂解液,置于4℃,漩涡震荡器每隔30 min混匀一次,裂解2 h。然后3 000×g,15 min离心,收集上清。继续12 000×g,15 min离心收集上清即为全细胞蛋白裂解液。加入等量2×Sample Buffer,ALB2121加热器上加热至100℃4 min, 迅速置于冰中2 min后,离心取上清。BCA法蛋白定量,每孔蛋白总量25μg 上样至SDS-PAGE 胶,电泳、转膜、封闭。蛋白质浓度使用BCA蛋白测定试剂盒(BioTeke,北京,中国),使用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)并转移至聚偏二氟乙烯膜(PVDF,Millipore,Boston,MA,USA)。在该膜上与一抗抗体孵育URG11,β-catenin,cyclin D1,c-Myc以及GAPDH(1∶2 000;Santa Cruz Biotechnology,Santa Cruz,CA,USA),在4℃下过夜。接下来用过氧化物酶标记的二抗(Santa Cruz Biotechnology,Santa Cruz, California )按1∶3 000稀释,并在室温下孵育1 h。最后,蛋白结合率采用增强化学发光(enhanced chemiluminescence, ECL)检测系统(Amersham,Little Chalfont,UK)测定。
1.5.2 RT-qPCR检测β-Catenin,cyclinD1和c-myc的mRNA表达
使用TRIzol试剂(Invitrogen)从细胞中分离总RNA,紫外分光光度计OD 260 nm定量,采用M-MLV逆转录酶 (Clontech, Palo Alto, CA, USA) 将3 μg总RNA逆转录成cDNA。采用cDNA为模板,加入Brilliant SYBR Green QPCR Master Mix试剂盒中(Stratagene, Boston, MA, USA)。用ABIPRISM 7500 fast real-time PCR仪反应(Applied Biosystems Foster City, CA, USA)。以GAPDH作内对照。各引物序列如表1。
在ABI7500循环仪上进行RT-qPCR,具体方案:在95℃下初始变性30 s, 随后在95℃下进行35个5 s循环的变性,在59℃退火30 s,72℃退火30 s。使用GAPDH作为规范基因表达的定量和定性控制。荧光定量数据分析采用公式:R=2-[△CT sample-△DCT control]。

表1 各引物序列
1.5.3 裸鼠成瘤模型评估URG11基因对NSCLC侵袭性生长的影响
裸鼠移植瘤模型的建立方法:取对数生长期的目标细胞,加适量生理盐水配制成细胞悬液,台酚蓝染色,光镜下瘤细胞计数,活瘤细胞>90%,调整细胞浓度为1×107ml,取50μl上述细胞悬液与50 μL Matrigel胶等体积混合,用75%乙醇消毒实验Balb/c雄性裸鼠(4~6周龄,身体质量16~18 g)共20只,随机分为两组。左腋下皮肤消毒,每只小鼠皮下注射0.2 ml上述细胞混合液(含瘤细胞1×106)。瘤计算接种后7 d开始用游标卡尺测量肿瘤长径(L)和短径 (W), 按公式: V=0.52×L×W2计算肿瘤体积。以肿瘤体积为纵坐标、测量时间为横轴标绘制肿瘤体积-时间生长曲线。4周后全部处死,取肿瘤组织立即置于冰上,尽快称重。抑瘤率计算按照公式:抑瘤率=(对照组瘤体称重-实验组瘤体称重)/对照组瘤体称重×100%,后置于-70℃保存,后续用常规免疫组化方法检测组织/细胞中β-Catenin的表达情况。
1.6 统计学方法
实验数据表达为平均值±标准差。两组间差异通过Student'st检验分析。多组间差异通过差异方差分析(ANOVA)。P<0.05认为具有统计学意义。
2 结 果
2.1 敲除URG11显著抑制Wnt /β-Catenin信号通路在NSCLC细胞中的激活
笔者等前期研究结果显示URG11在NSCLC中异常表达,敲除URG11能显著抑制NSCLC细胞的增殖,迁移和侵袭[18],还有证据表明Wnt /β-catenin信号通路参与了NSCLC细胞增殖和侵袭[19-21]。为了进一步证实抑制NSCLC细胞生长和迁移的潜在机制,笔者等检测了URG11对β-Catenin,细胞周期蛋白D1和c-Myc表达的影响。 Westernblot和 RT-qPCR结果显示,敲除URG11可以显著下调β-catenin,c-Myc,和细胞周期蛋白D1在A549细胞中的表达。
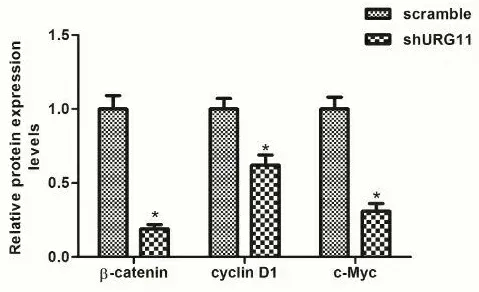
2.1.1 Western blot蛋白质印迹分析显示β-Catenin、cyclinD1和c-myc的蛋白水平在敲除URG11的A549细胞组(实验组)中的表达显著低于未敲除对照组 (DPI值分别为: 0.22±0.06VS 0.77±0.21, 0.61±0.09 VS 1.52±0.23, 0.42±0.07 VS 0.84±0.14,P<0.05)(图1)。上述各蛋白质的光密度值已采用GAPDH作为内参。
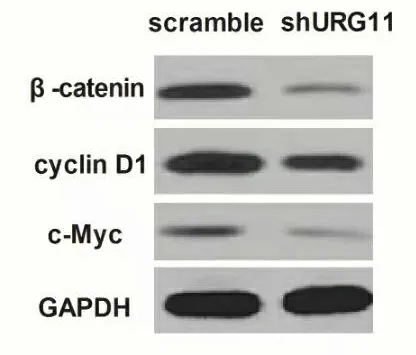
A.
B.
印迹分析显示在转染URG11后β-Catenin、c-Myc和cyclin D/D1表达下降; B.以GAPDH作内参, 通过光学显微镜定量
每个蛋白质的相对密度; 数据为平均值±标准差, 所有实验均在同一时间重复进行至少3次; *,与对照组比较P<0.05)
2.1.2 RT-qPCR结果
RT-qPCR结果显示β-Catenin、 cyclin D1和c-myc的mRNA在未敲除URG11对照组中的表达显著高于敲除URG11的A549 细胞实验组 (分别为3.52倍,2.58倍和2.19倍,P<0.05)。
2.2 敲除URG11显著减少异种移植肿瘤体在裸鼠体内侵袭性生长
2.2.1 裸鼠异种移植肿瘤的免疫组化鉴定β-Catenin分布
异种移植肿瘤动物模型可见新生瘤体原位长于裸鼠左侧腋下(图2A)。收集饲养第三十五天的裸鼠,处死后用HE染色法对裸鼠新生肿瘤进行鉴定,确认新生肿瘤是人源NSCLC(图2B),从而确定肿瘤异种移植动物模型的有效性。免疫组化法进一步鉴定β-Catenin在新生肿瘤组织里的分布情况,结果提示新生移植肿瘤组织的细胞胞浆里均匀分布有β-Catenin(图2C),进一步证实URG11及其下游基因β-Catenin在肿瘤侵袭性生长中的作用。
2.2.2 裸鼠异种移植肿瘤动物模型的动态观察
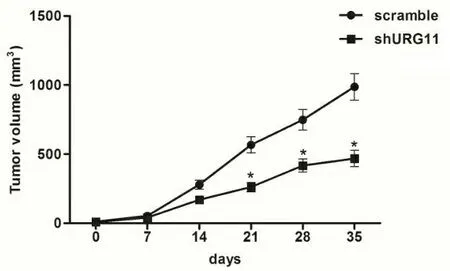
通过裸鼠异种移植肿瘤模型动态观察了URG11对肿瘤的体内生长作用。裸鼠移植NSCLC细胞后可以新生肿瘤,从第七天开始即可以看到逐渐长大的瘤体。从第21天开始,实验组和对照组的新生瘤体生长速度有明显区别,实验组的瘤体生长速度要明显慢于对照组。与对照组相比,敲除URG11能显著抑制BALB/c裸鼠体内新生肿瘤的重量。第35天新生瘤体重量,实验组VS对照组:(0.21±0.04)g VS (0.58±0.08)g,P<0.05,平均抑瘤率为63.79%; 同时敲除URG11能显著减少异种移植肿瘤的体积第21、28、35天的新生瘤体体积,实验组VS对照组:(258.33±0.24)mm3VS (512.86±0.18)mm3,(414.59±0.17)mm3VS (685.78±0.23)mm3, (423.21±0.36)mm3VS (986.73±0.14)mm3,P<0.05(图3)。

A.

B.

C.

A.
B.
3 讨 论
上皮-间质转化(EMT)是癌转移的重要事件,可增强癌细胞的侵袭能力。由于肿瘤转移和复发率高,NSCLC患者的长期存活率较低,而肿瘤细胞的侵袭性生长是影响NSCLC患者预后的关键因素。因此,鉴定预测NSCLC侵袭和预后的生物标志物至关重要。有研究发现URG11在细胞粘附,迁移和EMT方面起重要作用[22]。在前列腺癌、胃癌、肝癌和胰腺癌中,URG11过度表达并调节癌细胞的增殖和分化[11,23-25]。然而URG11在NSCLC中的作用尚未见相关报道。本实验的裸鼠成瘤研究数据表明URG11促进NSCLC侵袭生长的证据,敲除URG11基因可以抑制NSCLC的侵袭性生长。笔者等的前期研究表明,URG11在NSCLC中异常表达,URG11的高表达与NSCLC的高侵袭和差预后相关,而敲除URG11 能显着抑制NSCLC细胞的增殖,迁移/侵袭[18]。据此,笔者等推测URG11可能参与了NSCLC的肿瘤发生,可能是潜在的NSCLC的生物标志物。上述研究结果表明URG11可能在NSCLC的发生发展中发挥重要作用。
Wnt/β-catenin信号通路在促进肿瘤发展、癌细胞增殖扩散和侵袭性生长中起重要作用[10,26-27]。 β-Catenin是Wnt信号通路关键的末端成分,可以调节下游基因cyclinD1,c-Myc和基质金属蛋白酶-7 的表达,导致癌细胞增殖失控和侵袭性生长[28]。近期有研究表明,Wnt/β-catenin信号传导通路与NSCLC肿瘤的发生关系密切[29]。在两种主要NSCLC细胞系中观察到 β-Catenin启动子的高甲基化,β-Catenin的缺失与多种癌症的淋巴结转移和偏晚的TNM分期相关,并且和NSCLC预后不良密切相关[29]。Akiri等证实β-Catenin在NSCLC细胞系和原发性NSCLC中过量表达,下调Wnt信号传导通路的活性,可以抑制 NSCLC增殖,并诱导更加高分化的肿瘤表型[30]。还有研究表明,内源性URG11表达,降低了活化的β-Catenin/TCF及其下游效应基因cyclinD1和膜型金属蛋白酶1(membrane type-1 matrix metalloproteinase, MT1-MMP)在胃癌细胞中的表达[11]。与上述研究结果一致,本研究实验结果发现,敲除URG11抑制了β-Catenin,c-Myc和cyclinD1在NSCLC细胞中的表达。
URG11诱导EMT的重要机制是β-Catenin介导的转录程序。URG11可以反式激活β-Catenin并促进β-Catenin介导的转录[33]。β-Catenin是贴壁细胞间的连接部位,它能通过连接上皮和E-钙粘蛋白的细胞内结构域促进细胞粘附,也可以通过结合TCF/LEF转录因子来激活转录[31]。有研究表明,β-Catenin介导的转录可诱导Slug[32]和Twist1[33]的表达,从而导致EMT。还有研究[34]发现URG11过表达增加β-Catenin转录,促进β-Catenin/TCF活性,从而诱导表达间质细胞标志物a-SMA和波形蛋白。本研究发现,敲除URG11抑制了β-Catenin,c-Myc和细胞周期蛋白D1在NSCLC细胞中的表达。因此笔者等初步推论:在NSCLC中URG11过表达反式激活β-Catenin并促使其向细胞核内转移,从而导致β-Catenin/TCF靶基因表达上调,引起上皮细胞向间质细胞转变(即 EMT),最终通过EMT增强癌细胞侵袭能力。
总之,本实验选择人NSCLC细胞系作为研究对象,通过基因敲除URG11,细胞培养和裸鼠移植瘤模型,从转录水平评价URG11对β-catenin及下游靶基因cyclin D1、c-myc的上调作用,观察 URG11 对β-catenin蛋白的表达量和细胞定位变化的影响,以阐明URG11的高表达与NSCLC的高侵袭和差预后相关,URG11对NSCLC的促进作用在于其反式激活Wnt信号通路的枢纽蛋白β-Catenin并促使其向细胞核内转移,从而导致β-Catenin/TCF靶基因表达上调,最终引起上皮细胞向间质细胞转变(EMT),即EMT最终导致了NSCLC的发生和进展。
