不同途径移植骨髓间充质干细胞对慢性肾病大鼠肾脏纤维化的影响
2021-10-27李嘉琦杨扬李天祎杨素萍夏春娟王家平
李嘉琦,杨扬,李天祎,杨素萍,夏春娟,王家平△
慢性肾脏病(chronic kidney disease,CKD)是一类发病率和病死率较高的慢性疾病[1]。研究显示,炎症反应导致的肾间质纤维化是CKD 主要的进展途径之一,而炎症小体激活后释放的促炎细胞因子可促进纤维化的形成,其中核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like protein 3,NLRP3)炎症小体已被证实与肾间质纤维化的发展有关[2]。随着再生医学的发展,干细胞疗法展现出良好的应用前景。目前,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)被广泛研究,其调节免疫、抗炎等功能在多种疾病中可发挥修复作用[3]。但是,BMSCs 能否通过抑制NLRP3 炎症小体来修复肾间质纤维化尚不明确。本研究旨在探讨BMSCs 对阿霉素所致CKD大鼠肾脏的修复作用及其减轻纤维化的可能作用机制。
1 材料与方法
1.1 材料 50 只清洁级SD 雄性大鼠购自昆明医科大学实验动物中心。其中2 只4 周龄大鼠提供骨髓供体干细胞;余48 只8 周龄大鼠,体质量(300.18±14.27)g,其中36 只用于造模,12只作为假手术(SHAM)组。阿霉素购自Sigma公司;低糖培养基(L-DMEM)、胎牛血清(FBS)购自美国Gibco 公司;BMSCs 成骨成脂诱导分化培养基购自赛业(苏州)生物科技公司;HE染色试剂盒、Masson染色试剂盒、0.25%胰蛋白酶购自武汉塞维尔生物科技公司;NLRP3、凋亡相关微粒蛋白[apoptosis-associated speck-like protein containing Caspase recruitment domain(CARD),ASC]、半胱氨酸天冬氨酸蛋白酶-1(cysteinyl aspartate specific proteinase-1,Caspase-1)抗体购自赛默飞世尔科技有限公司;自动生化分析仪(日立7170型,日本)。
1.2 BMSCs 制备 2 只4 周龄健康雄性SD 大鼠脱颈处死后置于75%乙醇中浸泡5 min。剪断股骨、胫骨骨骺端,参照文献[4]分离培养BMSCs。用倒置相差显微镜观察细胞形态及生长方式,取第3代细胞进行成骨、成脂诱导分化培养,流式细胞仪鉴定细胞表面抗原CD29、CD44、CD45及CD11b阳性率,合格的BMSCs应表达CD29和CD44,而不表达CD45和CD11b[5]。细胞传代至4~6代,取生长至80%~90%融合的细胞备用。
1.3 CKD 模型制作及分组 48 只8 周龄大鼠适应性饲养1周,其中36 只通过左肾切除+多次尾静脉注射阿霉素进行CKD造模,大鼠全麻后俯卧位固定于超净台,逐层切开皮肤、肌肉,暴露左肾后切除;苏醒后尾静脉注入阿霉素造模,第一次剂量为3 mg/kg,2 周后同剂量再次注射;每周经眼内眦静脉取血检测肾功能,以血肌酐、尿素氮、24 h 尿蛋白升高,取肾切片HE 染色光镜观察符合慢性肾病改变为造模成功[6]。所有大鼠均造模成功,将大鼠根据随机数字表法分为模型(CKD)组、肾动脉移植BMSCs(A-M)组及尾静脉移植BMSCs组(V-M)组,每组12 只。余12 只为SHAM 组,不切除左肾,仅行开腹及剥离肾包膜操作。
1.4 各组干预方案 0.25%胰蛋白酶-EDTA将生长状况良好的BMSCs消化后加入L-DMEM培养基终止消化,1 500 r/min离心5 min,弃上清液后磷酸盐缓冲液(PBS)重悬细胞,吹打充分后制成2×106个/mL单细胞悬液保存备用。A-M组大鼠参照文献[7]在数字减影血管造影(digital subtraction angiography,DSA)透视下用无菌微导管(PE10)经左侧颈动脉插管至右肾动脉开口处,同时经导管推注少量肝素后再推注BMSCs悬液500 μL,术后逐层缝合切口并肌内注射80万U青霉素0.1 mL;V-M组大鼠腹腔注射10%水合氯醛(0.3 mL/kg)后俯卧位固定于操作台,经尾静脉注射等量BMSCs 溶液;Sham 组大鼠腹腔注射10%水合氯醛后俯卧位固定于操作台,经尾静脉注射500 μL生理盐水。
1.5 主要观测指标
1.5.1 大鼠血肌酐、尿素氮、24 h 尿蛋白检测 分别于BMSCs移植后第7、14天的前1 d,将各组大鼠放入代谢笼中,收集24 h 尿液并储存于-80 ℃冰箱。次日经尾静脉采血0.2 mL 常温静置 3 h,3 500 r/min 离心 15 min 分离血清,生化分析仪检测血肌酐、尿素氮和24 h尿蛋白。
1.5.2 肾脏组织病理损伤及纤维化程度检测 各组于治疗14 d末处死大鼠,迅速取出大鼠肾脏组织于10%福尔马林缓冲溶液中固定24 h,将石蜡包埋的肾组织切成4 μm薄片,苏木精和伊红(HE)染色、Masson三色染色,光学显微镜观察肾脏组织病理损伤及纤维化程度。参照Mizuguchi 等[8]方法对肾脏组织进行评分:0分为极少量或无病变;1分为轻度受损,纤维化范围0~25%;2分为中度受损,纤维化范围26%~50%;3分为重度受损,纤维化范围≥51%。
1.5.3 免疫组化检测肾组织中NLRP3、ASC、Caspase-1 表达情况 每组其余切片用免疫组织化学法染色。石蜡切片脱蜡至水,将组织切片放入盛满柠檬酸抗原修复缓冲液(pH=6.0)的修复盒中,修复盒行抗原修复并自然冷却后,切片放入3%过氧化氢溶液孵育25 min,洗涤3 次,用3%封闭缓冲液(BSA)均匀覆盖组织,室温封闭30 min。将切片稀释后分别与 NLRP3(1∶150)、ASC(1∶150)、Caspase-1(1∶150)抗体在4 ℃下孵育过夜。PBS漂洗3次,每次5 min,滴加与一抗相应种属的HRP 标记二抗(1∶150)覆盖组织,室温孵育50 min。滴加3,3′-二苯二甲酰肼(DAB)复染,梯度乙醇脱水后于光学显微镜下观察。
1.6 统计学方法 采用SPSS 23.0软件对数据进行分析。符合正态分布的计量资料采用均数±标准差()表示,多组间比较采用单因素方差分析,组间多重比较用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs 的分离纯化与鉴定 倒置显微镜下可见SD大鼠BMSCs为均匀贴壁生长的梭形细胞,呈漩涡状排列生长,传代至第3 代经流式细胞仪鉴定表型CD29 阳性率96.9%,CD44 阳性率98.9%,CD45 阳性率1.9%、CD11b阳性率2.2%,成骨、成脂诱导染色可见橘红色钙结节、红色脂滴形成,符合间充质干细胞的主要生物学特征,见图1。
2.2 各组大鼠血肌酐、尿素氮、24 h 尿蛋白情况比较 CKD组、V-M组及A-M组7 d和14 d的血肌酐、尿素氮、24 h 尿蛋白表达水平依次降低,但均高于SHAM组(P<0.05),见表1。
2.3 各组大鼠肾脏病理表现及纤维化程度 SHAM组HE染色未见明显病理改变,肾小球血管袢薄且清晰,肾小管形态正常,Masson三色染色未见胶原纤维沉积,纤维化评分0分;CKD组肾小球损伤部分可见空泡变性,系膜细胞和基质可见增生,出现局灶节段性硬化,肾小管萎缩,Masson 三色染色可见肾小球囊、小管间质周边大面积胶原增生,可见大量蓝色着染胶原纤维,纤维化评分 3 分;A-M 组、V-M 组可见肾小球可见不同程度萎缩,肾小管间质可见少量轻-中度淋巴细胞、浆细胞浸润并伴有结缔组织增生,其中 A-M 组病理学形态较 V-M 组轻微,A-M 组、V-M组Masson 三色染色均可见蓝色着染胶原纤维,V-M组纤维化评分2分,A-M组纤维化评分1分,见图2。
2.4 各组大鼠NLRP3、ASC、Caspase-1 表达水平比较 SHAM组大鼠NLRP3、ASC、Caspase-1表达均呈阴性;CKD 组、V-M 组、A-M 组大鼠 NLRP3、ASC、Caspase-1 表达均呈阳性,但阳性细胞数依次降低,见图3。
3 讨论
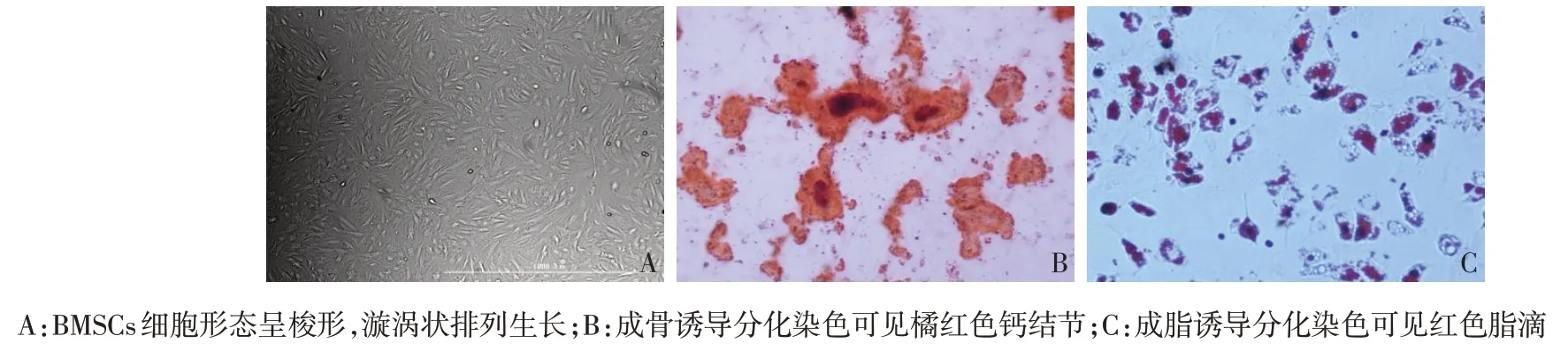
Fig.1 Morphology of the 3rd generation,staining for osteogenic differentiation and adipogenic differentiation(×100)图1 第3代BMSCs细胞形态、成骨诱导分化染色及成脂诱导分化染色(×100)
Tab.1 Comparison of serum creatinine,urea nitrogen and 24 h urinary protein after BMSCs transplantation between the four groups表1 各组大鼠血肌酐、尿素氮、24 h尿蛋白比较 (n=12,)
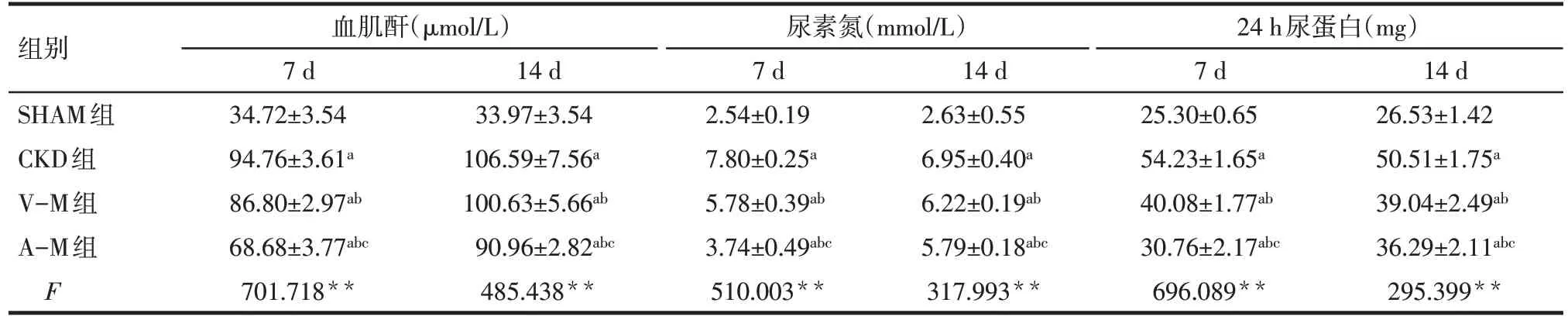
Tab.1 Comparison of serum creatinine,urea nitrogen and 24 h urinary protein after BMSCs transplantation between the four groups表1 各组大鼠血肌酐、尿素氮、24 h尿蛋白比较 (n=12,)
*P<0.05,**P<0.01;a与SHAM组比较,b与CKD组比较,c与V-M组比较,P<0.05
组别SHAM组CKD组V-M组A-M组F血肌酐(μmol/L)7 d 34.72±3.54 94.76±3.61a 86.80±2.97ab 68.68±3.77abc 701.718**14 d 33.97±3.54 106.59±7.56a 100.63±5.66ab 90.96±2.82abc 485.438**尿素氮(mmol/L)7 d 2.54±0.19 7.80±0.25a 5.78±0.39ab 3.74±0.49abc 510.003**14 d 2.63±0.55 6.95±0.40a 6.22±0.19ab 5.79±0.18abc 317.993**24 h尿蛋白(mg)7 d 25.30±0.65 54.23±1.65a 40.08±1.77ab 30.76±2.17abc 696.089**14 d 26.53±1.42 50.51±1.75a 39.04±2.49ab 36.29±2.11abc 295.399**

Fig.2 Pathological manifestations of renal tissues in the four groups(×200)图2 各组大鼠肾组织病理表现(×200)

Fig.3 Immunohistochemical staining results of NLRP3,ASC and Caspase-1 in the four groups(×200)图3 各组大鼠NLRP3、ASC、Caspase-1免疫组化染色结果(×200)
CKD 容易进展为终末期肾病(end stage renal disease,ESRD),后者往往需要透析、肾移植等肾替代疗法。维持性透析治疗不能完全替代肾脏功能,而肾移植由于供体、费用问题也不能广泛开展。BMSCs因其易于取材、体外扩增方便、具有多向分化潜能,成为疾病治疗的新选择。目前,常用的BMSCs移植途径包括静脉途径、动脉途径和局部注射,然而不同途径对BMSCs 的治疗效果的影响不同,对于移植途径仍然存在争议。李芳等[9]在用脐带血干细胞治疗犬肾损伤模型中发现,动脉途径和静脉途径治疗效果无明显差别。龚勇泉等[10]在小鼠心脏移植模型中发现,BMSCs 动脉途径移植较静脉及心肌局部注射更能延长移植心脏存活时间。谢周滔等[11]在小鼠肾缺血再灌注模型中发现,静脉途径移植BMSCs较动脉途径效果更佳,创伤较小。因此,BMSCs通过何种移植途径能较好地改善CKD 大鼠肾功能及其减轻或延缓肾间质纤维化的机制尚有待进一步研究。本研究结果显示,A-M 组、V-M 组与 CKD 组相比肾功能(血肌酐、尿素氮、24 h 尿蛋白)改善,A-M组效果优于 V-M 组;HE 染色、Masson 三色染色显示,BMSCs移植后肾脏炎性浸润减轻,纤维化程度降低,A-M 组改善程度优于V-M 组,表明经肾动脉途径移植效果优于经尾静脉途径。笔者分析可能与移植细胞在体内分布数量不同有关,通过介入方法经动脉途径注射后大量干细胞可直接进入受损肾组织,避免了外周静脉途径所必经的肺循环过程,增加了归巢细胞数量。传统的直接肾动脉穿刺途径注射虽然在实验中可行,但在实际操作中存在一些限制,如大鼠体积较小,穿刺可能撕裂肾动脉,造成术中大出血或者肾动脉内膜损伤,进而导致肾动脉狭窄,甚至闭塞。因此,相较于传统开腹直接注射方法,本研究通过介入途径经左颈总动脉肾动脉途径注入BMSCs有着精准、微创的优势。
现代医学认为,持续性炎症是慢性肾损伤重要标志,无菌性炎症是CKD的临床特征[12]。炎症小体是Nod样受体家族蛋白与PYHIN家族蛋白组成的细胞质多蛋白复合物,在先天免疫中起重要作用,其中NLRP3炎症小体在调节炎症反应及肾间质纤维化中的作用受到广泛关注。NLRP3 炎症小体由NLRP3、ASC 和 pro-caspase-1 构成。研究发现,至少有 2 种信号是NLRP3炎症小体激活所必需:(1)由Toll样受体或细胞因子如肿瘤坏死因子α识别的微生物配体介导,激活核因子途径,引起NLRP3蛋白水平上调。(2)由各种病原相关分子模式和损伤相关分子模式刺激介导,进而促进ASC 和pro-Caspase-1 的组装,诱导NLRP3炎症小体活化[13]。因此,在慢性肾损伤过程中会有NLRP3、ASC、Caspase-1 的阳性表达水平的升高。Ke 等[14]发现,在 CKD 患者的肾脏中,NLRP3和Caspase-1的表达水平显著升高,表明活化的NLRP3 炎症小体可能参与肾间质纤维化调节。部分研究发现,NLRP3 炎症小体可导致5/6 肾切除模型和晶体性肾病的肾间质纤维化[15-16]。研究显示,小鼠敲除NLRP3基因或使用NLRP3炎症小体活性抑制剂MCC950 抑制炎症小体表达后,小鼠肾间质纤维化程度均减轻[17-18]。本研究结果发现,NLRP3、ASC、Caspase-1 在单侧肾切除并多次阿霉素注射的肾间质纤维化模型中表达呈阳性,表明其参与了肾间质纤维化的进程;免疫组化结果显示,BMSCs 移植后NLRP3、ASC、Caspase-1 表达降低,故笔者推测BMSCs 可能通过抑制NLRP3 炎症小体活性来减轻大鼠的肾间质纤维化。
综上所述,BMSCs移植疗法可改善大鼠肾功能,减轻组织纤维化程度,且经肾动脉途径移植优于经尾静脉途径。单侧肾切除并多次阿霉素注射的肾间质纤维化模型中NLRP3炎症小体成分增加。BMSCs可能是通过降低NLRP3、ASC、Caspase-1 表达来改善CKD大鼠肾功能。
