双黄连冻干粉通过抑制MEK-ERK信号通路诱导急性淋巴细胞白血病Nalm6细胞凋亡
2021-10-27杨友钟芳芳黄喆覃祥马文哲刘文君
杨友 ,钟芳芳,黄喆,覃祥 ,马文哲 ,刘文君 △
急性淋巴细胞白血病(acute lymphocytic leukemia,ALL)由造血干祖细胞无限增殖所致,是儿童最常见的恶性肿瘤,目前治疗方式主要为化疗。在过去的20 年中,儿童ALL 的治疗取得了显著进展,5年生存率约80%[1];但化疗药物不良反应大,复发和耐药仍是目前需要克服的难题。双黄连(SHL)由金银花、黄芩和连翘3味中药配伍组成,具有疏风解表、清热解毒之功效。既往SHL 在抗细菌和病毒方面报道众多。研究发现,其对肺炎克雷伯菌[2]、支原体[3]等细菌有抑制作用;同时SHL 含有多种抗病毒成分[4],对人腺病毒Ⅲ[5]、甲型H1N1 流感病毒[6]、甲型H5N1 流感病毒[7]和新型冠状病毒(SARS-CoV-2)[8]等多种病毒均有明显抑制效果。在抗肿瘤方面,SHL 可抑制结肠癌[9]和肺腺癌[10]的增殖。目前尚未见SHL抗白血病作用的报道。丝裂原活化蛋白激酶(MAPK)级联反应是调节多种细胞生物学过程的关键信号通路。丝裂原活化蛋白激酶激酶-细胞外信号调节激酶(MEK-ERK)是其中的一条信号通路,可以调控细胞增殖、凋亡、分化等[11]。有研究发现,MEK/ERK信号转导通路激活可以促进白血病细胞 THP-1、KG-1、HL-60、Jurkat 等增殖,抑制 K562细胞凋亡,促进血管生成与肿瘤细胞转移[12]。本文通过探讨SHL对急性B淋巴细胞白血病Nalm6细胞MEK/ERK信号通路的影响,旨在为SHL治疗ALL提供理论依据。
1 材料与方法
1.1 细胞 人急性B 淋巴细胞白血病细胞(Nalm6)、人急性T 淋巴细胞白血病细胞(Jurkat、Molt4)以及急性髓系白血病细胞(KG1a)均购自中国科学院上海药物研究所。
1.2 药物与试剂 注射用双黄连(冻干)购自哈药集团中药二厂有限公司(批号:Z10960058;规格:600 mg/支);泛凋亡抑制剂苄氧羰基-VAL-ALA-ASP-氟甲基酮(Z-VAD-FMK)[13]购自美国MedChemExpresss 公司,胎牛血清购自美国Gibco公司;RPMI 1640 培养液购自美国Hyclone 公司;磷酸盐缓冲液(PBS)购自北京百灵克公司;Annexin V-APC 凋亡检测试剂盒购自美国Becton Dickinson 公司;hoechest33342 购自德国赛诺菲公司;CCK-8细胞增殖检测试剂盒购自日本同仁公司;鼠源 β-actin 一 抗 ,兔 源 cleaved Caspase-3、cleaved Caspase-9、cleaved PARP、tBid、ERK、p-ERK、MEK、p-MEK、c-Myc一抗及相应二抗购自Cell Signaling 公司。
1.3 仪器 倒置荧光显微镜购自日本Olympus公司;细胞培养箱购自美国Thermo公司;AIR-TECH医用净化工作台购自苏州净化设备公司;流式细胞仪购自美国ACEA NovoCyte 公司,酶标仪购自美国Awareness 公司;CO2细胞培养箱购自美国SHEL-LAB公司。
1.4 方法
1.4.1 细胞株培养 用含有10%胎牛血清、1%青链霉素的RPMI 1640 培养液培养细胞,在37 ℃、5%CO2和95%湿度的培养箱中培养传代,取对数生长期细胞进行后续实验。
1.4.2 CCK-8法检测细胞增殖 CCK-8测定共分为7组,其中使用不同浓度药物梯度6 组,空白对照1 组。取对数生长期的4 种细胞,1 000×g离心5 min,弃上清液,用含10%胎牛血清的RPMI 1640培养液重悬细胞至4×108个/L;按50 μL/孔接种于96孔板中,每组处理设置3个复孔;培养6 h后空白对照组每孔加入50 μL 细胞培养液,其他组分别加入50 μL SHL,使SHL 终浓度分别为0.025、0.05、0.1、0.2、0.4、0.8 g/L。培养24 h后,加入10 μL的CCK-8试剂,孵育4 h后酶标仪测定450 nm 波长处光密度(OD)值,实验重复3 次,取3 孔平均值。按公式算出细胞增殖抑制率,细胞增殖抑制率=[(对照组平均 OD 值-实验组平均 OD 值)/空白组平均 OD 值]×100%,并计算半数抑制浓度(IC50)。
1.4.3 流式细胞术检测细胞周期分布及凋亡 将细胞以每孔2×106个接种于6 孔板中,分别加入不同浓度的SHL 使其终浓度为0、0.1、0.2、0.4 g/L,温育24 h 后,收取细胞并用PBS洗涤2 次。500 μL 结合缓冲液重悬细胞,分别加入10 μL Annexin V-FITC和5 μL PI混匀,室温避光反应15 min。上流式细胞仪检测细胞凋亡百分比。不同浓度的SHL处理后,收取细胞,用PBS洗涤2次,加入70%的预冷乙醇充分混匀,放入-20 ℃固定 6 h 后用 PBS 洗涤 2 次,加入 400 μL 的 PI 染液(50 g/L),100 μL 的RNase A(100 g/L),4 ℃避光孵育30 min后用 PBS 洗涤 1 次,加入 500 μL 的 PBS 混悬细胞,上流式细胞仪检测细胞周期百分比。所有实验均重复3次,取平均值。
1.4.4 Hoechst 33342 染色观察细胞凋亡形态 Nalm6 细胞经0、0.1、0.2、0.4 g/L的SHL处理24 h,收取细胞用PBS洗涤2次,加入4%多聚甲醛固定10 min,PBS 洗涤后加入Hoechst 33342 荧光染料(50 g/L),室温避光孵育5 min,涂片,于荧光显微镜下观察、照相,实验重复3次。
1.4.5 Western blot检测蛋白表达 Nalm6细胞经0、0.1、0.2、0.4 g/L的SHL处理24 h,收取细胞用PBS洗涤2次,加入蛋白裂解液提取细胞总蛋白。二喹啉甲酸(BCA)法蛋白定量后行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、转膜、洗膜,5%脱脂奶粉室温封闭1 h;分别加入1∶2 000 稀释的tBid、cleaved Caspase-9、cleaved Caspase-3、cleaved PARP、MEK、ERK、p-MEK、p-ERK、c-Myc、β-actin 单克隆抗体于4 ℃孵育过夜。次日洗膜后加入IRDye TM800CW 染料标记的山羊抗兔或山羊抗鼠二抗(1∶1 000 稀释),室温孵育1 h,TBST 洗涤3 次,每次10 min,用双红外激光扫描成像系统进行荧光显色及分析,所有实验均重复3次。
1.4.6 Z-VAD-FMK预处理后流式细胞术检测Nalm6细胞凋亡水平变化 Nalm6细胞经Z-VAD-FMK(20 μmol/L)预处理4 h 后,加入SHL(0.2 g/L)处理24 h,通过流式细胞仪检测细胞凋亡,检测方法同1.4.3。
1.5 统计学方法 采用SPSS 21.0软件进行数据处理。符合正态分布的计量数据以均数±标准差()表示,多组间均数比较采用单因素方差分析,组间多重比较采用SNK-q法,P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度SHL 对急性白血病细胞增殖能力的影响 CCK-8 检测结果显示,SHL 能抑制 Nalm6、Jurkat、Molt4 以 及 KG1a 的 增 殖(图 1)。 SHL 对Nalm6、Jurkat、Molt4、KG1a 的IC50(g/L)分别为0.11±0.01、0.29±0.01、0.25±0.01、0.32±0.04。其中 SHL 对Nalm6 的IC50最低,抑制增殖效果更强,因此选取Nalm6 细胞进行后续实验。此外,结合细胞增殖实验的浓度设置以及Nalm6的IC50,选取SHL质量浓度为0.1、0.2、0.4 g/L。
2.2 不同浓度SHL 对Nalm6 细胞周期的影响 流式细胞周期分析显示,0.1、0.2、0.4 g/L SHL 对Nalm6的细胞周期分布无明显影响(P>0.05),见图2、表1。
2.3 不同浓度SHL 对Nalm6 细胞凋亡的影响 流式细胞凋亡分析显示,空白对照组及SHL 0.1、0.2、0.4 g/L 组总凋亡率(%)分别为 2.13±0.12、30.07±3.87、64.35±0.47、90.27±0.43,与空白对照组相比,SHL 各剂量组细胞总凋亡率均明显升高,且随着SHL浓度升高,细胞总凋亡率明显升高(F=544.600,P<0.01),见图3。

Fig.1 Cell proliferation inhibition rates of different concentrations of SHL in acute leukemia cells图1 不同浓度SHL对急性白血病细胞的增殖抑制率

Fig.2 Cell cycles of Nalm6 cells induced by different concentrations of SHL图2 不同浓度SHL对Nalm6细胞周期的影响
Tab.1 Cell cycles of Nalm6 cells induced by different concentrations of SHL表1 不同浓度SHL对Nalm6细胞周期的影响(n=3,%,)
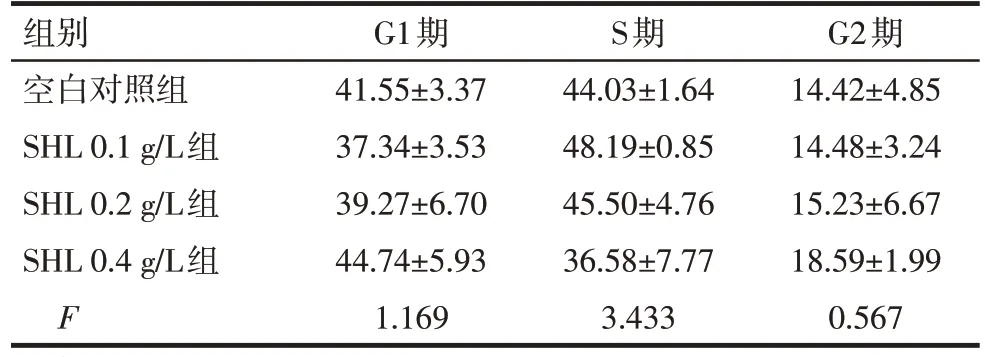
Tab.1 Cell cycles of Nalm6 cells induced by different concentrations of SHL表1 不同浓度SHL对Nalm6细胞周期的影响(n=3,%,)
均P>0.05
组别空白对照组SHL 0.1 g/L组SHL 0.2 g/L组SHL 0.4 g/L组F G1期41.55±3.37 37.34±3.53 39.27±6.70 44.74±5.93 1.169 S期44.03±1.64 48.19±0.85 45.50±4.76 36.58±7.77 3.433 G2期14.42±4.85 14.48±3.24 15.23±6.67 18.59±1.99 0.567

Fig.3 Apoptosis of Nalm6 cells induced by different concentrations of SHL图3 不同浓度SHL对Nalm6细胞凋亡的影响
2.4 不同浓度SHL 诱导Nalm6 细胞凋亡的形态学改变 Nalm6 细胞经Hoechst 33342 荧光染色后发现,SHL处理24 h后细胞形态发生明显改变,细胞核内可见浓染致密的蓝色颗粒荧光,呈现核固缩、核碎裂等细胞核形态改变,见图4。空白对照组及SHL 0.1、0.2、0.4 g/L 组凋亡细胞数(个/视野)分别为0.33±0.58、5.67±1.53、10.33±1.53、18.67±2.52。与空白对照组相比,SHL 各剂量组细胞凋亡细胞数逐渐增多(F=63.950,P<0.01)。
2.5 不 同 浓 度 SHL 对 Nalm6 细 胞 tBid、cleaved Caspase-3、cleaved Caspase-9 和 cleaved PARP 蛋白表达的影响 Western blot结果显示,经SHL处理24 h后,与空白对照组相比,SHL 0.1、0.2、0.4 g/L 组的tBid、cleaved Caspase-9、cleaved PARP 蛋白表达升高,SHL 0.2、0.4 g/L组cleaved Caspase-3蛋白的相对表达量升高。SHL 0.1~0.4 g/L 浓度范围内,随着处理浓度的升高,tBid、cleaved Caspase-9、cleaved Caspase-3、cleaved PARP蛋白表达水平逐渐升高,差异均有统计学意义(P<0.05),见图5、表2。

Fig.4 Morphological changes of Nalm6 cell apoptosis induced by different concentrations of SHL(×400)图4 不同浓度SHL诱导Nalm6细胞凋亡的形态学变化(×400)

Fig.5 Effects of different concentrations of SHL on expression levels of apoptosis related proteins in Nalm6 cells图5 不同浓度SHL对Nalm6细胞凋亡相关蛋白的影响
Tab.2 Changes in apoptosis-related proteins induced by different concentrations of SHL in Nalm6 cells表2 不同浓度SHL诱导Nalm6细胞凋亡相关蛋白的变化(n=3,)

Tab.2 Changes in apoptosis-related proteins induced by different concentrations of SHL in Nalm6 cells表2 不同浓度SHL诱导Nalm6细胞凋亡相关蛋白的变化(n=3,)
**P<0.01;a与空白对照组比较,b与SHL 0.1 g/L 组比较,c与SHL 0.2 g/L组比较,P<0.05
组别空白对照组SHL 0.1 g/L组SHL 0.2 g/L组SHL 0.4 g/L组F tBid 0.51±0.03 0.67±0.02a 0.78±0.01ab 0.83±0.05abc 1284.000**cleaved Caspase-9 0.10±0.02 0.50±0.03a 0.85±0.05ab 0.92±0.02abc 401.800**cleaved Caspase-3 0.13±0.02 0.16±0.03 0.19±0.02ab 0.25±0.01abc 22.320**cleaved PARP 0.31±0.01 0.46±0.02a 0.59±0.01ab 0.67±0.04abc 928.500**
2.6 不同浓度SHL对Nalm6细胞中MEK-ERK信号通路蛋白表达的影响 Western blot 结果显示,经SHL 处理24 h 后,与空白对照组相比,SHL 0.1、0.2、0.4 g/L 组 p-MEK/MEK、p-ERK/ERK、c-Myc 蛋白表达均明显下降(P<0.05);0.1~0.4 g/L 范围内,随着SHL 浓度的升高,p-MEK/MEK、p-ERK/ERK、c-Myc蛋白表达逐渐下降,差异均有统计学意义(P<0.05),见图6、表3。

Fig.6 Effects of different concentrations of SHL on expression levels of MEK-ERK signaling pathway proteins in Nalm6 cells图6 不同浓度SHL对Nalm6细胞MEK-ERK信号通路蛋白表达的影响
Tab.3 SHL induced changes in MEK-ERK signaling pathway proteins in Nalm6 cells表3 不同浓度SHL诱导Nalm6细胞中MEK-ERK信号通路蛋白的变化 (n=3,)

Tab.3 SHL induced changes in MEK-ERK signaling pathway proteins in Nalm6 cells表3 不同浓度SHL诱导Nalm6细胞中MEK-ERK信号通路蛋白的变化 (n=3,)
**P<0.01;a与空白对照组比较,b与SHL 0.1 g/L 组比较,c与SHL 0.2 g/L组比较,P<0.05
组别空白对照组SHL 0.1 g/L组SHL 0.2 g/L组SHL 0.4 g/L组F p-MEK/MEK 0.87±0.01 0.75±0.02a 0.46±0.01ab 0.29±0.02abc 785.400**p-ERK/ERK 0.82±0.03 0.77±0.01a 0.67±0.02ab 0.37±0.01abc 1 927.000**c-Myc 0.79±0.01 0.59±0.02a 0.42±0.01ab 0.35±0.03abc 1 585.000**
2.7 凋亡抑制剂Z-VAD-FMK 对SHL 冻干粉诱导Nalm6 细胞凋亡的影响 Z-VAD-FMK 是泛凋亡抑制剂,在加或不加Z-VAD-FMK(20 μmol/L)预处理4 h 的 Nalm6 细胞中加入 SHL(0.2 g/L)处理 24 h 后,细胞凋亡检测结果显示,在Z-VAD-FMK 未预处理Nalm6 细胞中,SHL 作用后的细胞总凋亡率为(64.42±3.71)%,而 Z-VAD-FMK 预处理的细胞在SHL作用后的细胞总凋亡率为(31.15±1.10)%,差异有统计学意义(t=14.892,P<0.05),见图7。
3 讨论
目前急性B淋巴细胞白血病的治疗手段主要是联合化疗,但患者用药后不良反应大,易产生耐药。本研究通过CCK-8法、流式细胞术检测证实SHL可以抑制急性白血病细胞(Nalm6 Jurkat、Molt4、KG1a)增殖,诱导急性B 淋巴细胞白血病细胞(Nalm6)凋亡,推测其可能具有抗白血病的作用。
凋亡细胞内染色质聚集,经核碎裂形成大小不等的染色质块,然后整个细胞通过出芽、起泡等方式形成一个球形凋亡小体,凋亡小体的形成是细胞发生凋亡的标志[14]。本研究通过 Hoechst 33342 荧光染色后观察到随着SHL 处理浓度增加,Nalm6 凋亡细胞明显增多。凋亡又分为外源性凋亡和内源性凋亡[15]。在本研究中,Nalm6经SHL处理后,促凋亡相关蛋白tBid、cleaved Caspase-9、cleaved Caspase-3以及cleaved PARP 表达均显著增高。tBid是由于外源性凋亡途径中Capsase-8 对Bid 进行切割以后形成的,随后tBid 转移到线粒体外膜(OMM)上激活Caspase-9依赖的活化结构[15],从而激活Caspase-9-Caspase-3 级联反应使 PARP 增加[16],导致外源性细胞凋亡。因此,SHL 可能通过外源性凋亡途径诱导Nalm6 凋亡;同时,用凋亡抑制剂 Z-VAD-FMK 预处理Nalm6后再加用SHL,Nalm6细胞凋亡率较单独使用SHL处理组下降,凋亡被抑制,再次确认SHL诱导Nalm6细胞的死亡方式可能是通过细胞凋亡。
MAPKs 家族蛋白由 ERK1/2、p38、c-Jun 氨基末端激酶(JNK12-13)和ERK5等分子组成。这些丝氨酸/苏氨酸激酶可被 MEK 激活,而 MEK1 和 MEK2 是ERK1/2的特定激活剂[17]。c-Myc作为MEK-ERK信号通路下游的靶基因,其活性增加会促进肿瘤的增殖和侵袭[18]。MEK-ERK 信号通路的激活最终促进了癌细胞增殖、迁移和血管生成[19],目前已有2 种MEK 抑制剂(trametinib 和cobimetinib)被批准用于临床治疗,而ERK抑制剂仍在进行临床试验[20]。本研究发现,SHL可以通过抑制MEK-ERK 信号通路,下调Nalm6 细胞中c-Myc 蛋白的表达。因此,SHL有可能作为治疗急性细胞白血病的潜在药物,但SHL进入细胞后的具体的作用靶点及其机制仍需要深入探究。

Fig.7 Effects of Z-VAD-FMK on apoptosis of SHL-treated Nalm6 cells图7 Z-VAD-FMK对SHL诱导Nalm6细胞凋亡的影响
综上所述,SHL可抑制Nalm6细胞增殖,并通过上调tBid、cleaved Caspase-9、cleaved Caspase-3以及cleaved PARP 等相关凋亡蛋白的表达诱导细胞凋亡,其作用机制可能与抑制MEK-ERK 信号通路有关。
