EM患者子宫内膜组织的ESCs中miR-539表达水平及其靶向MMP-9对ESCs侵袭和迁移的影响
2021-10-27肖田廉红梅
肖田 ,廉红梅
子宫内膜异位症(endometriosis,EM)常见于育龄妇女,是一种良性、慢性的妇科疾病,具有雌激素依赖性,以存在侵袭性异位内膜为特征,且与许多临床症状和体征密切相关,如盆腔疼痛、痛经、不孕和性交困难等[1-2]。关于EM 的发病机制有3 种学说,其中最有说服力的是月经逆行学说,即子宫内膜碎片植入子宫外部,如腹膜和腹部器官,尤其是卵巢[3]。细胞迁移和侵袭在子宫内膜异位囊肿的形成中起重要作用,但其分子机制尚不清楚。因此,需要进一步探讨EM 的发病机制,以找到更有针对性的治疗方法。EM表现为良性形态,然而子宫内膜基质细胞(endometrial stromal cells,ESCs)具有侵袭潜能,EM 常表现出一些恶性特征,如侵袭性增加、血管生成异常以及组织粘连广泛[4]。已有研究表明,基质金属蛋白酶(matrix metalloproteinases,MMPs)可能在EM 的发病机制中起重要作用。MMPs 可通过降解细胞外基质促进细胞迁移和侵袭,并广泛参与血管重塑,这些是EM 形成的必要过程[5]。微小RNA(microRNA,miRNA,miR)是一种小的非编码RNA,在调节细胞增殖、凋亡、细胞周期、免疫反应和炎症的基因表达中发挥重要作用[6]。MiRNA的失控和异常表达与人类多种疾病有关[7]。MiR-539具有抑制乳腺癌、非小细胞肺癌、肝细胞癌等多种肿瘤细胞侵袭和迁移的作用[8],且经生物信息学检测后发现,miR-539 与 MMP-9 的 3′- 非翻译区(untranslated region,UTR)具有结合位点,两者具有明显的靶向关系。本研究通过检测miR-539 在EM 患者子宫异位组织以及正常子宫内膜组织中的表达,探讨miR-539靶向MMP-9对ESCs侵袭和迁移的影响。
1 资料与方法
1.1 一般资料 纳入湖北省妇幼保健院2016年10月—2020年 1 月收治的 EM 患者 60 例,年龄 24~46 岁,平均(30.56±3.81)岁。依据修订后的美国生育学会子宫内膜异位症(rAFS)分期评定为Ⅰ~Ⅱ期24 例,Ⅲ~Ⅳ期36 例。患者手术前至少3个月未接受激素治疗,且无其他盆腔病变。收集以上患者术中子宫内膜异位组织,设为EM组。另取47例年龄匹配的子宫肌瘤等良性妇科疾病患者的正常子宫内膜组织设为对照组。以上组织样品均在无菌条件下采集,并送到实验室进一步处理。本研究经本院伦理委员会批准(文号:160805-1),取得所有研究对象知情同意。
1.2 主要试剂和仪器 Lipofectamine 3000 试剂盒(L3000001)购自 Thermo Fisher Technology 公司。RNA 提取试剂盒(货号:DP419)购自北京天根生化科技有限公司。PrimeScript RT 试剂盒(货号:RR036)及实时荧光定量PCR(qPCR)试剂盒(货号:RR820)购自宝日医生物技术(北京)有限公司。双荧光素酶报告基因检测试剂盒(货号:D0010)购自北京索莱宝生物科技有限公司。miR-539 mimics、miR-539 inhibitors及其阴性对照由广州锐博生物科技有限公司合成 。 miR-539 mimics 序 列 :上 游 5′-GGAGAAAUUAUCCUUGGUGUGU-3′;下 游 5′-ACACCAAGGAUAAUUUCUCCAUU-3′,双链。对照序列:上游5′-GCCCUACAACUCCCACUCUGUAC-3′ ;下 游 5′-AUUGCCCAAAUAACCGCUACCGU-3′。 miR-539 inhibitor 序 列 :5′-ACACACCAAGGAUAAUUUCUCCC-3′;对照序列:5′-UCGGGCCUGGAUAGCCCGAUCU-3′,采用 2-O 甲氧基修饰。MMP-9 一抗、内参一抗及二抗均购自美国Cell Signaling Technology 公司。光学显微镜购自日本尼康公司;荧光定量PCR(qPCR)仪、蛋白电泳仪和转膜仪均购自美国Bio-Rad 公司;GIS-500 型凝胶成像仪购自杭州Miulab公司。
1.3 方法
1.3.1 细胞分离培养 清洗子宫内膜组织,切成小碎片,在37 ℃下于含有Ⅳ型胶原酶(1 g/L)的DMEM/F12 培养基中孵育35 min。然后,使用400 目尼龙细胞过滤器过滤分离分散的子宫内膜细胞,离心后收集滤液中的基质细胞,并将其重悬于含有10%FBS 的DMEM/F-12 培养基中,37 ℃、5%CO2条件下培养12 h。根据人波形蛋白阳性和人角蛋白阴性的细胞染色,结果显色,ESCs的纯度高于95%[9]。
1.3.2 qPCR检测miR-539和MMP-9 mRNA的表达水平 使用RNA 提取试剂盒提取2 组ESCs 中的RNA,并利用分光光度计测定RNA 浓度。然后使用PrimeScript RT 试剂盒反转录成cDNA。miR-539的反转录引物为5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACACACAC-3′,U6 的反转录通用引物为5′-AACGCTTCACGAATTTGCGT-3′。然后使用qPCR 仪进行检测。反应条件:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火30 s,45 个循环;72 ℃延伸1 min。以 U6 和 β-actin 为内参基因,采用 2-ΔΔCt对组织中miR-539 和MMP-9 mRNA 表达水平进行相对定量分析。根据基因库数据库中基因序列的公开数据设计引物,引物序列见表1。

Tab.1 qPCR primer sequence表1 qPCR引物序列
1.3.3 双荧光素酶报告基因检测 采用TargetScan 软件分析,预测miR-539和MMP-9 3′-UTR 存在结合位点。将含有miR-539 结合位点的野生型(WT)和突变型(MUT)MMP-9 3′-UTR基因序列插入荧光素酶报告基因的载体pGL3上,构建相应的质粒载体,然后将WT-MMP-9、MUT-MMP-9 分别与 miR-539 mimics、miR-539 NC 共转染 ESCs。48 h 后收集细胞,使用双荧光素酶检测试剂盒检测荧光强度。
1.3.4 细胞转染及分组 将EM 组的ESCs 混合培养至生长对数期,接种于6孔板上。利用Lipofectamine 3000试剂转染ESCs,并将其分为 miR-539 mimics 组、mimics NC 组、miR-539 inhibitors 组和 inhibitors NC 组。并在 37 ℃、5%CO2培养箱中培养,用于后续检测。细胞实验均设3个平行,重复实验2次,取其平均值。
1.3.5 CCK-8 检测细胞增殖 按照1.3.4 中方法转染细胞至96孔板中(每孔3 000个细胞)培养,24、48、72 h后,每孔中加入10 μL CCK-8 溶液。然后在37 ℃条件下继续培养4 h,使用酶标仪检测450 nm处光密度(OD)值。
1.3.6 划痕实验检测细胞迁移 将1.3.4 转染后的各组细胞培养在6孔板中,然后用200 μL吸管尖端划破细胞单层。用添加1%胎牛血清的DMEM/F12 培养基进行细胞培养,以减少细胞增殖的影响。在划后0 h和24 h用显微镜观察并拍摄具有代表性的图像。使用Image-Pro Plus分析软件对迁移距离进行定量,计算划痕愈合率=(0 h 划痕宽度-24 h 划痕宽度)/0 h划痕宽度×100%。
1.3.7 Transwell 检测细胞侵袭 将1.3.4 转染后的细胞悬液(2×104个细胞)100 μL等量放入Transwell板(含Matrigel基质胶)上室。下室装满700 μL 含10%FBS 的DMEM/F-12 培养基。在37 ℃、5%CO2条件下培养48 h后,取出上室,下室细胞用3.8%甲醛固定20 min 后,0.1%结晶紫染色。然后使用显微镜观察,并用Image-Pro Plus软件计数每个视野的细胞数。
1.3.8 Western blot法检测MMP-9蛋白表达水平 将转染后的细胞加入含有蛋白酶抑制剂的裂解液,然后使用蛋白提取试剂盒提取总蛋白,并检测蛋白含量。使用SDS-PAGE分离总蛋白,然后转移到PVDF 膜上。在室温下使用5%脱脂奶粉封闭1 h,然后将膜上的蛋白质与MMP-9 一抗以1∶1 000的稀释度在4 ℃下孵育过夜,TBST洗涤3次。在室温下与二抗孵育1 h,TBST洗膜。曝光显色,使用凝胶成像系统分析蛋白相对表达量,以β-actin为内参蛋白。
1.4 统计学方法 使用SPSS 22.0 软件进行数据分析,计量数据以均数±标准差()表示,2 组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 miR-539 和MMP-9 mRNA 表达水平变化 与对照组相比,EM 组miR-539 mRNA 水平显著降低,MMP-9 mRNA水平显著升高(P<0.01),见表2。
2.2 miR-539与MMP-9靶向关系的预测与验证 生物信息学预测结果显示,MMP-9 3′-UTR 序列上存在miR-539 连续的结合位点,见图1。与miR-539NC+WT-MMP-9 组 相 比 ,miR-539 mimics+WTMMP-9 组荧光素酶活性显著降低(P<0.05),miR-539 mimics+MUT-MMP-9 组和miR-539 NC+MUTMMP-9 组荧光素酶活性无明显变化(P>0.05),见图2。
Tab.2 Comparison of miR-539 and MMP-9 mRNA expression levels between the two groups of ESCs表2 2组ESCs中miR-539和MMP-9 mRNA表达水平的比较 ()

Tab.2 Comparison of miR-539 and MMP-9 mRNA expression levels between the two groups of ESCs表2 2组ESCs中miR-539和MMP-9 mRNA表达水平的比较 ()
**P<0.01
组别n miR-539MMP-9 mRNA对照组EM组t 60 47 1.00±0.08 0.43±0.04 44.639**1.00±0.05 1.85±0.07 73.223**

Fig.1 The binding site of miR-539 and MMP-9 3′-UTR predicted by bioinformatics图1 生物信息学预测miR-539与MMP-9 3′-UTR结合位点
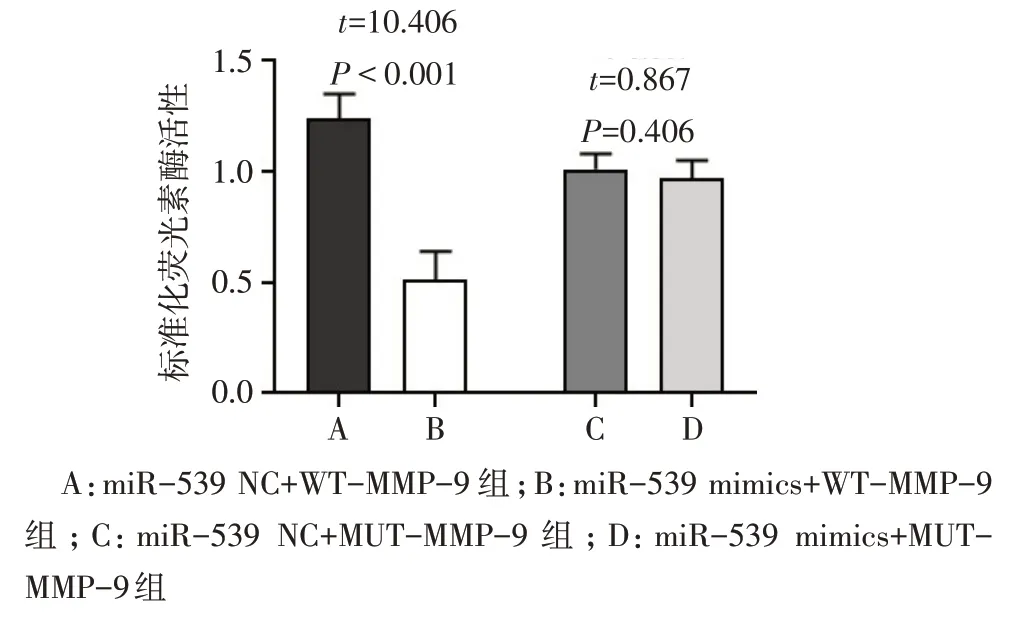
Fig.2 Comparison of the relative activity of luciferase between the four groups of ESCs(n=6)图2 4组ESCs细胞荧光素酶相对活性的比较(n=6)
2.3 miR-539 过表达对 EM 患者 ESCs 细胞增殖的影响 72 h 时,与 mimics NC 组相比,miR-539 mimics 组ESCs 细胞增殖能力显著降低(P<0.05);48、72 h 时 ,与 inhibitors NC 组 相 比 ,miR-539 inhibitors 组ESCs 细胞增殖能力显著升高(P<0.05),见图3。
2.4 miR-539 过表达对 EM 患者 ESCs 细胞迁移的影响 与 mimics NC 组相比,miR-539 mimics 组ESCs 细胞的划痕愈合率显著降低(P<0.05);与inhibitors NC 组相比,miR-539 inhibitors 组 ESCs 细胞的划痕愈合率显著升高(P<0.05)。见图4、5。
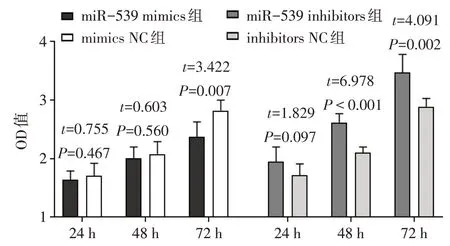
Fig.3 Comparison of the proliferation ability of ESCs cells at different time points between the four groups(n=6)图3 4组ESCs细胞不同时间点增殖能力的比较(n=6)

Fig.4 Comparison of cell migration ability between the four groups of ESCs图4 4组ESCs细胞迁移能力的比较
2.5 miR-539 过表达对 EM 组 ESCs 细胞侵袭的影响 与 mimics NC 组相比,miR-539 mimics 组 ESCs的侵袭细胞数量显著减少(P<0.05);与inhibitors NC 组相比,miR-539 inhibitors 组 ESCs 的侵袭细胞数量显著增加(P<0.05)。见图6、7。
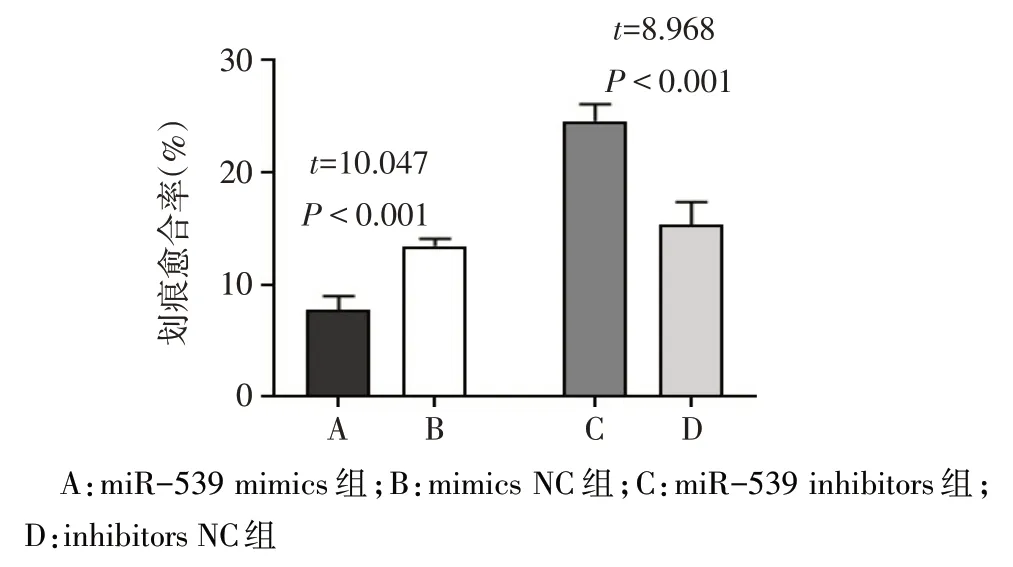
Fig.5 Comparison of Scratch healing rate between the four groups of ESCs(n=6)图5 4组ESCs细胞划痕愈合率的比较(n=6)
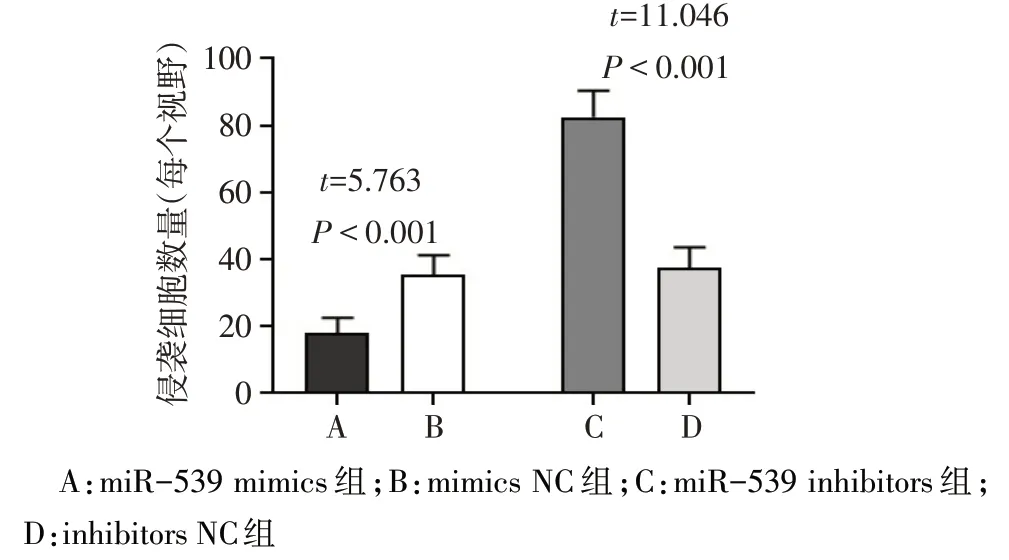
Fig.7 Comparison of the number of invasive cells between the 4 groups of ESCs(n=6)图7 4组ESCs细胞侵袭细胞数量的比较(n=6)
2.6 miR-539 过表达对 EM 组 ESCs 细胞中 MMP-9蛋白表达的影响 与mimics NC 组相比,miR-539 mimics 组ESCs 细胞MMP-9蛋白表达水平显著降低(P<0.05);与 inhibitors NC 组 相 比 ,miR-539 inhibitors 组ESCs 细胞的MMP-9 蛋白表达水平显著升高(P<0.05),见图8、9。

Fig.8 Expression of MMP-9 protein in four groups of ESCs图8 4组ESCs细胞中MMP-9蛋白表达情况

Fig.9 Comparison of the relative expression levels of MMP-9 protein between the 4 groups of ESCs(n=6)图9 4组ESCs细胞中MMP-9蛋白相对表达水平的比较(n=6)
3 讨论
3.1 miR-539 的表达水平与EM 的发生发展有关 EM是一种良性妇科疾病,但其病变具有癌性特征,如细胞侵袭、迁移和增殖等。人类子宫内膜是由不同细胞组成的复杂组织,包括腔上皮和腺上皮、间质细胞和免疫细胞。ESCs 在子宫内膜中的细胞数量最多,表明它们在维持子宫内膜的正常功能方面发挥着重要作用[10]。miRNA 是一组长度小于 24 个核苷酸的非编码RNA,在转录后水平调节基因表达。近年来,miRNAs作为特定基因表达的抑制因子被认为参与了子宫内膜的调控。各种miRNAs 在EM 中的异常表达已有报道[11-12]。同时 miR-539 在卵巢癌[13]、乳腺癌[14]等肿瘤中均异常表达。miR-539过表达可显著抑制癌细胞的侵袭和迁移。本研究显示,EM患者ESCs中miR-539水平明显下调,表明miR-539的表达水平与EM的发生发展有关。
3.2 miR-539可抑制ESCs的增殖、侵袭和迁移 为确定miR-539 在ESCs 中的作用,本研究将miR-539 mimics 和 miR-539 inhibitors 转染至 ESCs。CCK-8结果显示,转染miR-539 mimics 的细胞增殖率明显降低,而转染miR-539 inhibitors 的细胞增殖率则升高。ESCs 具有侵袭和迁移能力,这可能与EM 的发病机制有关[15]。本研究显示,miR-539 过表达可抑制ESCs的细胞侵袭和迁移能力,而抑制miR-539表达则可增强细胞侵袭和迁移能力,表明miR-539 在子宫内膜异位病变的发生发展中起着潜在的抑癌基因作用,miR-539可能通过抑制细胞增殖、侵袭和迁移而参与EM的发生发展。
3.3 miR-539 靶向调节MMP-9 来影响EM MMPs是一个内肽酶家族,可参与细胞外基质和基底膜的降解,这也是细胞迁移和侵袭的关键步骤。MMP-9是重要的细胞外金属蛋白酶,在EM 患者体内表达明显升高,可促进EM 细胞迁移和侵袭[16]。本研究显示,ESCs 细胞转染 miR-539 mimics 后,MMP-9 蛋白水平降低,而miR-539 inhibitors 转染后,MMP-9水平明显升高,表明miR-539 过表达可能通过下调MMP-9 的表达来抑制ESCs 的迁移和侵袭。因此,推测miR-539 可能是一种EM 抑制基因。另外,荧光素酶实验结果也证明了MMP-9 是miR-539 的直接靶标。miR-539过表达可抑制MMP-9水平,而抑制miR-539 则结果相反,表明miR-539 靶向调节MMP-9 的水平,提示其有可能成为EM 的分子标志物。
本研究表明,miR-539 在 EM 患者 ESCs 中表达下调,miR-539 过表达可下调MMP-9 水平,抑制ESCs 的迁移和侵袭,提示miR-539 可能成为治疗EM 的潜在靶点。然而,miR-539 在EM 中的具体作用和机制仍有待进一步研究。
