OX40Ig修饰大鼠脂肪间充质干细胞的实验研究
2021-10-27黄志伟刘涛陈晓波耿洁李光王玉亮
黄志伟,刘涛,陈晓波,耿洁,李光,王玉亮△
T细胞共刺激分子OX40(CD134)及其同源配体OX40L(CD134L、CD252)作为治疗T 细胞所介导疾病的重要靶点被广泛研究。OX40、OX40L分别属于肿瘤坏死因子(tumor necrosis factor,TNF)受体及TNF 超家族的成员,OX40 在活化的 CD4+T 细胞、CD8+T 细胞、中性粒细胞和自然杀伤细胞中均有表达,OX40L主要表达于活化的抗原提呈细胞(APC)、活化的T/B 细胞及巨噬细胞等。T 细胞与APC 间以及T 细胞相互间均可通过OX40 和OX40L 共刺激信号(第二信号)的传导而增强T 细胞活化能力、CD4+记忆T 细胞增殖水平及滤泡辅助T 细胞(Tfh)的生成,进而调节T 辅助细胞(Th)1 与Th2 的平衡,促进干扰素(IFN)-γ、TNF-α、白细胞介素(IL)-2、IL-21等细胞因子的产生[1-2]。在器官移植和自身免疫性疾病中,阻断OX40/OX40L共刺激信号可以抑制T细胞活化、延长移植物的存活时间并提高对自身抗原的免疫耐受[3]。脂肪间充质干细胞(ADSCs)因可发挥免疫调节、减轻全身炎症反应及损伤修复等功能而成为治疗多种难治性疾病的有效方案[4]。此外,ADSCs作为基因治疗载体也具有潜在的临床应用价值。本研究拟构建OX40Ig基因修饰ADSCs(ADSCsOX40Ig),探讨其对异基因反应性淋巴细胞免疫抑制的作用。
1 材料与方法
1.1 材料 健康雄性SPF 级Lewis 大鼠5 只和BN 大鼠4 只,6~8 周龄,体质量200~250 g,购自解放军军事医学科学院实验动物中心。DMEM/F12培养基、胎牛血清(美国Gibco公司);胰蛋白酶、成骨成脂及成胰岛样细胞诱导试剂、丝裂霉素C(美国Sigma 公司);细胞标记抗体、FACS Calibur 流式细胞仪(美国BD 公司);MiniBEST 凝胶DNA 回收试剂盒(日本TaKaRa 公司);TRIzol RNA 提取试剂盒、质粒载体pcDNA3.1(+)、琼脂糖(美国Invitrogen 公司);EcoRⅠ、BamHⅠ、XhoⅠ限制性内切酶、T4 DNA 连接酶(美国Thermo 公司);AxyPrep质粒小量提取试剂盒(美国Corning公司);Amaxa转染试剂盒(德国Amaxa 公司);重组Anti-OX40 抗体(美国Abcam 公司);ABI 7500实时荧光PCR扩增仪(美国Applied Biosystems公司);凝胶成像分析系统(美国Alpha Innotech公司)。
1.2 大鼠OX40 胞外区编码序列的获得及合成 取雄性Lewis 大鼠1 只,异氟醚吸入麻醉后取腹主动脉新鲜血液2 mL,淋巴细胞分离液分离外周血单个核细胞,按耿洁等[5]方法扩增大鼠OX40 胞外区及人IgG Fc 段编码序列。OX40片段用BamHⅠ-EcoRⅠ双酶切,IgG Fc 片段用EcoRⅠ-XhoⅠ双酶切,1%琼脂糖凝胶电泳回收目的片段。
1.3 pcDNA3.1(+)/OX40Ig融合基因表达载体的构建 按耿洁等[5]pcDNA3.1(+)/IgG Fc 质粒构建方法构建质粒,取pcDNA3.1(+)/IgG Fc 与OX40 胞外区序列连接反应产物,应用热休克法转化DH5α感受态大肠杆菌,碱裂解法小量提取质粒。质粒产物进行BamHⅠ-EcoRⅠ双酶切,1%琼脂糖凝胶电泳,若出现约600 bp 的目的条带,则初步鉴定为正确的重组质粒,命名为pcDNA3.1(+)/OX40Ig并测序鉴定。
1.4 大鼠ADSCs 分离培养及鉴定 1.2 中雄性Lewis 大鼠再取血后,无菌条件下取单侧腹股沟脂肪组织,参照文献[5]分离并提取ADSCs,应用流式细胞术及油红O染色、茜素红染色法对第3代ADSCs 表面标志物(CD90、CD105、CD73、CD34及CD45)及ADSCs诱导多向分化潜能进行鉴定。其中细胞表面标志物表达>95%为阳性,<1%为阴性;成脂细胞诱导观察细胞质内球形脂滴情况,成骨细胞诱导观察深染钙结节形成情况。
1.5 ADSCs转染和OX40Ig蛋白表达水平检测 ADSCs消化成单细胞悬液,参照文献[5]采用核转染技术将pcDNA3.1(+)/OX40Ig质粒转染至ADSCs。重组质粒转染ADSCs 后72 h,Western blot法检测ADSCs中OX40Ig表达,分离的蛋白电泳转移到聚二氟乙烯膜上,BSA封闭液封闭后加重组Anti-OX40抗体4 ℃孵育过夜,辣根过氧化物酶标记的二抗(1∶1 000)室温下和聚二氟乙烯膜孵育1 h,用增强化学发光反应显色阳性条带。
1.6 混合淋巴细胞反应 异氟醚吸入麻醉后,将4 只BN 大鼠和4 只Lewis 大鼠通过异氟醚吸入麻醉后取脾脏,通过尼龙滤网过滤法制备脾细胞悬液,再经淋巴细胞分离液分离并经尼龙毛柱法获得淋巴细胞。取2×106/mL的BN大鼠淋巴细胞悬液并加入25 mg/L 丝裂霉素C,于37 ℃作用30 min,以1 500 r/min 离心 10 min,RPMI 1640 培养液洗涤后调整为 2×106/mL作为刺激细胞。将Lewis大鼠淋巴细胞1×105/孔(反应细胞)与刺激细胞2×105/孔混合接种于96孔培养板中。每孔加入丝裂霉素C 处理过的ADSCs、ADSCsOX40Ig(2×104/孔),实验分为对照组(反应细胞+刺激细胞)、ADSCs 组(反应细胞+刺激细胞+ADSCs)及ADSCsOX40Ig组(反应细胞+刺激细胞+ADSCsOX40Ig);每组设3个复孔,37 ℃、5%CO2条件下常规培养4 d后采用MTT法测定淋巴细胞增殖的吸光度(A)值,并计算细胞增殖抑制率。增殖抑制率(%)=(1-A实验组/A对照组)×100%。
1.7 逆转录聚合酶链式反应检测淋巴细胞内IFN-γ、IL-10及转化生长因子(TGF)-βmRNA 表达水平 收集混合淋巴细胞反应培养72 h 后的淋巴细胞,采用TRIzol 法提取总RNA,取总RNA 5 μg反转录为cDNA,产物体积20 μL。IFN-γ引物:上游 5′-AGGCCATCAGCAACAACATAAGTG-3′,下游5′-GACAGCTTTGTGCTGGATCTGTG-3′;IL-10引物:上游5′-AAGGCCATGAATGAGTTTGACAT-3′,下游 5′-CGGGTGGTTCAATTTTTCATTT-3′;TGF-β引物:上游 5′-CAAGGGCTACCATGCCAACT-3′,下游5′-CCGGGTTGTGTTGGTTGTAGA-3′;内参基因β-actin引物:上游5′-CGTTGACATCCGTAAAGACCTCC-3′,下 游 5′-TAGGAGCCAGGGCAGTAATCT-3′。反应条件:95 ℃预变性15 min;95 ℃变性20 s,60 ℃退火和延伸 60 s,40 个循环。记录Ct 值,以 2-ΔCt表示IFN-γ、IL-10、TGF-βmRNA的相对表达水平,其中ΔCt=Ct目的基因-Ctβ-actin。
1.8 统计学方法 采用SPSS 16.0软件进行数据分析。符合正态分布的计量资料以均数±标准差()表示,2 组间均数比较用t检验,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 重组质粒的酶切鉴定EcoRⅠ-XhoⅠ双酶切重组质粒pcDNA3.1(+)/OX40Ig,电泳结果显示目的基因条带对应1 000 bp;BamHⅠ-EcoRⅠ双酶切重组质粒pcDNA3.1(+)/OX40Ig,电泳结果显示目的基因条带对应570 bp,见图1。
2.2 重组质粒的测序鉴定 重组质粒测序鉴定与GenBank上公布的目标序列完全一致,无插入、缺失和移码突变,表明质粒构建正确,见图2。
2.3 大鼠ADSCs 的体外培养和鉴定 ADSCs 传代后细胞形态为长梭形并呈漩涡状几何倍数稳定增长。ADSCs 表面分子 CD90、CD105 和 CD73 呈阳性表达,CD34、CD45呈阴性表达,见图3。ADSCs在成脂及成骨细胞诱导液培育下分化为脂肪细胞和成骨细胞,见图4。
2.4 OX40Ig 蛋白在ADSCs 细胞中的表达情况 重组质粒转染ADSCs细胞后,OX40Ig在ADSCs中呈高表达,见图5。
2.5 ADSCsOX40Ig对异基因淋巴细胞增殖反应的影响 与ADSCs 组(46.7%±3.1%)比较,ADSCsOX40Ig组(60.5%±4.4%)异基因淋巴细胞增殖抑制率增强(n=4,t=5.085,P<0.01)。
2.6 3 组IFN-γ、IL-10、TGF-βmRNA 表达水平比较 对照组、ADSCs 组及ADSCsOX40Ig组的IFN-γmRNA 相对表达水平依次降低,而IL-10、TGF-βmRNA相对表达水平依次升高(P<0.01),见表1。

Fig.1 Validation of the recombinant plasmid pcDNA3.1(+)/OX40Ig图1 pcDNA3.1(+)/OX40Ig质粒的酶切鉴定
Fig.2 DNA sequencing graph of pcDNA3.1(+)/OX40Ig图2 pcDNA3.1(+)/OX40Ig重组质粒基因测序图

Fig.3 Phenotypic characterization of ADSCs图3 ADSCs表型特征
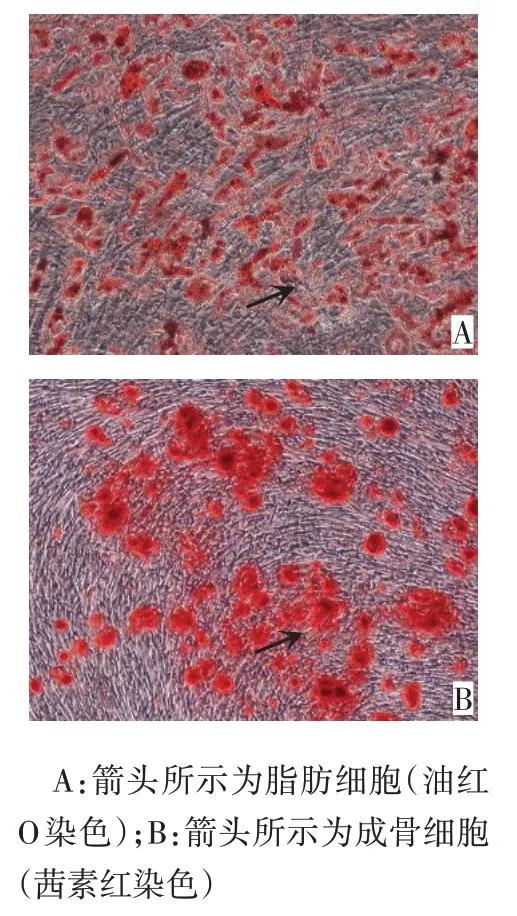
Fig.4 ADSCs multilineage differentiation capacity(×200)图4 ADSCs多向分化能力(×200)
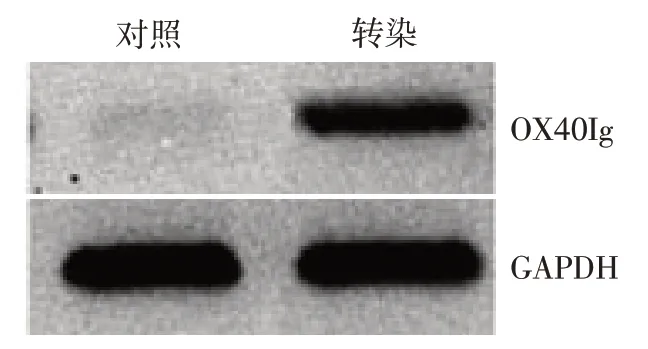
Fig.5 Expression of OX40Ig detected by Western blot analysis图5 Western blot检测OX40Ig融合蛋白表达情况
Tab.1 Comparison of IFN-γ,IL-10 and TGF-β mRNA between the three groups表1 3组IFN-γ、IL-10、TGF-β mRNA表达水平比较(n=4,)
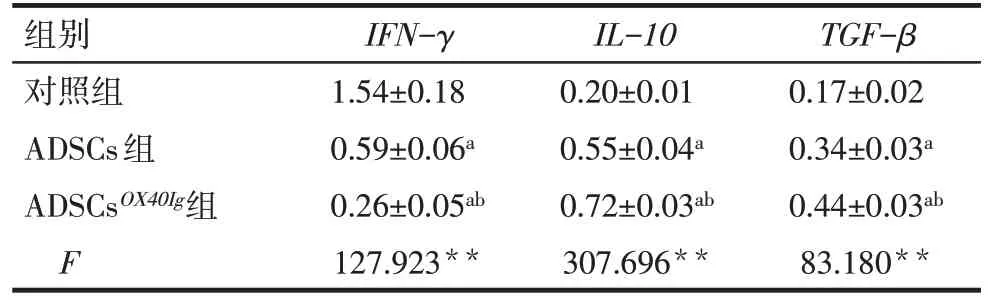
Tab.1 Comparison of IFN-γ,IL-10 and TGF-β mRNA between the three groups表1 3组IFN-γ、IL-10、TGF-β mRNA表达水平比较(n=4,)
**P<0.01;a与对照组比较,b与ADSCs组比较,P<0.05
组别对照组ADSCs组ADSCsOX40Ig组F IFN-γ 1.54±0.18 0.59±0.06a 0.26±0.05ab 127.923**IL-10 0.20±0.01 0.55±0.04a 0.72±0.03ab 307.696**TGF-β 0.17±0.02 0.34±0.03a 0.44±0.03ab 83.180**
3 讨论
3.1 共刺激分子-Ig 融合蛋白用于共刺激通路阻断 研究显示,激活T 细胞所必需的共刺激分子信号(第二信号)主要来自CD28、可诱导共刺激分子、OX40 等共刺激途径[6]。OX40/OX40L 对维持效应 T细胞的活化、增殖及T 细胞免疫记忆等发挥重要生物学功能。研究发现,OX40基因敲除小鼠因丧失增殖分化能力,T细胞活化后会大量凋亡,而增强OX40基因表达可阻止T细胞无反应状态并打破基因敲除小鼠已建立的外周免疫耐受[7]。近期研究发现,OX40可作为预测急性排斥反应的一个分子标志物,是T 细胞介导免疫应答的关键共刺激分子[8-9]。共刺激分子与Ig融合蛋白通过重组工程技术可产生共刺激分子-Ig 融合蛋白,用于共刺激阻断;与其他免疫抑制策略比较,共刺激分子-Ig融合蛋白可更好地诱导特异性免疫耐受并减少脱靶效应[10]。Kitchens等[11]研究显示,Balatacept与人源化抗OX40L抗体组合给药可显著延长非灵长类动物移植肾存活时间。Chen 等[12]研究显示,通过腺病毒介导OX40Ig基因表达来阻断OX40-OX40L 信号通路,可抑制大鼠同种异体肝移植排斥反应,并通过降低IL-2表达而诱导免疫耐受。本实验所构建的pcDNA3.1(+)/OX40Ig质粒 DNA 序列测序鉴定结果表明,DNA 序列与目标序列完全匹配,无插入、缺失和移码突变,表明成功构建了真核表达重组质粒,因此通过OX40-OX40L阻断诱导免疫耐受有望成为一种有前景的治疗策略。
3.2 ADSCs 应用 根据全球最大的临床试验登记系统Clinical Trials 的数据,全球共有数千项间充质干细胞(MSCs)治疗相关的临床研究登记注册,主要研究MSCs治疗某种特定疾病的安全性和有效性[13]。ADSCs 具有取材方便、易于标准化大规模生产以及可被基因修饰等特点。此外,ADSCs 具有比骨髓MSCs更强的免疫调节能力,是具有临床应用前景的种子细胞[14-15]。Sánchez-Guijo 等[16]对 13 例重症新型冠状病毒肺炎(COVID-19)患者在接受机械通气的情况下给予ADSCs治疗,结果表明,ADSCs可在重症COVID-19 患者中安全使用,并且大多数受试者临床症状得到改善。本研究结果显示,ADSCs 表面标志物CD90、CD105和CD73呈阳性表达,而造血干细胞表面标志物CD34、白细胞共同抗原CD45 均呈阴性表达,同时ADSCs 具有诱导分化为脂肪细胞和成骨细胞能力,表明来自脂肪组织所分离培养扩增的细胞为MSCs。鉴于ADSCs 的这些独特优势,ADSCs有望成为共刺激分子诱导特异性免疫耐受的理想的基因运载工具。
3.3OX40Ig基因修饰ADSCs 免疫耐受通常指当ADSCs 迁移到目标组织时,共刺激分子融合蛋白可以在局部持续释放,同时发挥ADSCs免疫调节、损伤修复等多方面作用,两者可协同诱导免疫耐受,且不存在常规免疫抑制剂带来的不良反应。研究显示,利用基因工程技术将共刺激分子融合蛋白基因转染至ADSCs,可使ADSCs 在体内持续分泌特定融合蛋白并延长融合蛋白在体内的半衰期,发挥细胞治疗与基因治疗对诱导免疫耐受的协同作用[17]。目前,ADSCs可以较容易地用已知的病毒和非病毒载体进行转导,并有效地过表达转基因产物,这使得用基因工程技术开发以ADSCs为基础表达所需治疗因子的构想成为可能[18]。本研究使用核转染方法将pcDNA3.1(+)/OX40Ig重 组 质 粒 转 染 ADSCs,Western blot结果显示,ADSCs细胞中OX40Ig蛋白表达显著升高,表明通过核转染技术重组质粒能够成功介导融合蛋白在真核细胞中的表达,从而为进一步研究其对淋巴细胞的免疫调节作用打下基础。
3.4 ADSCsOX40Ig对异基因淋巴细胞的免疫抑制作用 本研究结果显示,与ADSCs 比较,ADSCsOX40Ig在体外可显著增强异基因淋巴细胞增殖抑制率,表明ADSCsOX40Ig表达OX40Ig 并具有生物学功能,提示ADSCs可能通过与淋巴细胞直接接触抑制了异基因淋巴细胞的增殖,进而发挥其免疫抑制作用,并通过OX40Ig阻断T细胞之间的OX40/OX40L共刺激信号通路进一步增强了其对ADSCs 的免疫抑制作用,从而发挥两者协同诱导异基因淋巴细胞的低反应性作用。相关研究显示,应用MSCs 或阻断OX40 共刺激通路均可通过影响Th 的极化来发挥免疫调节作用[2,19]。IFN-γ、IL-10 以及 TGF-β 分别是 Th1、Th2及调节性T 细胞(Treg)表达和释放的主要细胞因子[20]。本研究结果显示,与ADSCs 比较,ADSCsOX40Ig能够进一步下调淋巴细胞IFN-γmRNA 表达,同时上调IL-10和TGF-βmRNA 表达,提示上调的IL-10及TGF-β使混合淋巴细胞反应体系中的T淋巴细胞群由促炎性Th1 占主导向抗炎性Th2 和Treg 偏移,从而发挥负性免疫调节作用。因此,笔者认为,OX40Ig基因修饰的ADSCs 可同时发挥ADSCs 的免疫调节作用和OX40Ig的共刺激阻断作用,协同诱导免疫耐受,其可成为抑制异基因淋巴细胞活化及诱导其低反应性的有效策略,但ADSCsOX40Ig在体内是否发挥免疫调节作用仍有待深入研究。
