利用膜片钳技术标记脑片神经元的方法*
2021-10-22黄燕云张雨彤杜相欣张利娜李建国
高 洁, 黄燕云, 张雨彤, 杜相欣, 张利娜, 郝 娜, 郭 霞, 李建国, 张 宇△
(1. 山西医科大学细胞生理学教育部重点实验室, 2. 山西医科大学生理学系, 太原 030001)
在进行脑片膜片钳实验时,经常需要甄别实验中选取的是哪一类细胞。通常是根据目标区域中细胞的镜下形态、细胞的静息电位及一些电生理学特性来进行初步的鉴别和区分。本实验室采用了一种通过全细胞膜片钳技术对脑片上目标神经元实施荧光标记的方法。该方法在记录离子通道电流后经过处理就可以更直观呈现观察神经元胞体和部分突起的形态,为实验提供形态学的证据。
实验中用到的两种染色生物制剂分别为NeurobiotinTMTracer和Streptavidin-Texas Red。神经生物素(Neurobiotin)是生物素的一种氨基衍生物,可作为细胞尤其是神经元的胞内标记物,使神经结构及其连接呈现可视化。神经生物素溶解度高,被离子导入性好,无毒可在细胞内长时间维持,因此它被广泛应用于通过细胞内记录技术对细胞进行电生理学表征后,从形态上鉴定神经元[1-3]。链霉亲和素(Streptavidin)是由链霉菌分泌的一种蛋白质,分子量为65 kD,是一种稍偏酸性(pH 6.0)的蛋白质。一个链霉亲和素分子可以结合4个生物素分子。链霉亲和素与生物素有很高的结合活性,因此被广泛用于检测生物素或生物素偶联的各种蛋白、核酸及其它分子。溶解的链霉亲和素可以在较宽的温度和pH范围内保持稳定,且特异性高[4]。被Texas Red标记的链霉亲和素可与Neurobiotin结合,发出红色荧光。Texas Red标记的链霉亲和素的发射波长(Em)为602 nm,激发波长(Ex)为582 nm。本文中以大鼠皮层和海马锥体神经元为样本介绍脑片膜片钳实验中标记所记录神经元形态的具体染色方法,为进行电生理学检测的神经元提供形态学证据。
1 材料与方法
1.1 主要材料
取出生10~20 d健康雄性SD大鼠(购自山西医科大学动物实验中心);4%多聚甲醛;0.01 mol/L 磷酸缓冲液(PB); NeurobiotinTMTracer产自美国Vectorlabs公司,Streptavidin-Texas Red产自美国Invitrogen公司;Triton X-100产自北京索莱宝科技有限公司,戊巴比妥钠、NaHCO3、KCl、NaH2PO4、NaCl、CaCl2、MgSO4、HEPES、Glucose、EGTA、K-Gluconate、Na2phosphocreatine、Na2ATP、Na3GTP和Mg-ATP均产自美国Sigma公司,带芯微电极玻璃管GBF150-86-10HP产自美国Sutter公司。
1.2 脑片制备
溶液配制:切片液(mmol/L)含NaHCO326,KCl 2.5,NaH2PO41.25,CaCl20.5,MgSO47,HEPES 5,Glucose 10,Sucrose 210,pH 7.2~7.4,渗透压295~205 mOsm/kg,4℃保存;孵育液(mmol/L)含KCl 2.5,CaCl22,NaH2PO41.25,NaCl 124,NaHCO326,Glucose 10,pH 7.2~7.4,渗透压295~205 mOsm/kg,现配现用;电极内液含K-Gluconate 120,KCl 5,HEPES 10,EGTA 5,CaCl20.5,MgSO42,Na2phosphocreatine 5,Na2ATP 5,Na3GTP 4,Mg-ATP 4,pH 7.2~7.4,渗透压295~205 mOsm/kg,用1.5 ml的EP管分装,每管1 ml,-20℃保存;含有神经生物素的电极内液为1 ml的电极内液中加入50 μg的NeurobiotinTMTracer粉末(5%),然后用1.5 ml的EP管分装,每管25 μl,-20℃保存;4%的多聚甲醛(pH 7.2~7.4);0.1 mol/L 磷酸缓冲液(pH 7.2~ 7.4)。
制备离体脑片:健康雄性SD大鼠,用1%戊巴比妥钠腹腔麻醉后快速被断头取脑,置于4℃氧饱和(95%O2和5%CO2)的切片液中冷却十几秒后取出。用Precisionary Instruments VF-700振动切片机进行脑片标本制备。沿冠状面修切掉不需要的部分,再用502胶水将其粘于振动切片机配套的组织托柄上,并用琼脂固定,然后迅速将其置于切片槽中并倒入4℃切片液,浸没脑组织块,调整好刀片和组织的距离后开始切片。切片机震动频率为7,前进速度为3,脑片厚度为200 μm。沿冠状面每切出一片脑片,就将其迅速转移到室温(25℃)孵育液中。切片液和孵育液中都持续通混合气(95%O2和5%CO2)。切好的脑片孵育1 h后即可观察记录。
1.3 神经元的染色标记
膜片钳记录模式下染料灌注:将孵育好的脑片移至脑片膜片钳设备的记录槽中,并用尼龙盖网固定。将拉制好的玻璃电极尾端浸入含有神经生物素的电极内液中,利用虹吸作用使尖端充灌标记液后,尾端注入不含神经生物素的电极内液。将电极安装在电极夹持器上,然后利用微型操纵器使其缓慢下降,在快接近脑片时给少许正压。选择轮廓清晰,胞体较亮,折光性好的细胞,当电极接触到细胞表面时撤去正压,并施加适当负压,使电极尖端与细胞表面形成高阻封接(GΩ)。待封接稳定后再次给予负压使细胞破膜形成全细胞记录模式。撤去负压,将放大器设置到whole-cell模式进行膜片钳电生理记录。若细胞的静息电位大于-50 mV,则表明细胞状态良好,可继续记录。根据实验需求,使用事先编辑好的Protocal或采用Gap-free模式进行记录。每个细胞至少记录10 min以上,使电极内液中的神经生物素充分进入细胞中。每片脑片上标记1~3个神经元。脑片标记完后置于4%多聚甲醛中常温下固定2 h以上(若脑片厚度超过200 μm,可酌情延长时间,也可4℃过夜)。
神经元染色与观察:固定好的脑片用0.1 mol/L的PB震荡漂洗3次,每次5 min。在PB中加入 0.1%的Triton X-100(一种非离子型表面活性剂,溶解脂质,以增加染料细胞膜的通透性)和0.1%的液体染料(如5 ml的PB中加入5 μl Triton X-100和5 μl Streptavidin-Texas Red)避光震荡混匀2 h以上,再用PB漂洗2次后即可用荧光显微镜观察。
2 结果
2.1 神经元的膜片钳记录
用全细胞脑片膜片钳法,对大鼠前扣带皮层及海马部位的锥体神经元采用电压钳和电流钳模式,记录神经元在不同电压刺激下膜电流的变化的反应和不同电流刺激下膜电压的变化反应,如图1所示。电压钳模式记录时,钳制电压为-70 mV,通过记录电极给一系列阶跃刺激(从-50~+90 mV,阶跃10 mV,时程200 ms)。锥体神经元表现为逐渐增大的膜电流。电流钳模式记录时,阶跃刺激(从-30~+60 pA ,增幅为10 pA,时程200 ms)使神经元去极化,达到阈电位后爆发动作电位。
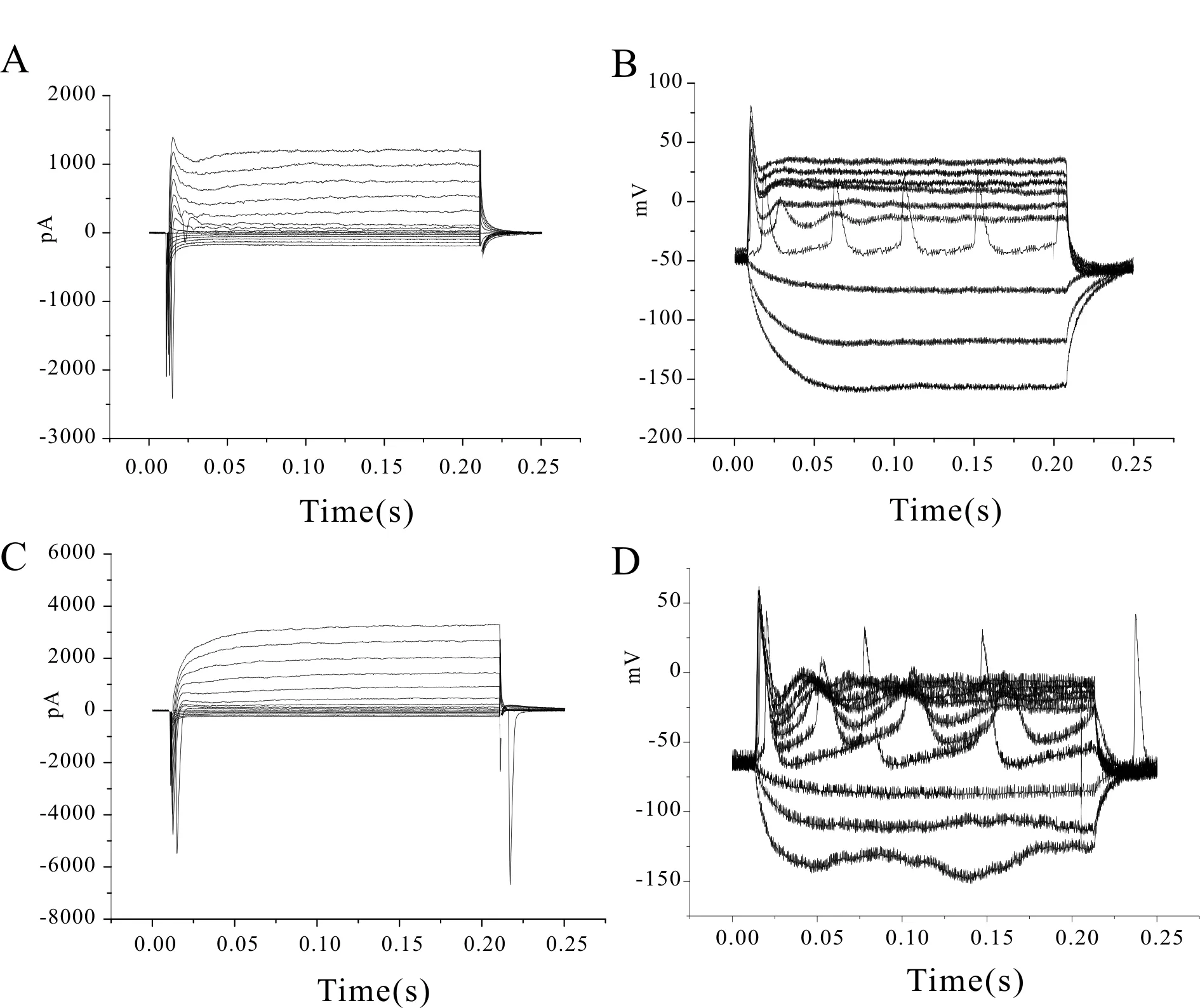
Fig. 1 Whole-cell patch clamp recording results. The above showed that the recorded membrane potential in the anterior cingulate cortical neuron (A) and the hippocampal neuron (C), and the recorded currents in the anterior cingulate cortical neuron (B) and the hippocampal neuron (D), n=5
2.2 神经元的染色
经过上述全细胞膜片钳记录及染色后,所选细胞的形态如图2。锥体神经元的胞体直径约20~40 μm,图中可看到清晰的胞体和周围的突起,表明神经生物素NeurobiotinTMTracer及其亲合物Streptavidin-Texas Red可用作标记神经元。

Fig. 2 The fluorescent photographs of pyramidal neurons labeled with intracellular fluid containing NeurobiotinTM Tracer in a 15-day-old rat. Neurons were stained with the pipette solution for a period of 20 min(n=5);The left is the anterior cingulate cortical neuron, the right is the hippocampal neuron
3 讨论
标记单个神经元的理想示踪剂必须满足多个要求,例如快速扩散,组织学处理过程中的稳定性等。NeurobiotinTM是一种有效的神经解剖学示踪剂,可用于体内顺行、逆行和跨神经元描记,以及体外标记神经元[5-7]。但也有研究表明,使用充满神经生物素的电极,尤其是膜片钳电极,对中枢神经系统神经元的电生理特征有所影响,会给所获得的电生理数据的解释带来问题,如在使用膜片钳技术记录期间,示踪剂导致动作电位时程显著延长,且与浓度有关,其影响随记录时间的增加而增大,但不明显改变静息膜电位等其他膜特性[8-10]。针对这一问题,本实验选择电极尖端充灌含有NeurobiotinTM的细胞内液,电极尾部注入普通电极内液,尽量减少生物素染料的使用量以减少对细胞电学特征的影响。另外,有实验室使用这种标记方法标记神经元时,为了避免移出电极时损伤细胞膜,采用减小玻璃微电极尖端直径的办法,但是高电阻尖端非常细小,易碎且容易堵塞,因此不易获得并保持稳定的细胞内记录[11]。经过多次实验发现,当电极尖端阻抗为5~7 MΩ时,实验中既不影响细胞内记录,实验结束后缓慢将电极从细胞上移除,也不易破坏细胞膜结构的完整性,有利于呈现完好的胞体和突起形态。
另外,实验时还需要注意以下几点:(1)配制液体的时候,一定要注意调节好液体的渗透压和pH值,液体的理化性质对脑片活性很关键;(2)切脑片的速度要快,从断头开始到脑片切好,整个过程不超过15 min,且时间越短脑片活性越好,染出来的细胞形态越接近真实状态,突起也会越明显;(3)细胞破膜后,可适当给予电刺激,有助于神经生物素在胞内扩散;(4)细胞记录完成以后,缓慢撤出电极,避免速度过快、幅度过大会损伤细胞膜,导致染料外漏甚至细胞死亡;(5)由于神经生物素对动作电位有影响,因此记录动作电位的数据仅供参考,不适合收入正式结果中;(6)普通荧光显微镜可以清晰观察细胞形态,但如果用激光共聚焦显微镜观察效果更好。
以上是本研究室在脑片上记录通道电流时标记目标神经元形态的方法及操作体会。通过该方法实现了将膜片钳技术与直观的神经元形态标记相结合,有利于甄别和区分中枢神经系统中不同类型神经元的功能活动,实用性强,易于在膜片钳实验中应用。
