紫草素对肝癌细胞SMMC-7721凋亡的影响及其机制*
2021-10-22何施燕朱若婷柯瑞君陈佳玉
王 瑜, 何施燕, 朱若婷, 柯瑞君, 陈佳玉
(绍兴文理学院医学院, 浙江 绍兴 312000)
肝癌是常见的恶性肿瘤,2018年全球肝癌的发病率占恶性肿瘤的4.7%,病死率占恶性肿瘤的 8.2%[1]。因肝脏被膜缺乏神经,早期症状少,肿瘤发病隐匿,大多数肝癌患者就诊时病程已达到中晚期,故手术治疗效果较差,患者预后不良,5年生存率往往小于5%[2]。肝癌对化疗药有一定的抵抗性,临床一线药物阿霉素的有效治疗率只有10%~15%[3]。经动脉化疗栓塞术(TACE)虽然能够较好地缓解临床症状或者延长生存时间,但有明显的副作用和严重的并发症,如急性肝功能衰竭等[4],不能够实现肝癌真正意义上的治疗。故寻找可治疗肝癌的高效、低毒药物是当前肝癌研究的重点和热点。
紫草素(shikonin)是紫草中的主要成分,价格低廉、易合成、毒副作用小[5]。有研究表明,紫草素具有抗炎、抗菌以及抗白血病等作用[5, 6]。但是紫草素抗肝癌作用的研究目前尚未见详细报道,因此本文通过体内外实验揭示紫草素对SMMC-7721细胞的作用及其作用的分子机制,为研究新型高效低毒的肝癌治疗药物提供实验基础。
1 材料与方法
1.1 材料
肝癌SMMC-7721细胞株为本校细胞实验室培养留存。洁净级BALB/c小鼠源自浙江省实验动物中心。紫草素为西安欣禄生物科技有限公司产品。CCK-8检测试剂盒源自日本同仁公司。胰酶、RPMI-1640培养液和胎牛血清均为美国Gibco公司产品。AnnexinV-FITC/PI双染试剂盒和脱脂奶粉购自于美国BD公司。Hoechst 33342、BCA蛋白浓度测定试剂盒和RIPA裂解液(强)均来源于上海Beyotime公司。一抗和酶标二抗为武汉BOSTER Biotech公司的产品。ECL化学发光液由美国Sigma公司提供。
1.2 细胞培养
RPMI 1640完全培养液中加入适量胎牛血清,使其终浓度为10%,用混合后的培养液将SMMC-7721细胞稀释至5 × 104cells/ ml。
1.3 CCK8法检测SMMC-7721细胞增殖活性
将稀释后的SMMC-7721细胞,以100 μl/well接种于96孔板,37℃、 5% CO2、饱和湿度下孵育24 h,加入紫草素使其终浓度分别为0、5、20、80和320 ng/ml,设3复孔,37℃、 5% CO2、饱和湿度下分别孵育0 h、24 h、48 h和72 h。于每孔加入10 μl CCK8,混匀后于细胞孵箱中继续培养3 h,用酶标仪于495 nm波长下检测吸光度(OD值),分析细胞增殖活性。
1.4 Hoechst 33342染色观察SMMC-7721细胞核型变化
将稀释后的SMMC-7721细胞,以2 ml/well接种于6孔培养板,37℃、 5% CO2、饱和湿度下继续孵育。至细胞80%融合时,弃上清,设三复孔,加入含有终浓度分别为0、5、20、80和320 ng/ml紫草素的RPMI 1640完全培养液2 ml,将细胞继续置于培养箱中孵育24 h,经hoechst 33342染色(关于试剂用量及染色方法参照说明书),荧光倒置显微镜,观察SMMC-7721细胞核型变化。
1.5 流式细胞仪分析SMMC-7721细胞凋亡水平
将稀释后的SMMC-7721细胞,以2 ml/well接种至6孔培养板,37℃、 5% CO2、饱和湿度下继续孵育。至80%融合时,弃上清,设三复孔,加入含有终浓度分别为0、5、20、80和320 ng/ml紫草素的RPMI 1640完全培养液2 ml,继续培养24 h,弃上清,PBS洗一次,胰酶消化细胞,细胞凋亡双染试剂盒染色后,流式细胞仪检测SMMC-7721细胞凋亡水平(试剂用量和染色方法按试剂说明书进行)并计算各组凋亡率。
1.6 Western blot观察SMMC-7721细胞内蛋白的水平
取经分别含有0和 80 ng/ml紫草素的完全培养液作用24 h后的SMMC-7721细胞,离心去上清,PBS洗涤3次,加入适量细胞裂解液,提取蛋白,经蛋白定量试剂盒定量后,以GAPDH为内参进行Western blot,采用Photoshop软件分析SMMC-7721细胞内蛋白P53的表达和AKT、PI3K蛋白的磷酸化水平。
1.7 抑瘤实验
取4周龄雄性BALB/c小鼠,随机分为6组,每组10只。在无菌条件下饲养一周以适应环境。取肝癌SMMC-7721细胞,离心5 min(1 000 r/min),弃去上清液,用PBS清洗2次,离心,将上清液完全丢弃,取细胞并用生理盐水稀释成2 × 107cells/ml,于腹股沟皮下处注射小鼠0.5 ml/只。3 d后,各组分别灌胃0、5、25、125、625 μg/kg的紫草素0.2 ml,每日一次,10日后杀鼠取瘤组织,称重,分析药物的抑瘤作用。
1.8 统计学处理
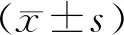
2 结果
2.1 紫草素对SMMC-7721细胞增殖活性的影响
用0、5、20、80和320 ng/ml浓度的紫草素,分别作用于肝癌SMMC-7721 细胞0 h、24 h、48 h和72 h,结果如图1所示,5~320 ng/ml紫草素对肝癌SMMC-7721 细胞均有显著的抑制作用(P<0.01,n=3),作用效果随用药浓度和时间的增加而增加。
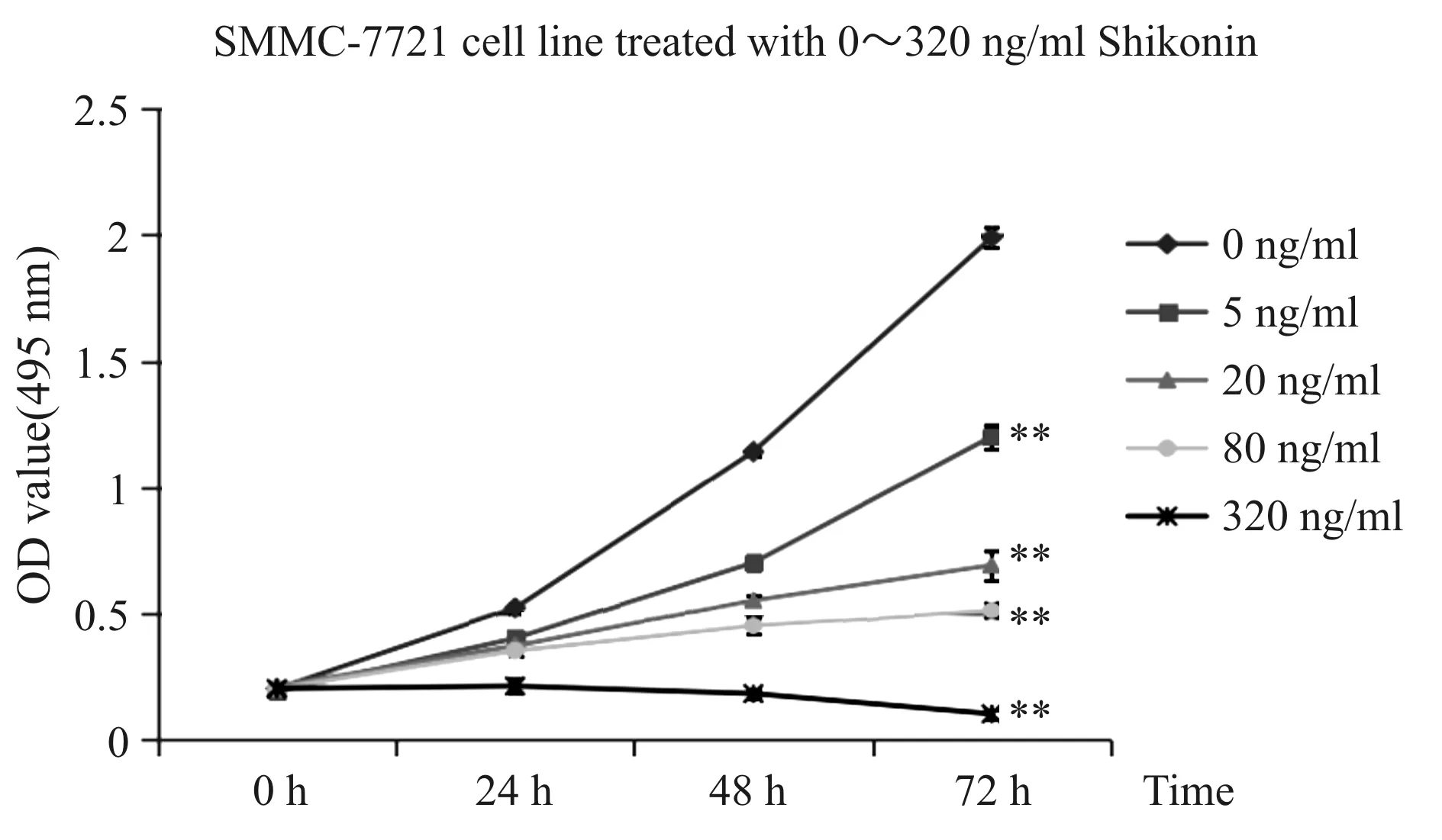
Fig. 1 Effects of shikonin on the proliferation activity of SMMC-7721 cells detected by CCK8 (n=3)
2.2 紫草素对SMMC-7721细胞核型改变的影响
Hoechst 33342染色结果显示,SMMC-7721细胞经0、5、20、80和320 ng/ml浓度的紫草素作用24 h后,细胞核出现染色质浓集、核碎裂和凋亡小体,且发生核型改变的细胞随用药浓度增加而增加(图2)。

Fig. 2 The results of hoechst 33342 staining(n=3)
2.3 紫草素对SMMC-7721细胞凋亡的影响
用0、5、20、80和320 ng/ml浓度的紫草素分别作用于SMMC-7721细胞24 h,流式细胞仪检测结果显示(图3),细胞凋亡率分别为(14.55±8.00)%、(22.65±1.13)%、(28.78%±1.44)%、(98.34± 4.92)%,其凋亡水平随用药剂量增加而增加(P< 0.01),该结果与Hoechst 33342染色结果基本符合。

Fig. 3 Effects of shikonin on apoptosis of SMMC-7721 cells detected by flow cytometry(n=3)
2.4 紫草素对SMMC-7721细胞蛋白表达的影响
SMMC-7721细胞分别经0和80 ng/ml浓度的紫草素作用24 h,Western blot检测显示(图4),P53蛋白表达水平由0 ng/ml组的(14.1±0.7)%增加至80 ng/ml组的58.0%±2.9%,而PI3K、AKT蛋白磷酸化水平分别由0 ng/ml组的(73.8±3.7)%、 (63.9±3.2)%下降至80 ng/ml组的(49.0± 2.4)%、(35.6±1.8)%,其蛋白表达水平随用药剂量的增加而发生显著变化(P<0.01)。
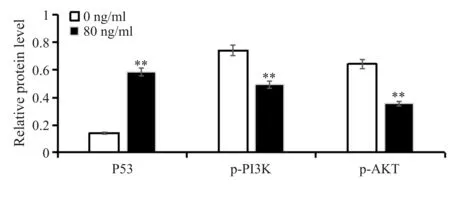
Fig. 4 Effects of shikonin on the protein expressions of P53, p-PI3K and p-AKT in SMMC-7721 cells detected by Western blot(n=3)
2.5 紫草素对肿瘤生长的影响
荷瘤小鼠分别用0、5、25、125 、625 μg/kg的紫草素灌胃10 d,抑瘤实验结果显示(图5),肿瘤抑制率分别为(15.90±0.79)%、(32.70±1.64)%、 (54.55±2.73)%、(76.36±3.82)%,故紫草素可抑制荷瘤小鼠肿瘤的生长,其肿瘤抑制率随着用药剂量的增加而增加(P<0.01)。
Fig. 5 The results of tumor suppression experiments(n=10)
3 讨论
诱导细胞发生凋亡已成为肿瘤治疗的新靶点[7, 8],现已研发出很多通过诱导肿瘤凋亡的抗癌药物,但是阿霉素等抗癌药物因为有较大毒副作用和诱发肿瘤的耐药性而并未实现真正的抗癌治疗[9-11]。
本实验证实紫草素可由抑制SMMC-7721细胞增殖活性,hoechst 33342染色、流式发现其有诱导SMMC-7721细胞发生凋亡的作用,Western blot揭示它显著上调了基因p53表达,并抑制抗凋亡蛋白AKT、PI3K磷酸化。PI3K、AKT和P53是PI3K/AKT信号通路的主要成员,在肿瘤的发生发展中发挥着重要的作用[12]。当细胞受到某种外界刺激时,细胞内蛋白PI3K磷酸化受抑,下调了PIP3活性,致使AKT在细胞膜的募集和磷酸化受抑,影响线粒体膜上蛋白质比例,BAX与BCL-2结合构成凋亡二聚体,促进细胞色素C(cytochrome c)和凋亡诱导因子的释放,促使Caspase级联反应发生,通过内源性途径诱导细胞凋亡[13]。同时当AKT活化受抑,可下调MDM2磷酸化水平,促进P53的表达[14]。临床研究证实,大部分肝癌患者都存在P53基因的突变,这种变异使得细胞凋亡无法正常进行,肿瘤细胞发生异常增殖[15, 16]。而P53是一种重要的抑癌基因,有资料显示,P53可激活外源性途径中的死亡受体,通过调控内源性途径中的BAX/BCL-2比例,发挥抑癌作用[17]。本实验发现紫草素可通过PI3K/AKT信号通路,上调p53基因表达,从而进一步诱导SMMC-7721细胞发生凋亡,发挥抑癌作用。
综上所述,本实验表明,紫草素可以通过影响PI3K/AKT信号通路抑制肝癌SMMC-7721细胞增殖活性,诱导该细胞发生凋亡,从而发挥抗肝癌的作用。本实验为肝癌真正治疗药物的研发提供了实验依据。
