细胞自噬在大鼠缺血/再灌注肺损伤中的调控作用*
2021-10-22郝卯林楼国强刘秀洁周卓琳王万铁
郝卯林, 楼国强, 刘秀洁, 钱 巍, 王 嘉, 周卓琳, 王万铁△
(1. 温州医科大学缺血-再灌注损伤研究所, 浙江 温州 325035; 2. 杭州市临安区第一人民医院全科医疗科, 浙江 杭州 311300; 3. 杭州医学院图书馆, 浙江 杭州 310052)
随着肺移植、肺溶栓治疗以及心肺复苏术等的普及,肺缺血/再灌注损伤(lung ischemia/reperfusion injury,LI/RI)的发生率正在逐渐增加。以往研究表明,氧化应激、炎症反应、细胞凋亡及缺血后处理等在其中发挥了重要作用[1-4], 细胞自噬(autophagy)作为近年来的研究热点,在脑、心、肾等重要脏器的缺血/再灌注损伤中均发挥了重要作用,但对于细胞自噬在LI/RI中的作用关,详细报道甚少。本研究旨在通过SD大鼠LIRI模型,探讨细胞自噬在LIRI中所起的作用,为临床防治LIRI提供理论基础。
1 材料与方法
1.1 实验动物与主要试剂
雄性SD大鼠40只,体重250 g±30 g,购于温州医科大学实验动物中心。二甲基亚砜(DMSO)、3-甲基腺嘌呤(3-methyladenine, 3-MA) 和雷帕霉素(Rapamycin, Rap)均购于上海生工生物技术有限公司,自噬相关蛋白p-AMPK/AMPK、p-mTOR/mTOR、LC3 II、P62、Beclin-1、GAPDH抗体购自英国abcam公司,二抗购自中国博蕴、BCA蛋白定量试剂盒购自中国碧云天生物技术研究所。
1.2 大鼠肺缺血/再灌注损伤模型制备
将大鼠禁食12 h后称重,腹腔注射水合氯醛(3 ml/ kg)对大鼠进行麻醉,消毒后纵形切开颈部皮肤,暴露气管后进行气管插管并接小动物呼吸机行机械通气。调节呼吸机参数为呼吸频率每分钟70次,吸呼比3∶4,潮气量30 ml/kg,同时氧气瓶供纯氧。于大鼠左胸部3~5肋间开胸,用动脉夹阻断左侧肺门,通气时若观察肺组织不再膨胀,表明阻断成功。左肺门阻断30 min后松开动脉夹,观察左侧肺组织恢复膨胀后,再灌注3 h。实验期间注意保温,监测大鼠生命体征。灌注结束后,剪破大鼠心脏处死大鼠,留取左肺组织。
1.3 实验分组与处理
将40只SD大鼠按随机方式分为5组(n=8):(1)假手术组(Sham组):气管插管并开胸处理,不夹闭肺门,机械通气3 h 30 min;(2)缺血/再灌注组(I/R组):开胸后保持机械通气,用动脉夹将左侧肺门夹闭,30 min后松开动脉夹,人为制造再灌注3 h;(3) 溶剂组(DMSO组):气管插管前1 h腹腔注射10% DMSO溶液,剂量 20 ml/ kg,余操作同I/R组;(4)自噬拮抗剂组(3-MA组):气管插管前1 h腹腔一次性注射3-甲基腺嘌呤的DMSO溶液,药物浓度30 mg/kg,余操作同I/R组;(5)自噬激动剂组(Rap组):气管插管前1 h腹腔一次性注射雷帕霉素的DMSO溶液,药物浓度1.5 mg/kg,余操作同I/R组。
1.4 肺损伤情况检测
实验结束对大鼠实施安乐死,取左肺并用生理盐水漂洗组织表面残留血液,吸干表面水分后称重,记录重量为湿重(wet weight,W);在恒温电热鼓风干燥箱70℃ 24 h烘干后称重,记为干重(dry weight,D),两者之比为肺W/D;总肺含水量(total lung water content,TLW)计算公式如下:TLW=(W-D)/D×100%。同时,剪取左肺下叶,修剪组织并清洗表面血液后,经过组织固定脱水、透明、浸蜡、包埋、切片、HE染色等步骤,用光镜观察组织形态,同时采用肺泡损伤率(IAR)作为肺泡损伤定量指标,IAR=损伤肺泡个数/总计肺泡个数×100%。同时,低温从左肺门附近处取1 mm3大小的组织块,将组织块浸入2.5%的戊二醛固定液内,混合均匀后于4℃冰箱内固定2 h以上,并依次经1%锇酸后固定、1%醋酸铀块染、酒精梯度脱水、丙酮浸透、包埋聚合、制作半薄切片和超薄切片后等步骤后,透射电镜下观察肺组织肺泡上皮细胞形态并拍照。
1.5 自噬相关蛋白在大鼠肺组织中的表达
各组取出适量肺组织,剪碎后用1 mmol/L PMSF的RIPA裂解液1 000 μl,加入磁力珠在磁力匀浆机上匀浆,充分裂解30 min后4℃,13 000 r/min 低温高速离心5 min,得到蛋白溶液,并进行BCA蛋白定量检测,测定浓度后采用Western blot方法检测肺组织自噬相关蛋白的表达,主要包括SDS-PAGE电泳、转膜(湿转)、封闭与杂交、化学发光并成像,用ImageJ软件进行灰度值分析,将LC3 II、Beclin 1、p62蛋白条带的累积光密度(IOD)分别与内参蛋白GAPDH条带相比,比值作为反映蛋白表达水平的相对指标。将p-AMPK与AMPK蛋白条带IOD之比、p-mTOR与mTOR蛋白条带IOD之比作为反映蛋白磷酸化表达水平的相对指标。
1.6 统计学处理
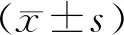
2 结果
2.1 自噬对大鼠肺W/D和TLW的影响
与sham组相比,其余各组的肺W/D、TLW均有升高(P<0.01);与I/R组、DMSO组分别相比,3-MA组肺W/D、TLW有下降(P<0.05),而RAP与I/R组,RAP与DMSO组间的W/D、TLW变化均无统计学差异(P>0.05,表1)。作为反映肺组织损伤程度的指标,W/D、TLW的变化说明肺缺血/再灌注会引起肺组织损伤,而自噬抑制剂3-MA可减轻这一损伤,加用自噬激动剂Rap后对肺组织损伤影响相较于I/R组和DMSO组无明显差异。

Tab. 1 comparison of W/D, TLW and IAR of lung tissues in each group n=8)
2.2 自噬对大鼠肺组织结构的影响
光镜下可见,sham组肺间质及肺泡结构清晰完整,肺泡上皮细胞形态正常,间质无水肿,无炎症细胞浸润,腔内未见明显渗液或红细胞;而其余各组肺间质均有不同程度水肿,有肺泡变形塌陷,肺泡腔内可见散在分布的红细胞,肺泡壁也可见更多炎性细胞浸润。与I/R组、DMSO组和Rap组相比,3-MA组肺泡结构紊乱有所减轻,水肿及渗出、红细胞漏出明显减少。而DMSO组和Rap组的肺组织结构损伤均较重 (图1)。与sham组相比,其余各组的肺IAR均明显升高(P<0.01);与DMSO组相比,3-MA肺IAR明显下降(P<0.01),而I/R、DMSO组IAR变化无统计学差异(P>0.05表1)。
2.3 自噬对大鼠肺组织超微结构的影响
透射电镜下可见,sham组的肺泡细胞结构完整,线粒体无水肿,形态较扁,嵴线分明,板层小体内容物丰富;其余各组的细胞内部结构出现不同程度的紊乱。其中I/R、DMSO、Rap组的线粒体发生高度水肿,嵴线溶解甚至消失,板层小体内容物减少,可见自噬体的形成;而3-MA组的肺泡细胞损伤则减轻,线粒体轻微肿胀,结构相对较为完整,板层小体内容物较为完整,无明显细胞自噬小体(图2)。
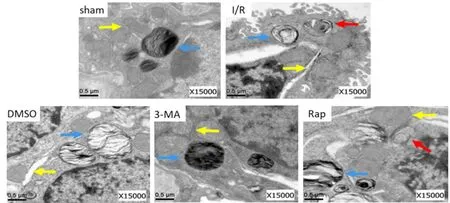
Fig. 2 Lung tissues ultrastructure of each group under electron microscopy(×15 000)
2.4 自噬对大鼠肺组织自噬蛋白表达的影响
Western blot检测结果显示,与sham组相比,其余各组肺组织的AMPK蛋白磷酸化水平和Beclin 1、LC3 II 蛋白表达均有明显升高,mTOR蛋白磷酸化水平和p62蛋白表达有明显下降(P<0.05或P<0.01);与DMSO组相比,3-MA组的AMPK蛋白磷酸化表达和Beclin 1、LC3 II 蛋白表达均明显下降(P<0.05或P<0.01),mTOR蛋白磷酸化水平和p62蛋白表达有明显上升(P<0.01)。而I/R组、DMSO组和Rap组两两比较,LC3 II、Beclin 1、AMPK和p62蛋白表达无明显差异(P>0.05),但Rap组的p-mTOR蛋白表达较DMSO组明显升高(P<0.01,图3,表2)。
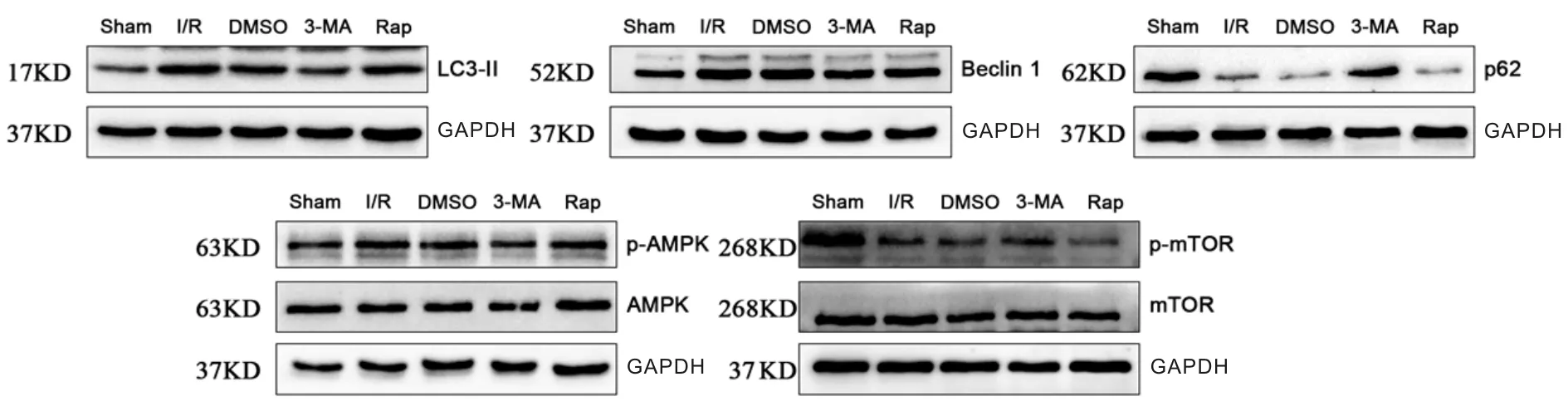
Fig. 3 The protein expressions of LC3 II,Beclin 1, p-AMPK p-mTOR and p62 of lung tissues in each group
3 讨论
细胞自噬最早由Ashford和Porter提出,通过自噬溶酶体(autophagosome)完成对细胞自身衰老或异常结构的更新。在饥饿时,自噬也会得到增强,诱发部分细胞器或细胞结构的损伤,以暂时维持细胞核心功能的正常[5],比如脑[6, 7]的缺血/再灌注等可引起细胞自噬从而起到其保护作用。但研究也表明,某些情况下,比如在心肌中[8],细胞自噬水平上调在某些情况下不仅不利于细胞内稳态的维持,反而会加剧细胞损伤。

Tab. 2 The protein expressions of LC3 II,Beclin 1, p-AMPK p-mTOR and p62 of lung tissues in each n=8)
腺苷单磷酸活化蛋白激酶(AMPK)和雷帕霉素靶蛋白(mTOR)是自噬信号通路中的上游蛋白。前者通过ATP与AMP的含量变化感知能量代谢状态:能量不足时,ATP减少,AMP增加,使AMPK磷酸化激活。后者在能量充足时,磷酸化的mTOR可通过抑制自噬起始分子ULK1/2而抑制自噬的发生。mTOR受到PI3K/Akt[9]、MAPK/ERK[10],肿瘤蛋白p53[11]等多重调控。在本研究中使用的雷帕霉素,是mTOR的特异性抑制剂,可以间接认为是自噬的激动剂。此外,正常情况下Beclin 1与Bcl-2形成复合物抑制自噬信号的传递,而Beclin 1的释放会引起自噬的发生[12], Beclin1可与PI3K class III、VPS15一同形成PI3K class III-VPS15-Beclin1复合体。在实验操作中,往往使用3-MA作为PI3K class III特异性抑制剂,通过抑制PI3K class III从而抑制自噬的进行。此外,LC3也可作为自噬的标志性蛋白,其表达水平可有效反映细胞内自噬体的数量[13, 14]。据报道,在肺缺血/再灌注后测量LC3-II蛋白水平的结果表明,其表达较未灌注前升高更加明显[15]。p62可与定位在自噬小体内膜上的LC3II形成复合体,从而削弱LC3 II的活性,同时,p62蛋白本身又受自噬作用的调节,其表达与细胞自噬活性呈负相关[16]。故LC3 II和p62的含量能很好的反应组织细胞内的自噬水平变化。
通过测量自噬上游蛋白AMPK、mTOR磷酸化情况以及Beclin 1、LC3-II、 p62等自噬通路效应蛋白表达,可以对肺组织在经历缺血后进行再灌注时诱导自噬活性的情况有一个较全面的了解。本实验结果显示,与sham组相比,其余各组肺组织损伤加重,蛋白检测也显示自噬水平上调,细胞超微结构出现不同程度的紊乱,其中I/R、DMSO、Rap组线粒体高度水肿,可见疑似自噬小体结构的出现。这表明肺组织发生缺血/再灌注时,肺组织均会出现自噬的高表达。而I/R组与DMSO组相比无明显差异,说明在该剂量的DMSO浓度下,对组织造成的影响没有统计学意义;而同DMSO组相比,自噬激动剂组的激动效应并不十分显著,仅有部分蛋白表达有统计学差异,这可能是因为肺损伤本身的作用与自噬激动剂的作用有较大重叠,使得自噬激动剂的损伤作用被掩盖,对此尚有待进一步的研究。而应用了自噬抑制剂3-MA后,细胞损伤情况有所改善,线粒体水肿较为轻微,并且未观察到自噬小体,可认为抑制自噬可减轻缺血/再灌注带来的细胞和损伤。
综上所述,肺缺血/再灌注可诱发细胞自噬增强,从而引起大鼠肺组织损伤;使用自噬抑制剂可减轻LIRI,为其临床应用提供确切的理论依据。
