颗粒蛋白前体通过抑制IL-6表达减轻哮喘气道炎症*
2021-10-22齐玉红吴光英胥文春
齐玉红, 孙 思, 王 玲, 杨 静, 吴光英, 黄 琪, 胥文春△
(1. 重庆医科大学检验医学院、临床检验诊断学教育部重点实验室, 重庆 400016; 2. 重庆两江新区第一人民医院检验科, 重庆 401147)
哮喘是一种慢性气道炎症性疾病,由多种细胞(中性粒细胞、肥大细胞、嗜酸性粒细胞等)和细胞组分参与,主要症状为呼吸困难、咳嗽、喘息等。激素是其常规治疗药物,然而长期使用易引发耐受及严重副作用,进一步阐明哮喘的发病机制可为新治疗策略的研究奠定基础[1]。
颗粒蛋白前体(progranulin, PGRN)是一种多功能分泌性生长因子,参与机体组织损伤修复、炎症、肿瘤发生等病理生理过程[2]。有报道显示哮喘患者血清PGRN水平显著低于健康人[3],在甲苯二异氰酸酯暴露所致的职业性哮喘患者血清中PGRN水平也明显低于正常对照组[4],而重组PGRN滴鼻处理能够减轻过敏性哮喘小鼠气道高反应[1],这些研究表明PGRN可能参与了哮喘的发生发展,然而其机制并不清楚。IL-6作为重要的促炎因子,可诱导初始T细胞向Th17细胞极化,而Th17又与中性粒细胞募集相关,中性粒细胞增多可加重哮喘气道炎症[5]。与正常对照组相比,过敏性哮喘患者疾病发作期外周血IL-6水平明显升高[6],且有报道称PGRN的特异性沉默可促进IL-6的产生[7,8],因此我们推测PGRN在哮喘中发挥作用可能与IL-6有关。本课题旨在通过构建体内外哮喘模型,研究PGRN是否通过影响IL-6的表达而在哮喘中发挥作用以及其中的机制。
1 材料与方法
1.1 实验动物
6-8周的C57BL/6雌性小鼠购于重庆医科大学实验动物中心,IL-6 ko小鼠购于Jackson实验室,以上小鼠均饲养于重庆医科大学实验动物中心。实验动物许可证号:SCKK(渝)2012-0001。所有动物实验操作均严格遵守学校实验动物伦理委员会管理规定。
1.2 主要试剂
鸡卵清蛋白OVA、铝佐剂和戊巴比妥钠(Sigma-Aldrich,USA);细胞因子IL-5、IL-6和IgE ELISA检测试剂盒(Biolegend,USA);小鼠及人PGRN ELISA试剂盒(R&D,USA);RNAiso plus及cDNA逆转录试剂盒(Takara,Japan);RIPA和BCA试剂盒(碧云天生物技术研究所);人IL-13(PeproTech, USA);重组人PGRN(R&D,USA);兔抗鼠p-p38抗体(美国CST公司)。
1.3 构建小鼠哮喘模型
分别在野生鼠和IL-6 缺陷鼠(6~8周的雌性C57BL/6小鼠)中设置对照组和哮喘模型组,每组8只。模型组中,在第0日和第7日致敏小鼠(腹腔注射OVA 100 μg),从第14日起连续激发8 d(5%OVA雾化吸入,30 min/d,每日1次),末次激发24 h后取标本(图1);对照组用PBS代替OVA做相同处理。采集支气管肺泡灌洗液(BALF)进行白细胞计数和分类计数;HE染色观察肺组织病理情况;Q-PCR及ELISA检测小鼠肺匀浆、血清和BALF中细胞因子水平。
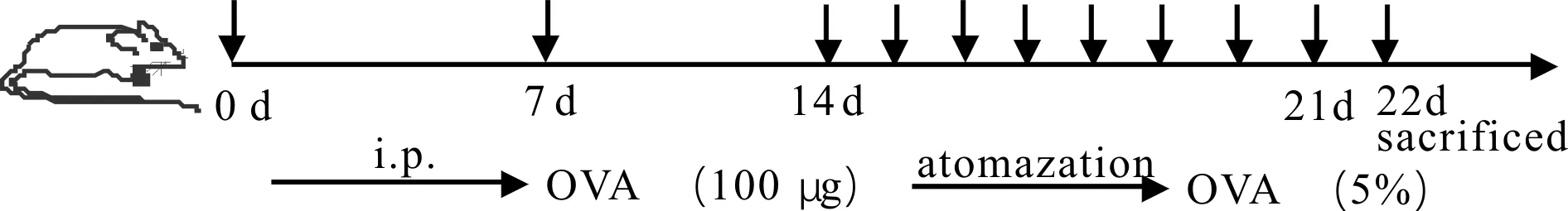
Fig. 1 Method for constructing mice model of asthma
1.4 体外哮喘炎症模型的构建及细胞的处理
用IL-13刺激人肺泡上皮细胞A549或支气管上皮细胞BEAS-2B建立体外哮喘炎症模型,每组3个复孔,共4组:PBS处理组、IL-13处理组、IL-13与重组人PGRN蛋白(rhPGRN)共同处理组及p38磷酸化抑制剂(SB203508)处理组。具体处理方法如下:PBS组仅加入无抗生素培养基2 ml/well;IL-13处理组加入含IL-13(200 ng)的无抗生素培养基2 ml/well;IL-13与rhPGRN共同处理组加入含IL-13(200 ng)和rhPGRN(500 ng)的无抗生素培养基2 ml/well;P38磷酸化抑制剂(SB203508)处理组加入SB203508预处理1 h后,再加入含IL-13(200 ng)和rhPGRN(500 ng)的无抗生素培养基2 ml/well;处理0 min~48 h后收集细胞及上清,用Q-PCR及ELISA检测PGRN和IL-6的表达;Western blot检测p38的磷酸化。
1.5 Q-PCR检测
使用RNAiso Plus从肺组织中提取RNA,然后使用cDNA逆转录试剂盒根据其说明书进行逆转录。采用SYBR Premix Ex Taq试剂盒对cDNA进行Q-PCR分析,以GAPDH作为内参。本研究中用于Q-PCR的引物序列见表1。
1.6 ELISA检测
用ELISA检测IL-5、IL-6、IgE和PGRN的蛋白水平,其具体操作参考试剂盒说明书。
1.7 Western blot
RIPA法提取细胞总蛋白,BCA蛋白试剂盒检测总蛋白浓度。取50 μg蛋白上样,电泳;转膜;5%奶粉室温封闭1.5 h;兔抗鼠p-p38抗体、兔抗鼠GAPDH多克隆抗体4℃孵育过夜;TBST洗膜3次,并于室温孵育HRP标记的羊抗兔IgG抗体1 h;TBST洗膜3次后,于干化学发光显影仪上进行发光显影。
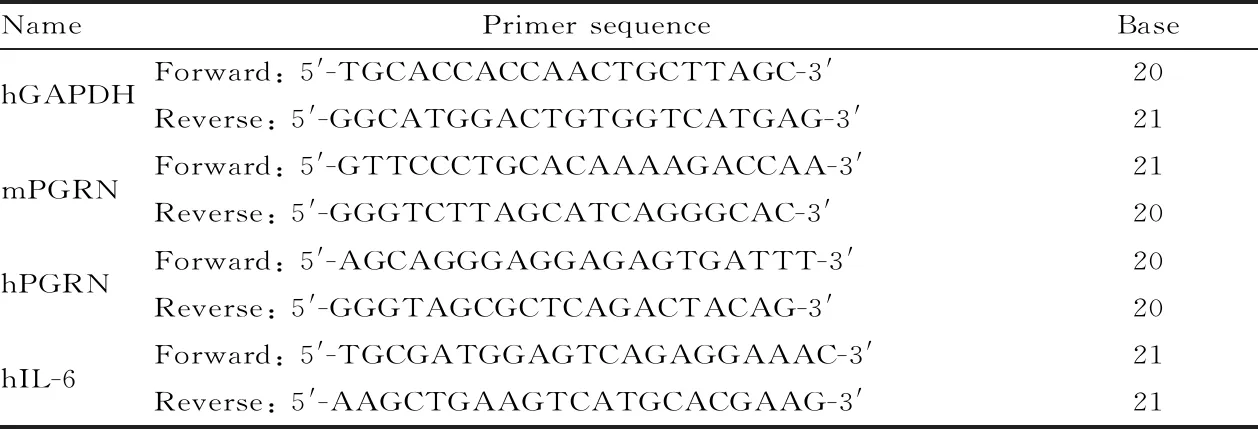
Tab. 1 The sequences of PCR primers
1.8 肺组织切片染色
于OVA末次激发后24 h获取小鼠肺组织,并固定在4%的多聚甲醛溶液中,经脱水、透明、浸蜡、包埋、切片,最后进行苏木精-伊红(HE)染色或糖原(PAS)染色。
1.9 统计学处理
2 结果
2.1 体内哮喘模型中PGRN和IL-6的表达
文献报道哮喘患者血清PGRN水平明显低于健康人[3]。为研究小鼠哮喘模型中PGRN的变化情况,我们构建了混合型哮喘模型(中性粒细胞和嗜酸性粒细胞都升高)。与对照组小鼠相比,哮喘组小鼠肺组织损伤更严重,炎症细胞浸润增加,PAS染色显示粘液分泌增多(图2);BALF中细胞总数升高(P<0.01,表2),中性粒细胞、嗜酸性粒细胞、淋巴细胞和巨噬细胞均显著升高(P<0.01, 表2);BALF及血清中IL-5及IgE均显著升高(P<0.01,表3)。这些结果表明小鼠哮喘模型构建成功。
与对照组小鼠相比,模型组小鼠肺组织PGRN的mRNA表达水平显著降低(P<0.01, 表4),BALF中PGRN蛋白显著降低(P<0.01,表4),血清PGRN蛋白有降低的趋势(表4),这与文献报道的哮喘患者体内PGRN表达降低基本一致。我们同时检测了IL-6的表达,结果显示,模型组小鼠BALF中IL-6水平显著高于对照组(P<0.05,表4)。
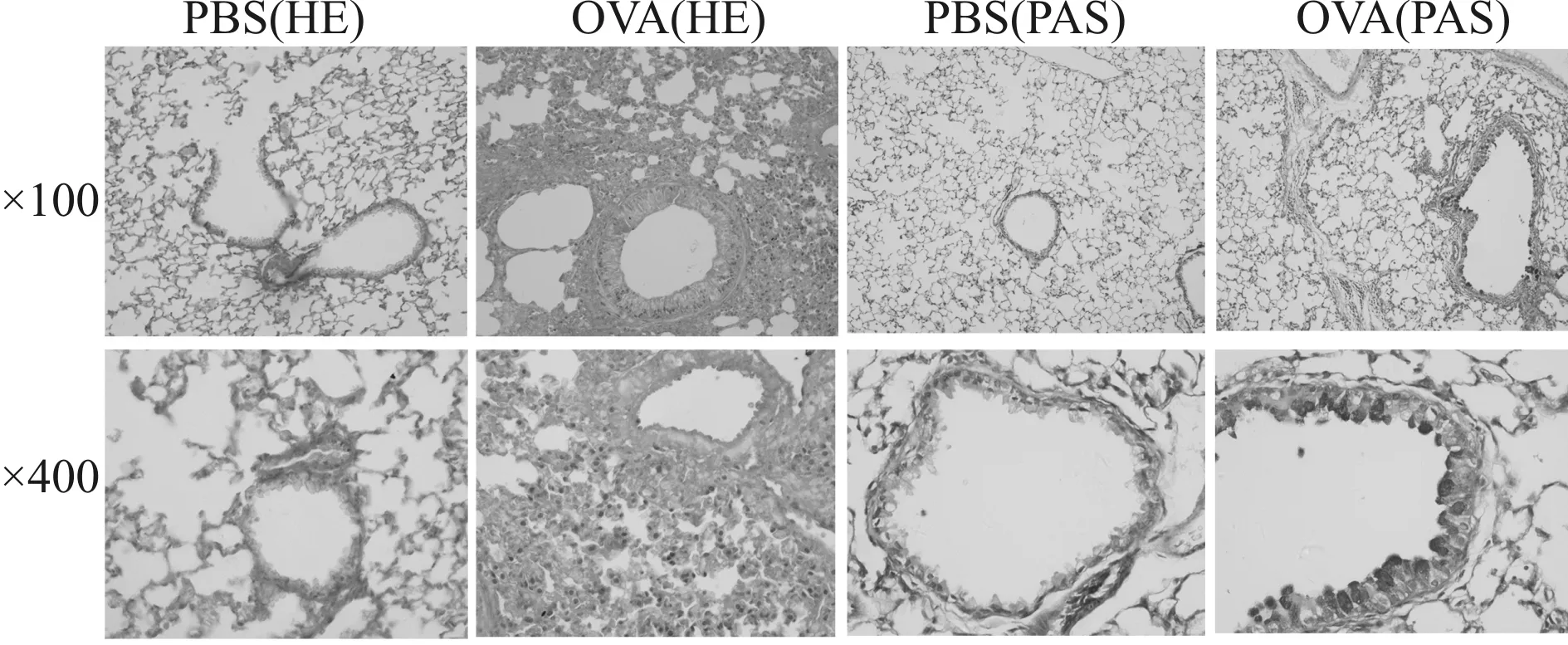
Fig. 2 Photomicrographs of HE and PAS-stained lung tissue sections of mice
Tab. 2 Total inflammatory cells and the differential cell counts in BALF of mice (×104, n=8)

Tab. 3 Levels of IgE and IL-5 in serum and BALF of mice n=8)

Tab. 4 The expressions of PGRN and IL-6 in mice n=8)
2.2 体外哮喘炎症模型中PGRN和IL-6的表达
为了解体外哮喘模型中PGRN和IL-6的表达情况,我们用IL-13(100 ng/ml)处理人肺泡上皮细胞A549或支气管上皮细胞BEAS-2B构建体外哮喘炎症模型[9]。结果显示,与PBS组相比,IL-13处理人肺泡上皮细胞A549 6 h后PGRN mRNA水平显著降低(P<0.05,表5);48 h后PGRN蛋白水平也显著降低(P<0.05,表5)。用IL-13处理BEAS-2B后得到相似的结果(表5)。与PBS组相比,用IL-13处理A549 6 h后IL-6 mRNA表达升高(P<0.05,表5);IL-6蛋白水平也在刺激48 h后升高(P<0.01,表5)。这些结果表明PGRN和IL-6的表达在体内外模型中是一致的。

Tab. 5 Levels of PGRN and IL-6 in vitro inflammation model n=3)
2.3 体外哮喘炎症模型中rhPGRN对IL-6的调节
体外培养人肺泡上皮细胞A549,分别采用PBS处理、IL-13(100 ng/ml)单独处理、IL-13(100 ng/ml)+rhPGRN(250 ng/ml)共同处理,比较IL-6的变化情况。结果显示,IL-13处理组的IL-6mRNA及蛋白水平均较PBS组增加(P<0.01,表6);而较单独IL-13处理组,IL-13+rhPGRN共同处理组中IL-6 mRNA及蛋白水平均显著降低(P分别为P<0.01及P<0.05,表6),提示在体外哮喘炎症模型中rhPGRN能降低促炎因子IL-6的表达。

Tab. 6 rhPGRN inhibited the production of IL-6 in vitro inflammation model n=3)
2.4 体外哮喘炎症模型中rhPGRN抑制IL-6产生的机制
MAPK信号通路对于IL-13刺激上皮细胞产生促炎因子至关重要[10],因此我们通过Western blot技术检测了MAPK信号通路的激活情况。结果显示,与对照组相比,IL-13处理后,肺上皮细胞A549的p38磷酸化水平增加(图3A),IL-6水平升高(P<0.05, 图4);用不同浓度的p38磷酸化特异性抑制剂SB203508(10 μmol/L、20 μmol/L)预处理A549细胞1 h后再用IL-13(100 ng/ml)处理,结果显示,与模型组相比,p38抑制剂处理组IL-6水平显著降低(P<0.05,图4),说明MAPK信号通路参与了哮喘模型中IL-6的产生。为探究PGRN对MAPK信号通路的影响,在体外哮喘模型的基础上,再给予rhPGRN处理,结果显示,rhPGRN抑制IL-13对上皮细胞p38磷酸化的激活(图3B)及IL-6的分泌(P<0.05,图4)。这些结果表明,在体外哮喘炎症模型中rhPGRN通过抑制p38磷酸化从而降低炎症因子IL-6的表达。
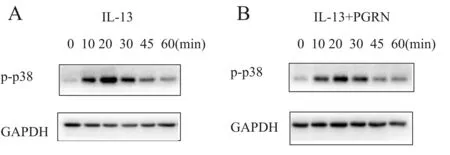
Fig. 3 The levels of p38 phosphorylation detected by Western blot after treatment with IL-13/ IL-13 + rhPGRN
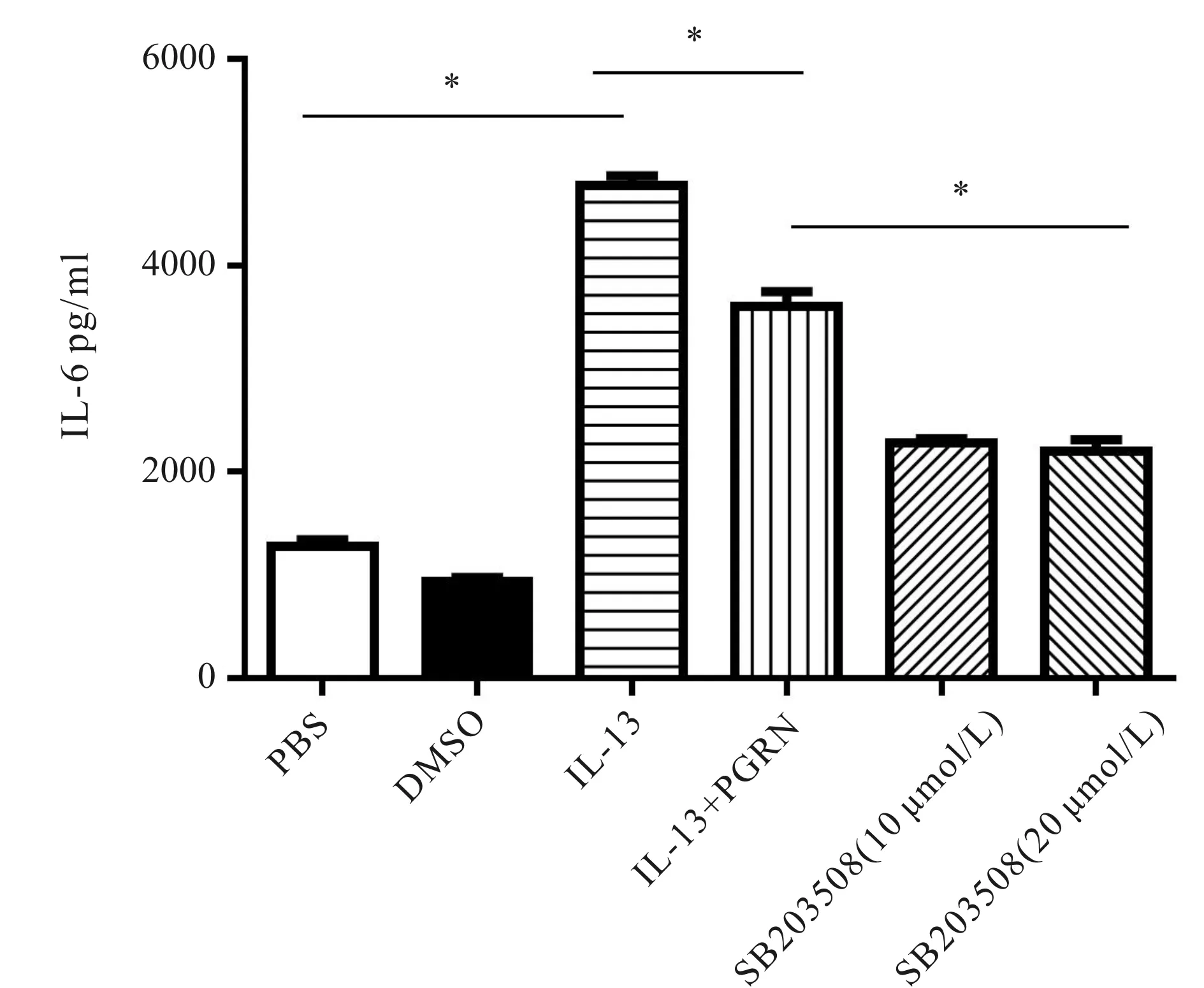
Fig. 4 The levels of IL-6 secreted by A549 cells with different treatment
2.5 IL-6 ko哮喘小鼠中PGRN的表达
有文献报道IL-6可促进中性粒细胞的募集[9],而中性粒细胞弹性蛋白酶可降解PGRN[11],因此我们推测在哮喘小鼠中,IL-6可能促进了中性粒细胞弹性蛋白酶对PGRN的降解。为了验证该推测,我们采用IL-6 ko小鼠构建哮喘模型,结果显示,与野生哮喘小鼠相比,IL-6 ko哮喘小鼠BALF细胞总数降低(P<0.05,表7),各类白细胞分类计数也降低,其中中性粒细胞降低显著(P<0.05,表7);支气管周围、肺泡及血管间隙的炎症细胞浸润减少,肺泡结构完整性较好,出血也减少(图5)。这些结果说明IL-6 ko小鼠的哮喘气道炎症得到显著改善。
同时我们检测了小鼠体内PGRN的表达,结果显示,与野生哮喘小鼠相比,IL-6 ko哮喘小鼠肺组织中PGRN mRNA表达无差异(表8),BALF中PGRN蛋白水平明显增高(P<0.05,表8),表明在小鼠哮喘模型中IL-6并不影响PGRN的产生,但IL-6 ko鼠BALF中PGRN蛋白水平增高,其原因可能是IL-6敲除后中性粒细胞的募集减少,从而使PGRN降解减少。
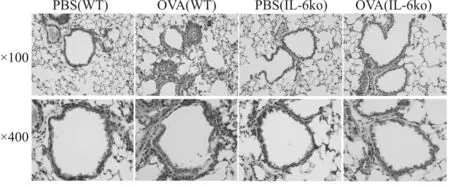
Fig. 5 Photomicrographs of HE-stained lung tissue sections of wild mice and IL-6 ko mice
Tab. 7 Total inflammatory cells and the differential cell counts in BALF of wild mice and IL-6 ko mice (×104, n=8)

Tab. 8 PGRN mRNA levels in lung tissue and PGRN protein levels in BALF of wild mice and IL-6 ko mice n=8)
3 讨论
PGRN不仅在机体生长发育、伤口修复和炎症反应等生理活动中发挥着重要作用,同时还参与了众多疾病的病理过程[12]。在多种疾病中,PGRN的表达均增加,如乳腺癌[13]、畸胎瘤[14]、系统性红斑狼疮[15]、风湿性关节炎[16]及肺炎[17]等。然而哮喘患者体内PGRN水平较健康人降低,其具体机制尚不清楚。
本研究构建了小鼠混合型哮喘模型,即BALF中嗜酸性粒细胞和中性粒细胞均明显增多。与对照组相比,哮喘小鼠肺组织和BALF中PGRN水平均显著降低,血清中PGRN蛋白也有降低的趋势,这与哮喘患者体内PGRN变化趋势基本一致。在体外哮喘模型中,与对照组相比,PGRN的mRNA及蛋白水平均降低。体内外实验均显示哮喘发生后PGRN的mRNA水平降低,表明PGRN的产生减少。
与哮喘相似,慢性阻塞性肺气肿(COPD)血清中PGRN水平也明显低于健康人,有学者认为是由于COPD患者体内增多的中性粒细胞所产生的弹性蛋白酶对PGRN有降解作用[18]。在哮喘气道炎症中,除了少见的寡细胞型外,中性粒细胞为主型、嗜酸性粒细胞为主型及混合型哮喘中,其中性粒细胞数量均高于正常人。那么哮喘患者体内PGRN水平降低,是否也与中性粒细胞弹性蛋白酶的降解作用有关?
IL-6是参与哮喘免疫应答的重要炎症分子之一,可由固有免疫细胞( 如巨噬细胞、树突状细胞和ILC2 细胞)及结构细胞( 如上皮细胞和内皮细胞)等分泌[19]。已知IL-6可促进Th17细胞极化,Th17产生IL-17促进中性粒细胞的募集[6, 12]。有研究表明哮喘患者血清IL-6水平越高病情越严重[20],阻断IL-6信号通路后减轻了哮喘小鼠气道炎症[21]。我们的结果显示,与野生哮喘小鼠相比,IL-6 ko哮喘小鼠BALF中性粒细胞数量显著降低,其肺部PGRN mRNA水平无明显改变,但BALF中PGRN蛋白水平升高。这说明在IL-6 ko哮喘小鼠体内,PGRN的产生与野生小鼠无差异,PGRN蛋白水平有所回升可能是由于中性粒细胞减少导致了弹性蛋白酶减少,因而PGRN降解减少。综上,我们认为PGRN在哮喘中表达降低的原因,一方面是PGRN的产生减少,另一方面可能是中性粒细胞弹性蛋白酶对其降解所致,但其具体机制有待进一步研究。
有文献报道,MAPK可调节人体炎症及免疫反应,在肺部炎症性疾病如COPD和哮喘中,MAPK发挥着重要作用[10]。我们使用IL-13处理人肺泡上皮细胞A549或支气管上皮细胞BEAS-2B建立体外哮喘炎症模型[9]。结果显示,与IL-13处理组相比,IL-13与PGRN共同处理组IL-6水平显著降低,P38的磷酸化水平也显著降低;与IL-13处理组相比,p38磷酸化抑制剂处理组IL-6水平显著降低,表明PGRN可通过抑制P38的磷酸化从而降低IL-6水平来减轻哮喘气道炎症。
本研究初步阐明了PGRN在哮喘中表达降低的原因及作用机制,为进一步研究PGRN在哮喘发生发展中的机制奠定了基础。
