黄芪甲苷对辐射诱发肾损伤的干预作用及其机制*
2021-10-22刘淑宁丁艳平徐郁琴张晋平邵宝平
刘淑宁, 丁艳平△, 徐郁琴, 康 洁, 张晋平, 邵宝平
(1. 西北师范大学生命科学学院, 甘肃 兰州 730070; 2. 兰州大学生命科学学院, 甘肃 兰州 730000)
如今,辐射的生物学效应及机制日渐成为研究热点,辐射可能会对机体产生不同水平的损伤[1]。肾脏是腹部放射损伤敏感器官之一,辐射可引起肾脏体积缩小, 皮质比例减小, 肾小球和肾小管细胞的结构改变,肾小管上皮细胞间隙增大, 部分上皮细胞肿胀、坏死等病理变化,出现以肾功能减退为特征的放射性肾病[2]。
研究表明,辐射损伤的重要机制之一是其诱发胞内活性氧(reactive oxygen species, ROS)的过量产生和蓄积,从而诱发氧化应激反应并进一步产生更多的 ROS,造成细胞的损伤和坏死[3]。硫氧还蛋白相互作用蛋白(thioredoxin-interacting protein, TXNIP)是氧化应激效应途径中的一个关键调控蛋白,ROS 能够促使 TXNIP从细胞核内转位进入细胞质[4]。已有研究发现,在一些疾病状态下,TXNIP 可与NOD样受体蛋白3(nod-like receptor pyrin domain containing protein 3, NLRP3)结合从而激活 NLRP3 炎性小体[5],进而引起下游生物学损伤效应。
黄芪中的主要活性成分——黄芪甲苷(astragaloside IV, AS-IV)作为天然产物,具有抗辐射、抗氧化、抗高血压、抗炎症、抗凋亡等作用[6,7]。本实验通过建立小鼠体内肾脏辐射模型并进行 AS-IV 干预,首次探讨了 AS-IV 是否能通过抑制 TXNIP/NLRP3 信号通路减轻辐射诱导的小鼠肾脏氧化应激损伤。
1 材料与方法
1.1 实验动物与分组
清洁级雄性5~6周龄昆明小鼠100只,购于兰州大学医学院动物实验中心(SYXK(甘)2018-0002)。所有动物在标准饲养的环境下饲喂食物和饮水,并在西北师范大学实验动物伦理委员会监控下进行。以 DMSO 作为溶剂,配制 AS-IV 溶液。将小鼠随机分为5组,Control 组、DMSO 溶剂组、IR 组、IR+AS-20 mg/kg 组和 IR+AS-40 mg/kg 组,每组20只小鼠。IR+20 mg/kg和IR+40 mg/kg 组小鼠每天分别于腹腔注射20 mg/kg、40 mg/kg 的AS-IV;DMSO 组和 IR 组于腹腔注射体重对应的DMSO;Control 组腹腔注射生理盐水。腹腔注射一个月后,除 Control 组与 DMSO 组外,其他3组在兰州威特辐照有限公司接受剂量为8 Gy的60Coγ射线单次全身辐射,吸收剂量率为1.143 Gy/min,总时长7 min。辐射完5 d后,每组取10只小鼠脱臼处死,快速取出肾脏组织置于液氮中,用于 ROS 水平检测及免疫印迹(Western blot,WB)分析;另外10只进行心脏灌流处理,灌注完成后取肾脏组织固定于4%多聚甲醛中,用于形态学观察及免疫组化染色。
1.2 实验试剂
AS-IV(纯度>98%,货号MB1955)购自美仑生物,DMSO和 BCA 蛋白定量试剂盒购自Solarbio公司,兔多克隆抗体 TXNIP 购自华安生物公司,兔抗细胞凋亡诱导蛋白抗体(NLRP3)和兔抗肿瘤坏死因子-α抗体(TNF-α) 购自博奥森公司,兔多克隆抗体白细胞介素-1β(IL-1β)和兔多克隆抗体 Caspase-1 购自abcam公司,Ⅱ抗(生物素标记羊抗兔IgG)购自Immunoway公司。
1.3 HE染色检测肾脏组织形态学变化
将固定好的肾组织进行清洗、脱水、透明、浸蜡、石蜡包埋。制作7 μm的石蜡切片,经苏木精和伊红 (hematoxylin-eosin staining, HE) 染色后在光镜下观察各组肾脏结构特征。
1.4 ROS染色
取肾组织制作冰冻切片,用组化笔在组织周围画圈(防止液体流走),在圈内加入自发荧光淬灭剂5 min,流水冲洗10 min。在圈内滴加 ROS 染液,避光恒温箱37℃孵育30 min。玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5 min。切片稍甩干后用含有DAPI的抗荧光淬灭封片剂封片。晾干后采用荧光显微镜观察采集图像。
1.5 免疫组织化学染色
石蜡切片脱蜡,在0.1 mol/L柠檬酸钠缓冲液中煮沸18 min,3%的 H2O2避光30 min ,用山羊血清封闭1 h。然后将切片与兔抗 NLRP3(1∶200)和兔抗 TXNIP(1∶150)在4℃ 温育过夜,PBS 冲洗后加入二抗工作液(生物素标记的羊抗兔IgG),在室温孵育2 h,PBS 冲洗后,加入streptavidin / HRP工作液,室温孵育2 h,PBS 冲洗后,DAB 溶液染色,苏木精复染,中性树脂封片,晾干后采用光学显微镜观察采集图像。
1.6 蛋白质印迹
将小鼠肾脏组织置 RIPA 裂解液990 μl+蛋白酶抑制剂(PMSF)10 μl 中匀浆,4℃下以13 000 r/min离心30 min,取上清备用。采用BCA试剂盒测定上清中蛋白的量,以小牛血清白蛋白作为对照品。蛋白统一稀释后在沸水中煮15 min 以备用。上述提取的蛋白经 10%、12%、15% SDS-PAGE电泳分离后转移至 PVDF膜上,5%脱脂奶粉封闭,在一抗NLRP3、TXNIP、Caspase-1、IL-1β、TNF-α 中孵育过夜,与HRP标记的二抗进行反应。最终在膜上加 ECL显色液,用凝胶系统成像仪采集图像。
1.7 统计学处理
2 结果
2.1 AS-IV对小鼠肾脏组织形态学变化的影响
我们运用 HE染色观察肾脏组织形态学的变化。结果显示, DMSO 组的小鼠肾脏结构未见异常;与 DMSO 组相比,IR 组肾小球萎缩,肾小囊的空间变大,肾小管部分管腔扩张,胞质淡染,肾小管管腔内上皮细胞坏死、脱落;与 IR 组相比,IR+AS-20 mg/kg 组和IR+AS-40 mg/kg 组小鼠肾脏病理变化明显改善,其中IR+AS-40 mg/kg 组与 DMSO 组无明显差异(图1)。

Fig. 1 HE staining of mouse kidney tissue in the Control, DMSO, IR, IR+AS-20 mg/kg group and IR+AS-40 mg/kg group (×40)
2.2 AS-IV对小鼠肾脏组织内 ROS 水平的影响
我们检测了小鼠肾脏组织中 ROS 的水平(图2)。阳性结果分析表明,与 Control 组及 DMSO 组相比,IR 组 ROS 水平明显升高(P<0.01),而在 IR+AS-20 mg/kg 组和 IR+AS-40 mg/kg 组 ROS 水平明显少于 IR 组(P<0.01,表1)。
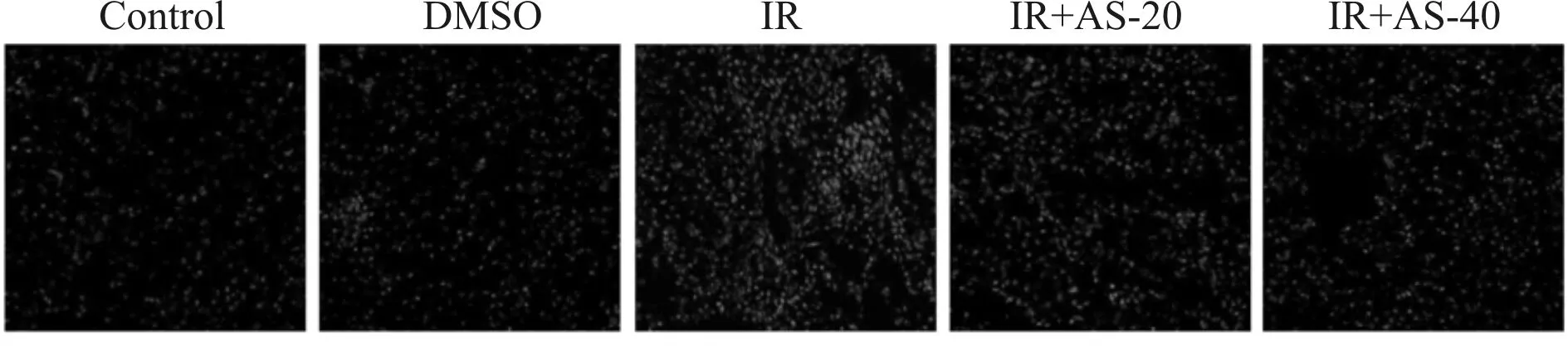
Fig. 2 Level of ROS in the Control, DMSO, IR, IR+AS-20 mg/kg group and IR+AS-40 mg/kg group (×40)
2.3 AS-IV对小鼠肾脏 NLRP3 和 TXNIP 蛋白及其通路相关蛋白表达变化的影响
我们用免疫组织化学法检测了各组小鼠肾脏组织中 NLRP3 和 TXNIP 的表达,棕褐色染色为阳性表达。结果显示,在 IR 组,NLRP3 和 TXNIP 阳性表达位于各级肾小管上皮细胞和肾小球系膜细胞,在 IR+AS-20 mg/kg 组和IR+AS-40 mg/kg 组,NLRP3和TXNIP 阳性表达主要位于近曲小管上皮细胞(图3)。数据分析显示 IR 组 TXNIP 和NLRP3 阳性细胞数量明显多于 Control 组及 DMSO 组(P<0.01),而IR+AS-20 mg/kg组和 IR+AS-40 mg/kg 组 TXNIP 和 NLRP3 阳性细胞数量极显著少于 IR 组(P<0.01,表1)。
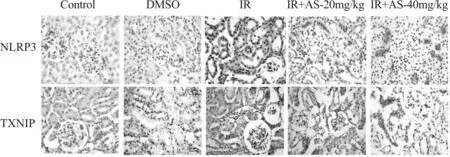
Fig. 3 Expression of NLRP3 and TXNIP in the Control, DMSO, IR, IR+AS-20 mg/kg group and IR+AS-40 mg/kg group (×40)
对 TXNIP/NLRP3 通路相关蛋白的检测结果表明,Control 组和 DMSO 之间无差异。与 DMSO 组相比,小鼠接受辐射处理后 TXNIP、NLRP3、Caspase-1、IL-1β 及TNF-α 的蛋白表达量明显呈上升趋势,具有极显著性差异(P<0.01)。与 IR 组相比,AS-IV组 TXNIP、NLRP3、Caspase-1、IL-1β、TNF-α 的表达显著降低(P<0.05,P<0.01),且 IR+AS-40 mg/kg 组 TXNIP 和 NLRP3 蛋白表达显著低于IR+AS-20 mg/kg 组(P<0.05)。这表明AS-IV给药处理能显著抑制辐射诱导的 TXNIP、NLRP3、Caspase-1、IL-1β 及TNF-α的高表达,通过抑制 TXNIP/NLRP3 途径而产生防护作用(图4,表2)。
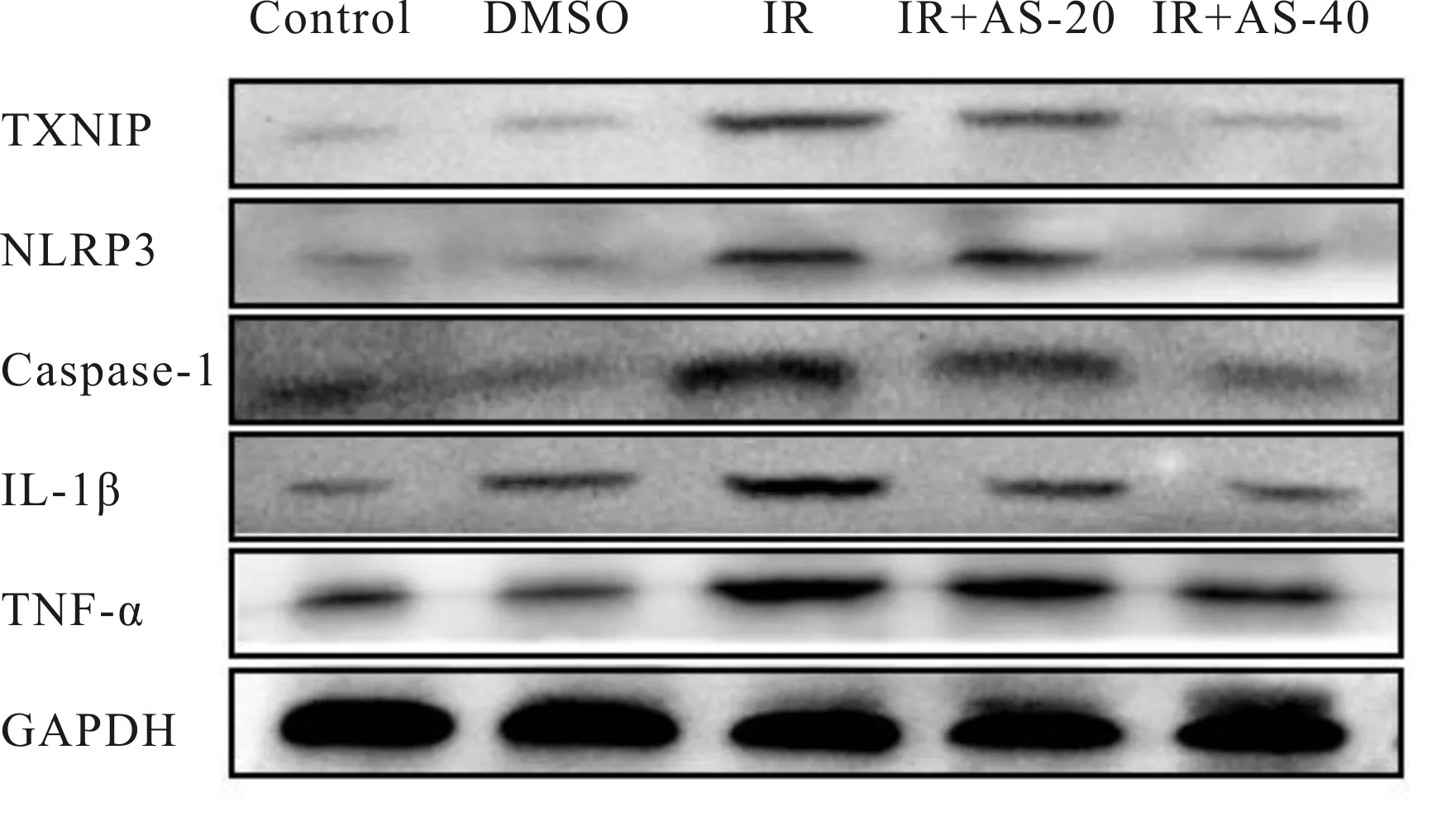
Fig. 4 Effect of AS-IV on the expression of TXNIP, NLRP3, Caspase-1,IL-1β and TNF-α in the kidney of mice induced by radiation

Tab. 1 Changes of ROS、TXNIP and NLRP3 in different groups n=5)
Tab. 2 Comparison of TXNIP, NLRP3, Caspase-1, IL-1β and TNF-ɑ relative protein n=5)
3 讨论
电离辐射的种类很多,γ射线是其中的一种。虽然60Coγ射线常用于肿瘤和癌的放射治疗[8],但也会导致机体的系统或组织水平的急性损伤,目前认为其机制主要与氧化应激、炎症反应、免疫抑制等有关[9]。肾脏是腹部放射性敏感器官中损伤最为严重的一个[2],与其他组织的上皮细胞相比,肾小管上皮细胞对辐射更敏感,可出现肾脏多种病理变化,导致机体肾功能减退[2],因此探讨辐射所致肾损伤的机制及有效防治措施具有重要意义。近年来,中药在辐射损伤防治方面表现出较大优势。AS-IV 作为天然化合物,已明确其具有抗辐射、抗氧化、抗炎症、抗高血压、抗凋亡等作用[6,7],但是其对于60Coγ射线全身照射所致肾脏损伤是否有防护作用及其机制,目前尚未见报道,本文就此进行了探讨。
氧化应激在多种肾脏疾病中发挥重要作用,在肾脏病进程中产生的大量 ROS 能使脂质分解而形成丙二醛(malonaldiadehyde, MDA),从而引起氧自由基增多,加剧氧化应激过程[10],引发蛋白质和脂质过氧化以及 DNA 损伤,进一步损伤肾脏[11]。同时,氧化应激也是电离辐射对机体损伤的重要机制之一,电离辐射会导致短期 ROS 的急性产生和持续的氧化应激。而 AS-IV 在多种肾疾病或损伤中具有显著的抗氧化作用:AS-IV 能抑制高糖诱导的肾小球足细胞凋亡及 ROS 产生,显著降低高糖诱导的足细胞 MDA 并升高抗氧化物酶过氧化氢酶 (catalase, CAT) 及超氧化物歧化酶(superoxide dismutase, SOD)水平[12];减轻 H2O2诱导的肾小球系膜细胞氧化应激损伤及细胞存活率,使细胞内胞 ROS 产量降低[13]。在本实验中,辐射后小鼠肾小球萎缩,肾小囊的空间变大,肾小管部分管腔扩张,胞质淡染,肾小管管腔内上皮细胞坏死、脱落,这表明辐射能造成肾脏的病理损伤;ROS 检测结果表明辐射可使肾组织 ROS 水平显著增高;给予 AS-IV 处理后,其病理特征减轻,ROS 水平显著降低。这表明辐射可损伤肾脏,增高机体的氧化应激水平,且 AS-IV 具有抗氧化保护作用,这与LIU[14]等的研究结果一致。
硫氧还蛋白(thioredoxin, TRX)是细胞抗氧化应激的主要分子,TXNIP 在机体内广泛存在,是调节体内氧化应激水平的硫氧还原蛋白系统中的成员,可与 TRX 结合并对 TRX 进行负调节,从而提高机体的氧化应激水平[15,16]。TXNIP/NLRP3 信号通路是炎症反应的重要信号通路之一,在一些疾病状态下,TXNIP 可与 NLRP3 结合从而激活 NLRP3 炎性小体[5],并进一步诱导 caspase-1 活化,促进促炎细胞因子如 IL-18、L-1β 等的成熟和分泌,从而诱发炎症反应[4,17,18]。此外,TNF-ɑ 是参与系统性炎症和急性期反应的细胞因子之一,在肾脏损伤模型试验中表达升高[19]。研究表明,TXNIP/NLRP3 信号通路在糖尿病肾病[20]、脓毒症[21]及 BDE-47[22]导致的急性肾损伤中发挥重要作用,但是在辐射导致的肾损伤中是否有 TXNIP/NLRP3 信号通路参与尚无研究。本实验结果表明 IR 组 TXNIP 及 NLRP3 阳性物质广泛表达于各级肾小管上皮细胞,而 AS-IV 给药组 TXNIP 及 NLRP3 阳性表达明显少于辐射组,且阳性表达位于近曲小管上皮细胞;Western blot 检测结果表明 IR 组 TXNIP、NLRP3 及 Caspase-1、IL-1β、TNF-ɑ 蛋白的表达极显著高于 Control 组和 DMSO 组,而 AS-IV 给药处理能显著降低各蛋白的表达,本研究首次证明在辐射诱导的肾脏损伤中,TXNIP/NLRP3 信号通路发挥了重要作用,而 AS-IV 可能通过抑制 TXNIP/NLRP3 信号通路活化,对肾脏损伤起保护作用。
综上所述,辐射会诱发胞内 ROS 的产生,使细胞质中 TXNIP 表达上调,进一步激活NLRP3 炎性小体、Caspase-1、IL-1β 及 TNF-α 等炎症和凋亡相关因子;而 AS-IV 能够抑制 ROS 的产生,通过 TXNIP/NLRP3 信号通路抑制辐射诱导的炎症因子的产生,从而发挥肾脏保护作用。本实验表明 AS-IV 能以 TXNIP 作为抗氧化的靶点发挥作用,这为治疗辐射导致的肾损伤提供了新的治疗思路。
