党参总皂苷对TNBS诱导的大鼠溃疡性结肠炎的保护作用及其机制*
2021-10-22刘雪枫高建德陈正君
刘雪枫, 乔 婧, 高建德,3, 陈正君, 刘 雄△
(1. 甘肃中医药大学药学院, 兰州 730000; 2. 甘肃省中藏药化学与质量研究省级重点实验室, 兰州 730000;3. 甘肃省中药质量与标准研究重点实验室, 兰州 730000)
溃疡性结肠炎(ulcerative colitis, UC)是一种以腹泻、腹痛、血便为主要临床症状的非特异性慢性炎症性肠病,病变部位主要在直肠和结肠的粘膜或粘膜下层,常见于30~40岁的成年人。其发病机制为多因素所致,包括遗传易感性、上皮屏障缺陷、免疫反应失调和环境因素等[1]。该病治疗难度高、易反复发作,病程绵长,是世界卫生组织公认的难治性疾病[2]。 目前UC的治疗药物包括5-氨基水杨酸类、类固醇类和免疫抑制剂等,但副作用大,易出现停药反应。中药因其整体治疗和安全性方面的独到优势在治疗UC时展现出了良好的前景。传统中医学认为UC属于“肠癖”范畴,主要致病邪气为湿热,是脾胃虚弱、湿热内蕴、肾阳不足、瘀血阻滞等多个因素作用的结果[3]。党参是我国传统的补益药,为桔梗科党参Codonopsispilosula( Franeh. ) Nannf. 、素花党参CodonopsispilosulaNannf. Var.modesta( Nannf. )L. T. Shen 或川党参CodonopsistangshenOliv. 的干燥根,具有补中益气、健脾益肺的功效,临床上常用于脾肺气虚、咳嗽虚喘、内热消渴等症[4]。长久以来,以党参为主药的方剂在临床上广泛应用于发作期、缓解期溃疡性结肠炎的治疗[5]。查阅文献,至目前为止尚未见党参对UC模型的治疗作用及机制研究的相关报道。党参总皂苷是党参中重要的生物活性成分之一,现代药理研究表明其具有抗炎、抗氧化、抗溃疡、抗肿瘤、抗脂质过氧化、免疫调节等重要的临床应用价值[6-7]。因此,本研究属首次探索党参总皂苷对大鼠UC模型的保护作用及其可能机制,为党参的临床开发应用奠定科学依据。
1 材料与方法
1.1 动物、试剂和主要仪器
SPF级健康雄性Wistar大鼠(220±10)g, 50只,购于甘肃中医药大学动物实验中心(合格证号:SYXK(甘)2015-0005)。在22~24℃,相对湿度 40%~60 % 环境下,普通饲料、纯净水饲养。
党参药材购于兰州复兴厚中药饮片有限公司,经甘肃中医药大学王明伟副教授鉴定为桔梗科植物党参(Codonopsispilosula(Franch.)Nannf.)的根;柳氮磺胺吡啶(SASP,上海信谊天平制药厂);2,4,6-三硝基苯磺酸(TNBS,天津大茂化学试剂厂);水合氯醛(郑州市德众化学试剂厂);超氧化物歧化酶(SOD),丙二醛(MDA)检测试剂盒(南京建成生物工程研究所);RNA 提取试剂盒,cDNA 反转录试剂盒,实时荧光定量PCR检测试剂盒(德国QIAGEN公司,批号分别为157042224、160017598、157056248);小鼠SP试剂盒、兔SP试剂盒、DAB显色试剂盒(北京中杉金桥科技有限公司,批号分别为SP-9002、SP-9001、ZLI-9018);细胞核内核转录因子-κB(NF-κB)一抗(美国Genetex公司,GTX107678);白介素-6(IL-6)、白介素-10(IL-10)、肿瘤坏死因子α(TNF-α)引物序列均由上海生工生物公司合成,引物序列及产物长度见表1。
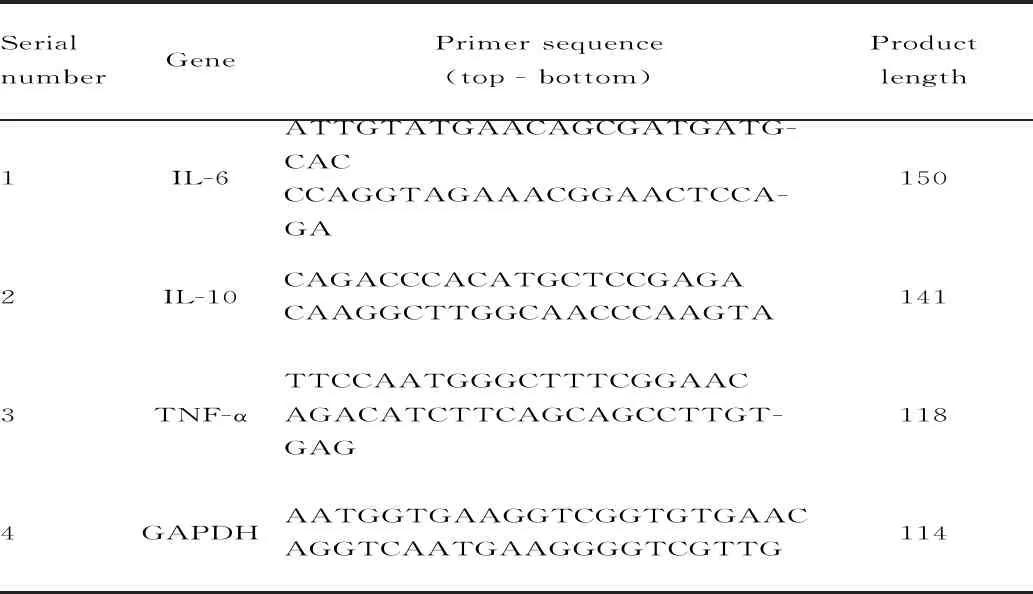
Tab. 1 Primer sequences and product length
Primo高速离心机(德国 Heraeus公司);KD-BM包埋机(浙江省金华市科迪仪器);切片机(德国莱卡公司);iMark酶标仪(美国Bio Rad公司);RX50显微镜(宁波舜宇仪器有限公司);NanoDrop核酸浓度测量仪(美国Thermo公司);DM7500实时定量PCR仪(美国Agilent公司);AE-240 电子天平(梅特勒-托利多仪器上海分公司)。
党参总皂苷(TSC)制备采取冷浸加超声法提取:粉碎后的党参药材浸泡23 h,加入无水乙醇使体积分数为71.5%,料液比1∶31,超声温度39.6℃,超声提取29 min,TSC得率为1.616%,具体方法详见参考文献[7]。
1.2 动物造模、分组及处理
50只 Wistar雄性大鼠,按体重随机分为5组,分别为对照组、模型组、柳氮磺胺吡啶(SASP)组 (0.3 g/kg)、TSC高、低剂量组(分别为1.2 g/kg, 0.4 g/kg,按生药量计算,为成人临床剂量的30,10倍)。各组动物继续给予相应药物灌胃,每日1次,连续5 d后,实验动物禁食36 h,水合氯醛麻醉,正常组以生理盐水灌肠,其余各组以100 mg/kg TNBS和50%乙醇溶液0.25 ml/只缓慢注入结肠约8 cm处进行灌肠[8]。造模后,连续3 d根据造模后大鼠体重下降率、粪便性状及大便隐血情况进行疾病活动指数(DAI)评分,DAI>0.5即代表造模成功,评分标准见参照文献[9]。造模成功后,各组动物继续给药21 d。末次给药后,大鼠禁食不禁水36 h,水合氯醛麻醉解剖,取从肛门向上至8 cm处的结肠组织,将结肠组织冻于液氮中,后续检测使用。
1.3 大鼠症状及体征观察
给药期间,观察各组大鼠体重变化,饮食饮水、自主活动是否正常,毛色有无光泽以及是否有腹泻便血出现。
1.4 大鼠结肠粘膜损伤评价[10]
将结肠组织纵向剖开,生理盐水洗净,平铺固定观察结肠黏膜,根据文献方法进行结肠黏膜损伤指数评价(CMDI)。0分:无损伤;1分,黏膜轻度充血水肿,表面光滑,无糜烂或溃疡;2分,黏膜粗糙呈颗粒状,充血水肿,有糜烂或肠粘连;3分,黏膜表面有坏死及溃疡形成,高度充血水肿,溃疡最大纵径小于1.0 cm,肠壁增厚或表面有坏死及炎症;4分,在3分基础上溃疡最大纵径大于1.0 cm或大鼠死亡。
1.5 大鼠结肠病理学组织观察
取1 cm结肠组织4 %多聚甲醛固定,梯度酒精脱水,常规石蜡包埋、切片,苏木素-伊红(HE)染色,光镜下观察组织病理学形态变化。
1.6 大鼠结肠组织生化指标检测
取适量结肠组织,加入生理盐水制备成10%匀浆,离心取上清后按照试剂盒方法检测结肠组织中超氧化物歧化酶(SOD)和丙二醛(MDA)含量。
1.7 大鼠结肠组织中IL-6、IL-10、TNF-α mRNA表达的测定
取各组大鼠结肠组织适量,加入液氮研磨,按照RNA提取试剂盒说明书提取RNA,采用多功能酶标仪测定样品的浓度。在PCR扩增仪上将RNA逆转录为cDNA,之后进行RT-PCR反应。反应条件为95℃预变性10 min,95℃变性15 s,60℃退火60 s,72℃延伸5 min,共40个循环。应用2-ΔΔCT方法计算各基因相对含量,每组实验重复四次。
1.8 大鼠结肠组织中NF-κB 蛋白的表达
采用免疫组化法观察结肠组织中NF-κB 蛋白的表达。切取3 mm大小的结肠组织,石蜡包埋后切制成5 μm厚的切片。切片常规脱蜡,梯度 70%乙醇水化,柠檬酸钠热修复两次后,3%的过氧化氢封闭内源性过氧化物酶;山羊血清封闭液封闭 30 min。每张切片滴加一抗 NF-κB(1∶200),4℃ 冰箱过夜,PBS 缓冲液冲洗后滴加聚合 HRP 标记抗兔 Ig G 37℃孵育 30 min,PBS 缓冲液冲洗后 DAB 显色10 min 左右,室温下苏木素复染90 s,自来水冲洗后,梯度乙醇脱水,二甲苯Ⅰ、Ⅱ各 25 min,中性树胶封片。显微镜下观察 NF-κB 蛋白表达情况。取同等倍数下的4个不同视野进行拍照,用Image Pro Plus软件计算。
1.9 统计学处理
2 结果
2.1 UC大鼠症状及体征观察
对照组大鼠一般情况良好,自主活动正常,饮食正常,毛色有光泽,无腹泻便血发生;造模后,模型组大鼠出现懒动,竖毛,厌食症状,有明显腹泻,甚至出现便血,体质量下降(P<0.01);SASP组、TSC高低剂量组一般情况较模型组好,大鼠毛色有光泽,自主活动增加,大鼠腹泻发生率低于模型组,体质量恢复正常(P<0.05)。从DAI评分来看,造模3 d后,与对照组比较,各组DAI评分显著增加(P<0.01),说明造模成功。给药21 d后,与模型组比较,SASP组和TSC组大鼠DAI评分显著下降,结果有统计学意义。TSC高剂量组DAI评分略低于低剂量组,但结果无统计学意义(表2)。

Tab. 2 DAI, CMDI scores of UC n=10)
2.2 UC大鼠结肠粘膜损伤情况
动物处死解剖后,肉眼观察可见对照组大鼠结肠颜色淡红,表面光滑,肠壁厚薄适中,黏膜皱襞清晰完整;模型组大鼠肠壁红肿充血,溃疡明显,溃疡面积较正常组显著增加(P<0.01,表2);SASP组、TSC组亦可见结肠水肿、充血或黏膜粗糙,但较模型组有很大程度改善。
2.3 UC大鼠结肠组织形态学变化
HE染色结果显示(图1),对照组染色均匀,细胞核形态正常,肠粘膜以及基层清晰可见。模型组与对照组相比较,有大量炎性细胞浸润,粘膜层损伤严重,基层分界线消失。与模型组比较,SASP组炎性细胞浸润减少,粘膜损伤较模型组减轻;TSC高剂量组与模型组相比较,炎性细胞明显减少,粘膜层损伤较轻,基层较清晰。
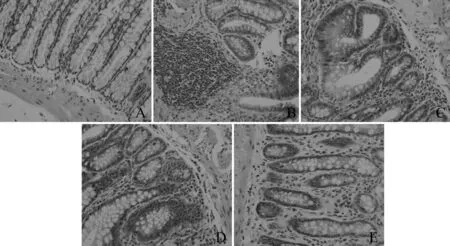
Fig. 1 Histopathological changes of colonic mucosa in rats stained with HE under light microscope(× 200)
2.4 UC大鼠结肠组织中SOD和MDA含量
如表3所示,与对照组相比,模型组大鼠结肠黏膜组织 SOD活力显著下降,MDA含量显著升高 (P<0.01);与模型组比较,SASP组大鼠结肠黏膜组织SOD活力升高,MDA含量下降,但结果无统计学意义;TSC高低剂量组均能提高结肠黏膜中SOD活力,降低MDA含量(P<0.05),且TSC高剂量组MDA含量显著低于SASP组和TSC低剂量组(P< 0.05)。

Tab. 3 SOD and MDA contents in colon tissues of UC n=10)
2.5 UC大鼠结肠组织中IL-6、IL-10、TNF-α mRNA表达
如表4所示,与对照组比较,模型组大鼠IL-6、TNF-α mRNA的表达量显著升高(P<0.01),IL-10 mRNA的表达量显著降低(P<0.01);与模型组相比,SASP组、TSC高低剂量组均能降低UC大鼠结肠组织中IL-6和TNF-α mRNA的表达水平,并提高抗炎细胞因子IL-10 mRNA的表达水平(P<0.05);TSC高剂量组降低IL-6 mRNA表达、升高IL-10 mRNA表达的能力优于SASP组和TSC低剂量组(P<0.05)。
Tab. 4 Expressions of IL-6, IL-10, TNF-α mRNA and NF-κB protein in colon n=10)
2.6 UC大鼠结肠组织中NF-κB 蛋白表达
如图2所示,通过免疫组化法,进一步观察了TSC及SASP对UC大鼠结肠组织中NF-кB蛋白表达的影响。结果显示与对照组比较,模型组大鼠结肠粘膜中NF-кB蛋白表达显著升高,而TSC高低剂量组能明显减少NF-кB蛋白的表达,作用比SASP组更加显著,且降低作用与给药剂量正相关(P< 0.05,表4)。

Fig. 2 Immunohistochemical detection of NF-κB protein expression in rat colon tissues(× 200)
3 讨论
溃疡性结肠炎(UC)是一种侵袭结肠黏膜的慢性非特异性炎性疾病,以反复发作、易癌变为特征[1],目前临床上尚无良好的治疗药物。UC发病机制复杂,与多种因素有关。因此,要选择有效治疗UC的药物必须考虑多环节、多靶点、多途径的治疗策略。中药作为我国几千年传统文化的瑰宝,其作用靶点多、安全性高,在临床治疗多种疾病中确有独特之处。有学者通过对2000~2015年期刊文献中记载临床治疗溃疡性结肠炎的处方进行频次统计分析,发现党参等三种中药出现频次均在100次以上[11]。党参是甘肃省大宗道地药材,具有补中益气、健脾益肺之效[4]。查阅文献发现,党参调节胃肠功能的研究主要集中在对胃溃疡动物模型的影响和改善胃肠动力方面[6],而鲜有对UC的治疗作用研究,并尚缺乏党参对UC的保护作用研究。因此,本研究观察了党参总皂苷(TSC)对UC模型大鼠的保护作用及其可能作用机制。
从实验结果来看,模型组大鼠结肠黏膜溃疡明显,疾病活动指数、结肠黏膜损伤指数显著升高,结肠组织中SOD活力下降、MDA含量升高,IL-6、TNF-α mRNA表达升高,IL-10 mRNA表达降低;免疫组化观察结肠组织NF-κB蛋白表达发现,模型组NF-κB蛋白含量明显比对照组大鼠增加,以上结果与文献报道一致[12],说明模型复制成功。MDA的产生是由细胞膜上的多不饱和脂肪酸进行脂质过氧化反应而来,该产物水平的高低反映了机体脂质过氧化的程度[13],而SOD是体内消除超氧阴离子的主要抗氧化酶系,其水平常作为临床上观察结肠黏膜损伤水平以及抗炎水平的重要指标[14]。实验结果显示,TSC对UC大鼠的疾病活动指数、结肠黏膜损伤指数及结肠黏膜形态均有明显改善,并使结肠中SOD活力增加、MDA含量下降,说明了TSC对UC模型大鼠的保护作用可能与抗脂质过氧化、抗炎有关。有研究表明,IL-6和TNF-α 能直接介入急性期炎症损伤过程,诱导结肠上皮细胞凋亡,促进UC的发生。相反,IL-10作为抗炎细胞因子,能够抑制TNF-α和IL-6等促炎性细胞因子产生[15]。NF-κB在UC发病过程中具重要作用,是各种致病因子释放和表达的关键。NF-κB被激活后转位进入细胞核,与靶基因的启动子结合,编码多种炎性因子的基因表达,包括IL-2、IL-6、IL-8、TNF-α等,从而进一步加速炎症级联反应[16]。给予TSC干预后,TSC高低剂量组均可以通过降低NF-кB的蛋白表达,降低结肠炎症因子IL-6、TNF-α mRNA水平,促进抗炎因子IL-10 mRNA表达。本实验中SASP与TSC低剂量组对UC大鼠的保护作用相当,TSC高剂量组保护作用优于二组,这可能是由于TSC在治疗UC时体现了多环节、多靶点、多途径的治疗策略,故其疗效略优于阳性药SASP,具体机制还需进一步探讨。
综上所述,TSC通过抗脂质过氧化、改善结肠黏膜损伤,抑制NF-κB的活化从而减少IL-6 和 TNF-α 等炎性因子的释放,增强抗炎因子IL-10的释放来发挥对UC大鼠的保护作用。
