HIF-1α参与调控三阴性乳腺癌MDA-MB-231细胞化疗耐药及体内外增殖的机制研究
2021-10-21王亮黄琰菁娄娜娜吴焕良
王亮,黄琰菁,娄娜娜,吴焕良
目前,乳腺癌作为一种恶性肿瘤严重威胁妇女身心健康,并给社会带来巨大的经济压力[1]。在我国,乳腺癌在女性恶性肿瘤中发病率最高[2]。三阴性乳腺癌(triple-negative breast cancer,TNBC)是一种具有高度侵袭性的乳腺癌亚型,占乳腺癌病例的15%~20%,具有较高的肿瘤异质性、低分化、快速增殖、早期复发与转移及预后不良等特征[3-4]。常规化学疗法和放射疗法是TNBC患者早期和晚期的标准治疗方法,由于缺乏雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)[3],常规治疗效果欠佳,且用于TNBC的化疗药物对癌细胞的选择性相对较低,TNBC患者在反复使用药物后会产生耐药性[5]。因此,了解化疗耐药的潜在机制和潜在分子靶标可能有助于 TNBC 的治疗。
低氧诱导因子-1α(hypoxia inducible factor 1 alpha,HIF-1α)是细胞在缺氧状态下表达并可作出调控反应的核转录因子。研究表明,HIF-1α参与调节细胞内 pH、自噬、凋亡、血管生成及自身免疫等过程,并可在转录水平调控多个靶基因的表达从而影响肿瘤细胞的化疗耐药性[6-8]。本研究通过在三阴性乳腺癌MDA-MB-231细胞中过表达HIF-1α观察对顺铂敏感性的影响,并探讨其对体内外增殖的作用及相关机制,为三阴性乳腺癌的治疗提供新的实验依据,报道如下。
1 材料与方法
1.1 材料 (1)动物及细胞:健康、SPF级BALB/c雌性裸鼠20只,4~6周龄,体质量(20±2)g,购自海南医学院实验动物中心,生产批号:SYXK(琼)2019-0008,动物饲养环境: 温度( 22±2) ℃,湿度 60%,12 h 明/暗循环,自由饮食与饮水;三阴性乳腺癌细胞株 MDA-MB-231购于美国典型培养物保藏中心(ATCC);pEGFP-HIF-1α质粒由上海生工生物有限公司设计构建。(2)试药试剂:青霉素、链霉素、胎牛血清、DMEM培养基(美国 Hyclone 公司),CCK-8试剂盒(美国 Amresco公司),Annexin V-FITC/PI细胞凋亡检测试剂盒、化学发光液ECL(南京碧云天生物公司),HE染色试剂(武汉博士德生物工程有限公司),Trizol 试剂盒、SYBR Green qPCR Mix试剂盒(日本Takara 公司),Lipofectamine 2000试剂盒(美国Thermo Fisher公司),RIPA裂解液(北京索莱宝公司),兔抗Ki-67、兔抗VEGF、辣根过氧化物酶标记山羊抗兔IgG抗体(北京中杉金桥生物科技有限公司)。(3)仪器设备:细胞培养箱(美国Thermo Revco公司);凝胶成像系统(美国 UVP 公司);MK3 酶标仪(美国热电公司);FACS-Canto 型流式细胞仪(美国 BD 公司);Olympus BX-50 光学显微镜(日本奥林巴斯公司)。
1.2 实验方法 2020年1—12月于海南省肿瘤医院进行实验。
1.2.1 细胞培养与转染: 在三阴性乳腺癌细胞株 MDA-MB-231中添加含10% 胎牛血清、青霉素(100 U/ml)、链霉素(100 μg/ml)的DMEM 培养基中,置于37℃、5%CO2的细胞培养箱中孵育,待细胞贴壁生长,每2~3 d传代1 次。当汇合度达到80%~90%时,使用Lipofectamine 2000试剂进行转染。将MDA-MB-231细胞浓度调整为2×105个/ml,接种于6孔板中,将细胞随机分为3组:空白对照组、pEGFP-C1组和pEGFP-HIF-1α组,按照Lipofectamine 2000 说明书操作,空白对照组细胞不进行转染处理,pEGFP-HIF-1α组和pEGFP-C1组分别转染pEGFP-HIF-1α质粒及其pEGFP-C1空载体质粒,3组均置于37℃、5%CO2的细胞培养箱中培养48 h后收获细胞。
1.2.2 乳腺癌裸鼠模型构建:将 4~6 周龄雌性 BALB/c裸鼠20只随机数字表法法分为C1组和HIF-1α组,每组10只。收集转染后的MDA-MB-231细胞,洗涤后用无血清DMEM悬浮细胞100 μl,HIF-1α组裸鼠注射转染pEGFP-HIF-1α的MDA-MB-231细胞,C1组裸鼠注射转染pEGFP-C1的MDA-MB-231细胞。在无菌条件下,取细胞悬液0.2 ml注射入裸鼠左侧乳垫处。1 周后观察裸鼠成瘤状况,并定期监测肿瘤生长体积,于4周后处死裸鼠,取肿瘤组织用甲醛液固定备用。
1.3 观察指标与方法
1.3.1 qRT-PCR检测MDA-MB-231细胞中 HIF-1α、血管内皮生长因子(VEGF) mRNA表达: TRIzol法提取转染后细胞总RNA,Nanodrop测定提取的RNA纯度和浓度。按照cDNA合成试剂盒进行逆转录获得cDNA,以合成的cDNA为模板进行qRT-PCR 检测基因mRNA表达,具体操作参考SYBR Green qPCR Master Mix试剂盒说明书,以β-actin为内参基因,由上海生工生物有限公司合成引物,HIF-1α上游引物: 5’-GTTACAGTATTCCAGCAGA-3’,下游引物: 5’-GTATGTGGGTAGGAGATG-3’;VEGF上游引物: 5’-CGAGCTTCAGGACAATGCTGGTG -3’,下游引物: 5’-GCAGGAAGGTCAACCACTCAC-3’;β-actin上游引物: 5’-CCCTGGCACCCAGCACGCTTC-3’,下游引物: 5’- GCCGATCCACACGGAGTAC-3’。扩增程序为:95 ℃预变性 5 min(1个循环);95 ℃变性30 s, 55 ℃退火15 s, 72 ℃延伸30 s(40个循环)。采用2-ΔΔCt法计算各基因mRNA的相对表达水平,
1.3.2 Western-blot检测MDA-MB-231细胞中 HIF-1α、VEGF蛋白表达:在转染后细胞中加入RIPA裂解缓冲液提取细胞总蛋白,Bradford试剂盒检测上清液蛋白质浓度。取50 μg蛋白样品通过10% SDS-PAGE分离并转移到聚偏二氟乙烯膜(PVDF)上,在5%脱脂奶粉中封闭2 h,滴加特异性一抗HIF-1α(1∶200)、VEGF(1∶200)、GAPDH(1∶1 000)在4 ℃ 下孵育过夜。次日,将印迹用TBST清洗,然后滴加辣根过氧化物酶标记山羊抗兔IgG(1∶2 000)二抗,室温孵育1 h,TBST洗膜后,通过滴加增强的ECL化学发光液显色曝光,凝胶成像系统拍照,通过Image-Pro Plus软件对各蛋白条带进行分析。
1.3.3 CCK-8法检测 MDA-MB-231细胞药物敏感性:将转染后的MDA-MB-231细胞以5×104个/ml密度接种于96孔板上,每孔加入100 μl,置于37 ℃、5%CO2的细胞培养箱中培养72 h,分别加入终浓度为 2、4、8、16、32 μg/ml 顺铂培养液,培养24 h 后每孔加入 10 μl CCK-8,孵育 2 h 后,采用酶标仪测定450 nm 处的吸光度值(OD),计算药物半抑制浓度(IC50)。将转染后的MDA-MB-231细胞以5×104个/ml密度接种于96孔板上,每孔加入100 μl,培养24 h后加入含7 μg/ml 顺铂的培养液培养,分别于0、24、48、72、96 h每孔加入 CCK-8试剂10 μl,细胞培养箱内孵育 1 h 后,采用酶标仪测定 450 nm处的OD值,计算细胞生长抑制率。
1.3.4 Annexin V-FITC/PI双染法检测MDA-MB-231细胞凋亡:收集转染后的MDA-MB-231 细胞进行消化离心,并制成细胞悬液,使用Annexin V-FITC/PI细胞凋亡检测试剂盒检测凋亡细胞,加入1×binding buffer重悬细胞500 μl,在细胞悬浮液加入Annexin V-FITC 5 μl,接着加入10 μl的 PI,混匀后室温避光孵育15 min,采用流式细胞仪检测各组细胞的凋亡情况。
1.3.5 HE 染色观察裸鼠肿瘤组织:将甲醛固定好的肿瘤组织进行常规脱水,石蜡包埋,切片4 μm厚度;而后进行HE染色,苏木精染色5 min,流水冲洗后,伊红染色液染色3 min,用梯度乙醇脱水,二甲苯进行透明处理,使用中性树胶封片,在光学显微镜下观察肿瘤组织切片并采集图片。
1.3.6 免疫组织化学方法检测 Ki-67和VEGF表达:将制备的裸鼠肿瘤组织石蜡切片用二甲苯脱蜡,梯度乙醇脱水,采用0.3%过氧化氢(H2O2)处理 30 min,滴加柠檬酸钠溶液修复抗原。然后加入山羊血清室温孵育1 h,将切片与Ki-67(1∶100)、VEGF(1∶100)抗体在4 ℃孵育过夜,次日PBS 液冲洗后,加二抗室温孵育1 h。滴加 DAB 显色,自来水洗涤,加苏木素复染,二甲苯透明,中性树胶封片,在光学显微镜下观察图像并拍照。
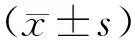
2 结 果
2.1 3组细胞HIF-1α mRNA和蛋白表达比较 与空白对照组比较,pEGFP-HIF-1α组细胞中 HIF-1α mRNA和蛋白相对表达量显著升高,差异有统计学意义(t/P= 36.027/0.000,25.432/0.000);pEGFP-C1组细胞中 HIF-1α mRNA和蛋白相对表达量与空白对照组比较差异无统计学意义(t/P= 0.759/0.106、0.802/0.101)。说明转染成功,见图 1。

注:A.空白对照组;B.pEGFP-C1组;C.pEGFP-HIF-1α组。与空白对照组比较,aP<0.05
2.2 3组细胞中VEGF mRNA和蛋白表达比较 与空白对照组比较,pEGFP-HIF-1α组细胞中 VEGF mRNA和蛋白相对表达量均显著升高(t/P=24.551/0.000,19.876/000);pEGFP-C1组细胞中VEGF mRNA和蛋白相对表达量与空白对照组比较差异均无统计学意义(t/P=0.988/0.071,0.875/0.103),见图 2。
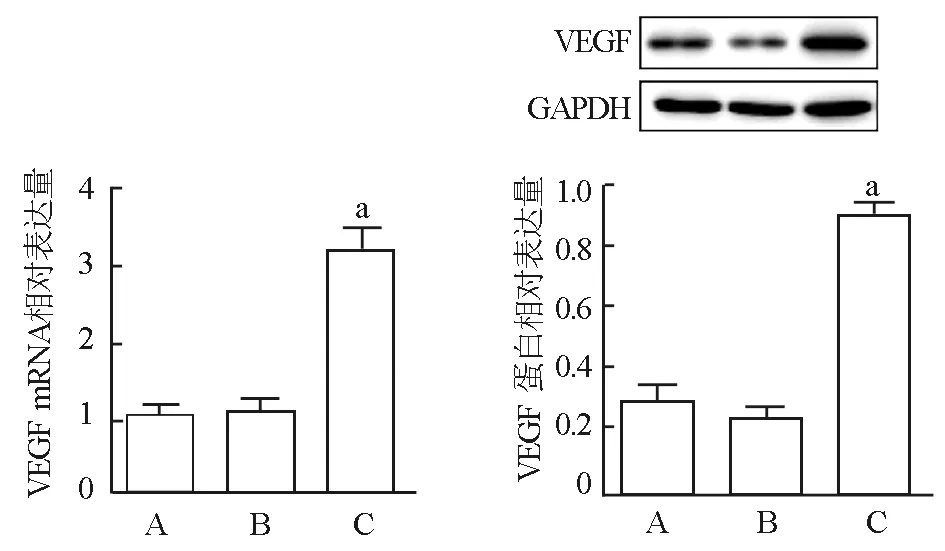
注:A.空白对照组;B.pEGFP-C1组;C.pEGFP-HIF-1α组。与空白对照组比较,aP<0.05
2.3 3组细胞的顺铂 IC50和细胞生长抑制率比较 与空白对照组比较,pEGFP-C1组 MDA-MB-231细胞生长抑制率的顺铂IC50差异无统计学意义(P>0.05),而pEGFP-HIF-1α组的IC50显著升高(P<0.05)。顺铂对MDA-MB-231细胞的生长抑制率随时间逐渐增加,在培养0、24、48 h内顺铂对各组细胞的生长抑制率差异无统计学意义(P>0.05) ;在培养72、96 h pEGFP-HIF-1α组细胞生长抑制率显著低于空白对照组(P<0.05),而pEGFP-C1组细胞生长抑制率与空白对照组比较差异仍无统计学意义(P>0.05),见表1。
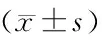
表1 3组MDA-MB-231细胞顺铂 IC50值与细胞生长抑制率比较
2.4 3组细胞凋亡率比较 与空白对照组比较,pEGFP-HIF-1α组细胞凋亡率显著降低(t/P=56.437/0.000),而pEGFP-C1组与空白对照组比较差异无统计学意义(t/P=1.560/0.052),见图3。

注:A.空白对照组;B.pEGFP-C1组;C.pEGFP-HIF-1α组。与空白对照组比较,aP<0.05
2.5 2组裸鼠肿瘤组织生长比较 在2组裸鼠皮下接种MDA-MB-231细胞1周后,裸鼠皮下均形成种植瘤,成瘤率为100%;转染pEGFP-HIF-1α的MDA-MB-231细胞接种裸鼠 1 周后,种植瘤块生长较为迅速,在1、2、3、4周时,其肿瘤组织体积显著大于转染pEGFP-C1的裸鼠(t/P= 79.987/0.000、120.547/0.000、89.152/0.000、80.984/0.000),见图 4。

注:与C1组比较,aP<0.05
2.6 2组裸鼠肿瘤组织病理学变化比较 HE染色结果显示,2组裸鼠所有种植瘤均为癌,且HIF-1α组裸鼠肿瘤组织中肿瘤细胞比C1组裸鼠排列更加密集,见图5。

图5 2组裸鼠肿瘤组织细胞密集比较(HE染色,×100)
2.7 2组裸鼠肿瘤组织Ki-67与VEGF表达比较 免疫组化染色结果显示,pEGFP-C1组肿瘤中 Ki-67阳性表达率为(13.56±1.34)%,低于pEGFP-HIF-1α组的(67.23±6.77)%(t/P=83.436/0.000);VEGF阳性表达率pEGFP-C1组为(10.22±0.97)%,低于pEGFP-HIF-1α组的(45.87±4.36)%(t/P=67.817/0.000),见图6。

图6 2组裸鼠肿瘤组织中Ki-67与VEGF表达比较(免疫组化染色,×100)
3 讨 论
乳腺癌是全世界女性癌症相关死亡的第二大病因,TNBC在年龄超过40岁的女性中更为常见,与其他类型的乳腺癌相比,其复发性和转移率相对较高[4]。
由于缺乏特异性分子靶点和有效的临床治疗手段,以及化疗药物耐药性的产生,基于以上综合治疗方法尚未有效提高TNBC患者的整体生存率,这使得TNBC治疗存在巨大挑战。低氧水平是许多类型癌症的常见特征,尤其是诸如TNBC等增生性癌症[9]。在低氧条件下,肿瘤细胞激活几种途径以促进肿瘤进展并使癌细胞出现化疗耐药性。大量研究证实,HIF-1α水平升高与患者预后差和耐药性增加之间存在很强的相关性,HIF-1α通过募集Treg细胞和抑制肿瘤浸润性T细胞来促进免疫抑制性微环境,此外,HIF-1α还通过募集肿瘤相关巨噬细胞(TAM)和髓样抑制细胞(MDSC)促进肿瘤生长[10-11]。这表明HIF-1α可作为一些肿瘤治疗新的分子靶点。
本研究成功建立了过表达HIF-1α的MDA-MB-231细胞,过表达 HIF-1α的细胞中顺铂 IC50值明显升高,而且细胞凋亡率降低,在顺铂处理下培养72 h和96 h后,过表达 HIF-1α的MDA-MB-231细胞生长抑制率明显下降。说明过表达HIF-1α后减弱了三阴性乳腺癌MDA-MB-231细胞对顺铂的敏感度。
VEGF是人类癌症中的主要血管生成因子,血管生成在肿瘤的生长、进展和转移中起着复杂的作用[12-14]。多项研究表明,恶性肿瘤患者血清VEGF水平明显高于良性肿瘤患者,且VEGF水平较高的患者生存时间相对较短[15-17]。也有研究表明,在缺氧条件下和炎性反应过程中,VEGF表达增加[18]。在乳腺癌相关研究中,抑制VEGF信号通路可抑制乳腺癌细胞的增殖,并诱导细胞凋亡,从而调控癌细胞的生长、存活、抗药性等[19-21]。本研究结果表明,在MDA-MB-231细胞中HIF-1α可促进VEGF的表达,注射转染pEGFP-HIF-1α质粒MDA-MB-231细胞的裸鼠肿瘤组织的生长速度较快,且肿瘤组织中VEGF表达增加,由此说明HIF-1α可能激活VEGF信号通路从而促进体内外肿瘤的增殖生长。目前,靶向VEGF的抗血管生成疗法已成为多种肿瘤的重要治疗策略之一。
综上, HIF-1α过表达会减弱体外培养MDA-MB-231细胞的顺铂敏感性,抑制细胞凋亡,在体内过表达HIF-1α可促进三阴性乳腺癌肿瘤形成与生长。
(致谢:感谢海南医学院基础医学与生命科学学院许佳老师在实验中提供的帮助)
利益冲突:所有作者声明无利益冲突
作者贡献声明
王亮:设计研究方案,论文撰写;黄琰菁:实施研究过程,分析实验数据;娄娜娜:实施研究过程,进行统计学分析;吴焕良:提出研究思路,论文审核
