沉默MMP-9对喉癌细胞侵袭、迁移及PI3K/Akt磷酸化水平的影响
2021-10-21左文娜朱虹金爱燕王强王洪琴
左文娜,朱虹,金爱燕,王强,王洪琴
喉癌是喉黏膜上皮组织的恶性肿瘤,是头部常见的恶性肿瘤之一。临床主要表现为声音嘶哑,咽喉异物感,咽下疼痛,痰中带血,伴有刺激性咳嗽,病情严重会导致呼吸困难等[1]。该病多发于老年男性,中国喉癌的发病率约为5.83/10万,占全身肿瘤的2%左右[2]。随着环境污染的加重,喉癌的发病率逐渐升高。该病的发病机制尚不明确,一般与吸烟、口腔卫生欠佳、接触有害粉尘、内分泌失调、病毒和维生素D代谢失常关系密切[3]。喉癌的发生不限于侵袭、迁移、转移和血管生成,而且还与细胞外环境密切相关[4]。基质金属蛋白酶-9(MMP-9)在细胞外基质膜蛋白裂解和重构中发挥着非常重要的作用,与癌症的病理学特性广泛相关[5]。相关研究表明,MMP-9在肿瘤的转移、侵袭和血管生成中起着重要的作用,并且介导肿瘤的微环境变化,在大多数情况下促进肿瘤的发展[6]。另外,MMP-9还与心血管疾病和免疫疾病相关。磷脂酰肌醇3激酶/丝氨酸苏氨酸蛋白激酶(PI3K/Akt)信号通路调控肿瘤细胞的多种功能,如细胞生长、增殖、迁移和凋亡等[7]。目前关于沉默MMP-9调控PI3K/Akt磷酸化水平的机制尚不清楚,现观察沉默MMP-9对喉癌细胞侵袭、迁移及PI3K/Akt磷酸化水平的影响,为临床喉癌治疗提供一定的参考,报道如下。
1 材料与方法
1.1 材料与试剂 (1)实验对象:收集2018年3月—2019年3月河北省沧州市中心医院耳鼻喉科诊治喉癌患者20例的术后癌组织和癌旁组织(于-80℃冰箱中保存)。人鼻咽永生化上皮细胞:NP69、HEp2、TU212 、TU686、TU177细胞(南京凯基生物科技发展有限公司)。(2)试剂:甲醛、含FBS的培养基、Lipofectamine 3000转染试剂(南通碧云天生物技术研究所);四甲基偶氮唑盐(北京中杉金桥生物技术有限公司);Trizol裂解液、蛋白裂解液(南京建成生物工程研究所);qRT-PCR试剂盒(武汉博士德生物工程有限公司)。(3)仪器设备:酶标仪(德国biosys bioreader)、流式细胞仪(美国BD公司,FACS Calibur流式细胞仪)、Transwell小室(北京达科为生物技术有限公司 ,3422)、图像分析系统(Media Cybernetics公司,Image-Pro Plus 7.0)、显微镜(日本Olympus公司,CX23)。
1.2 实验方法 取NP69、HEp2、TU212、TU686、TU177细胞分别维持在DMEM与10%FBS的培养基中,于37 ℃、5% CO2中培养,2 d更换液体1次,待细胞处于对数生长期时,采用适量胰酶消化,吸出培养液,进行传代培养,待后期实验备用。待HEp2细胞生长密度达到80%以上,取之进行转染,转染siRNA Control 40 nmol/L为siRNA Control组,转染pGV 102-MMP-9-siRNA 40 nmol/L为MMP-9 siRNA组,按Lipofectamine 3000转染试剂说明书进行转染,只进行换液处理,没有转染的HEp2细胞记为Control组。
1.3 观测指标与方法
1.3.1 实时荧光定量PCR(qRT-PCR)检测MMP-9 mRNA表达:将喉癌组织和癌旁组织放入液氮中研磨,在喉癌组织、癌旁组织呈粉状时加入Trizol裂解液1 ml,提取组织中的RNA,并检测纯度和浓度,逆转录成cDNA,采用qRT-PCR试剂盒检测MMP-9 mRNA水平。为了验证MMP-9 mRNA在NP69、HEp2、TU212、TU686、TU177细胞的表达,也分别加入Trizol裂解液1 ml,提取细胞中的RNA,检测纯度和浓度,逆转录成cDNA,MMP-9 mRNA引物:上游5'-ACTTCATCACCATTCCAT-3',下游5'-GCTTCTTATCAACACT-3';GAPDH内参,上游5'-CAATTCTCCATTCTCATT-3',下游5'-CATATCCTATAATCCA-3',反应条件为92℃、30 min, 80℃退火10 s,70 ℃延伸15 s,45个循环,采用2-ΔΔCT计算相对含量。
1.3.2 四甲基偶氮唑盐(MTT)法检测HEp2细胞增殖: 将Control组、siRNA Control组和MMP-9 siRNA组转染后的HEp2细胞以1.0×104个/孔接种到24孔板中,细胞培养过夜,在24 h、48 h、72 h、96 h,采用 MTT法测定细胞增殖情况,酶标仪在490 nm下完成吸光度值(OD)测定。
1.3.3 流式细胞术实验检测HEp2细胞凋亡:取各组转染后的HEp2细胞,以每孔1×106个/孔接种于24孔板中,将荧光标记的 Annexin V加到细胞悬液中,常温孵育20 min,采用PI染色,应用流式细胞仪进行检测,实验重复3次。
1.3.4 Transwell实验检测HEp2细胞侵袭:将各组转染后的HEp2细胞,以2 ×104个/孔接种无血清培养基的Transwell小室中进行细胞侵袭实验,再将含10% FBS 的培养基放入Transwell小室中,孵育48 h后,使用甲醛固定,采用0.1%结晶紫染色30 min,拍照,采用Image-Pro Plus图像分析系统计数细胞侵袭的数量。
1.3.5 伤口愈合实验检测HEp2细胞迁移:将各组转染后的HEp2细胞以1 ×105个/孔放入6孔板中,室温孵育12 h,观察细胞生长情况,当细胞的融合度达到80%时,采用200 μl移液枪头刮细胞表面,使其形成伤口,显微镜拍照,使用Image J图像处理软件计算迁移面积,伤口愈合率=[(0 h面积-48 h面积) /0 h 面积]×100%。
1.3.6 蛋白质印迹(Western-blot)法分析检测PI3K/Akt磷酸化水平:取各组转染后的HEp2细胞,加入蛋白裂解液,并收集裂解后的液体离心处理,取上清液,采用BCA法定量,提取总蛋白,进行 SDS-PAGE电泳、转膜,再加入5%胎牛血清蛋白封闭60 min,加入相应的一抗,4 ℃孵育12 h,洗膜后加入二抗,室温孵育60 min后,TBST洗膜,采用化学发光法检测p-PI3K、p-Akt、PI3K和Akt蛋白水平,拍照后应用Gel-Pro analyzer软件分析灰度值。
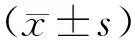
2 结 果
2.1 MMP-9在喉癌组织、癌旁组织和人鼻咽永生化上皮细胞中的表达比较 qRT-PCR 检测结果显示,喉癌组织中MMP-9 mRNA表达明显高于癌旁组织(1.56±0.41 vs. 0.24±0.07,t/P=11.237/0.001);鼻咽永生化上皮细胞NP69与HEp2、TU212、TU686、TU717细胞中MMP-9 mRNA表达水平分别为0.32±0.05、1.83±0.46、1.36±0.27、1.33±0.25、1.51±0.32,与鼻咽永生化上皮细胞NP69比较,HEp2、TU212、TU686、TU177细胞中MMP-9 mRNA表达明显升高(t/P=8.673/0.009、6.431/0.017、6.159/0.022、6.873/0.011),且HEp2细胞中MMP-9 mRNA表达最高,故后续采用HEp2细胞进行实验。
2.2 沉默MMP-9对喉癌细胞增殖和凋亡作用的影响 MTT法检测结果显示,Control组24 h、48 h、72 h和96 h的HEp2细胞增殖能力分别为0.26±0.05、0.48±0.07、0.83±0.09、1.26±0.13,siRNA Control组24 h、48 h、72 h和96 h的HEp2细胞增殖能力分别为0.24±0.06、0.46±0.06、0.82±0.07、1.19±0.11,MMP-9 siRNA Control组24 h、48 h、72 h和96 h的HEp2细胞增殖能力分别为0.24±0.07、0.44±0.08、0.51±0.06、0.69±0.07。与Control组比较,siRNA Control组各时点HEp2细胞增殖能力差异无统计学意义(t/P=0.795/0.274、0.831/0.213、 0.949/0.195、0.982/0.154);与siRNA Control组比较,MMP-9 siRNA组24 h、48 h细胞增殖能力差异无统计学意义(t/P=1.036 /0.116、1.227/0.109),而72 h和96 h细胞增殖能力显著降低(t/P=5.382/0.005、5.146/0.007)。流式细胞术实验检测结果显示,与Control组比较,siRNA Control组HEp2细胞凋亡能力差异无统计学意义(t/P=1.156/0.785); MMP-9 siRNA组HEp2细胞凋亡能力明显高于Control组和siRNA Control组(t/P=8.643/0.001、8.237/0.001),见图1。
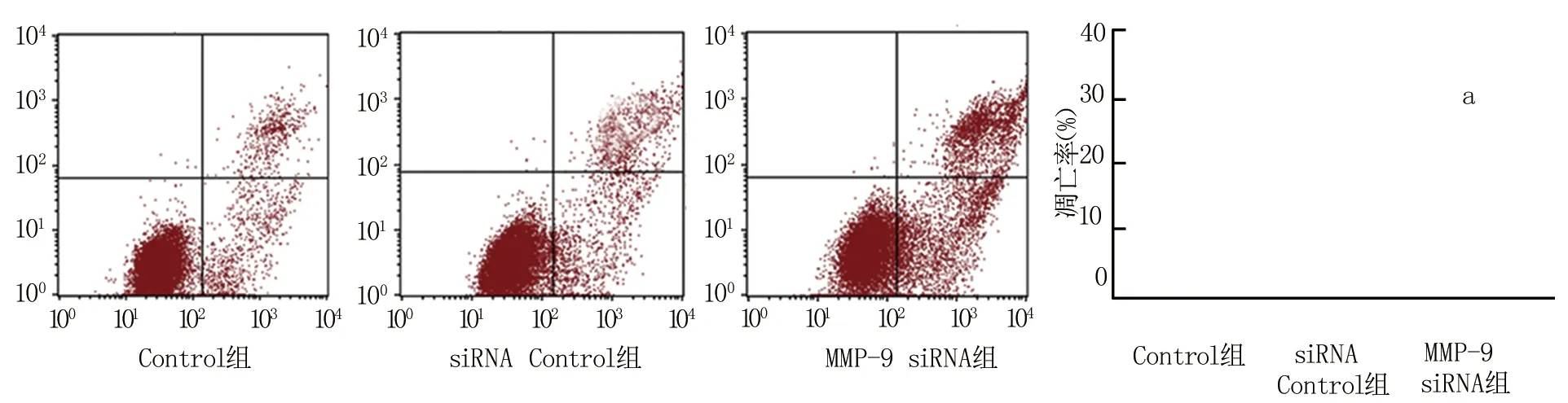
注:与Control组比较,aP<0.01
2.3 沉默MMP-9对喉癌细胞侵袭作用的影响 Transwell实验检测结果显示,与Control组比较,siRNA Control组HEp2细胞侵袭能力差异无统计学意义(t/P=1.379/0.483); MMP-9 siRNA组HEp2细胞侵袭能力显著低于Control组和siRNA Control组(t/P=7.673/0.001、6.792/0.002),见图2。
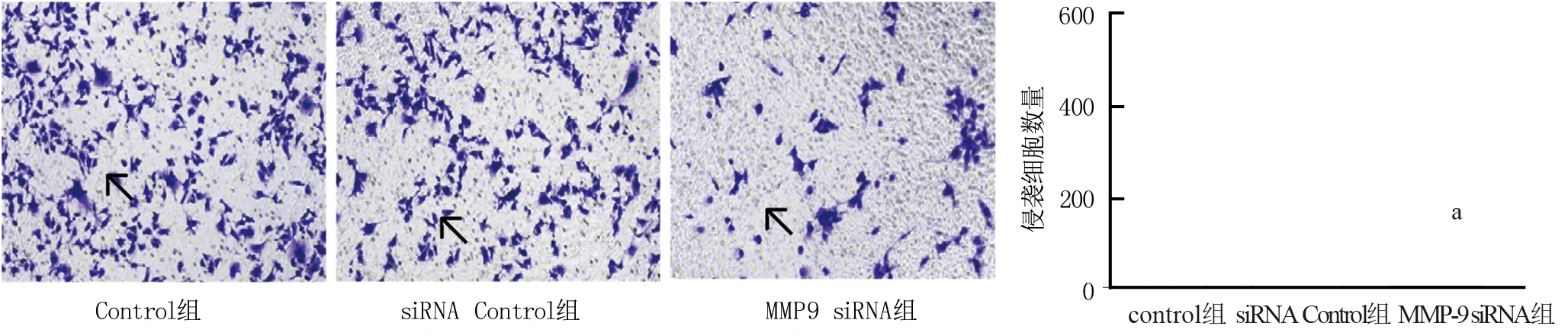
注:与Control组比较,aP<0.01
2.4 沉默MMP-9对喉癌细胞迁移作用的影响 伤口愈合实验检测结果显示,与Control组比较,siRNA Control组HEp2细胞愈合率差异无统计学意义(t/P=1.756/0.336); MMP-9 siRNA组HEp2细胞愈合度显著低于Control组和siRNA Control组(t/P=6.882/0.003、6.513/0.005),见图3。
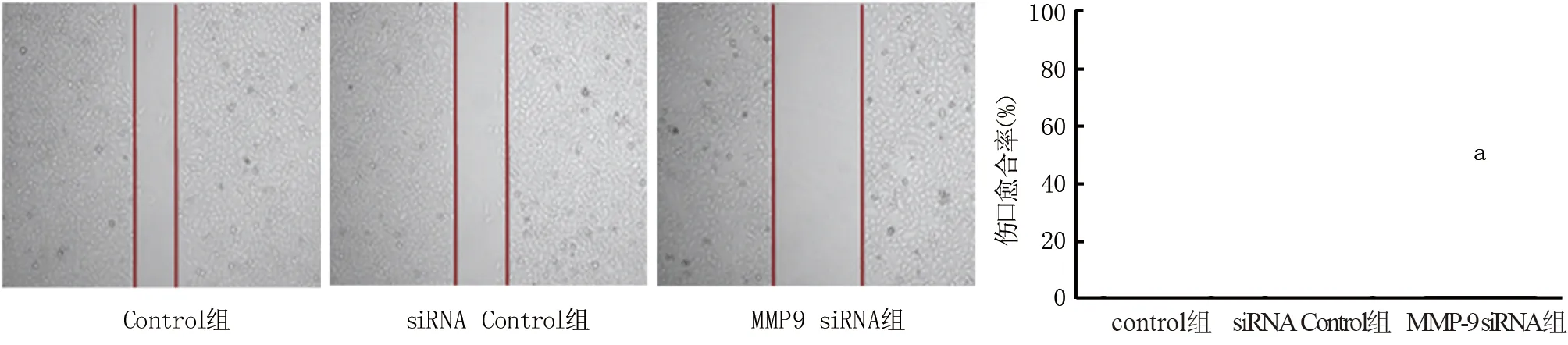
注:与Control组比较,aP<0.01
2.5 沉默MMP-9对PI3K/Akt蛋白磷酸化水平的影响 Western-blot分析检测结果显示, Control组、siRNA Control组和MMP-9 siRNA组中PI3K、Akt蛋白水平比较差异无统计学意义(P>0.05);Control组、siRNA Control组中p-PI3K和p-Akt蛋白水平比较差异亦无统计学意义(P>0.05);MMP-9 siRNA组中p-PI3K和p-Akt蛋白水平显著低于Control组和siRNA Control组(t/P=9.459/0.001、8.736/0.001、6.873/0.001、6.694/0.001),见图4。
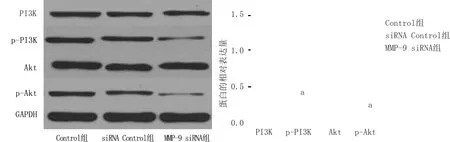
注:与Control组比较,aP<0.01
3 讨 论
喉癌是常见的头颈部恶性肿瘤之一,以喉鳞癌为主要类型,近年来,喉癌的发病率逐渐增高。全切除术是一种传统的喉癌治疗方法,可显著减少该病的复发情况,但可能引起喉部功能丧失[8]。放化疗已经广泛应用于喉癌的治疗,尽管可以延长患者的生存时间,但总体的治疗效果并不理想,预后不良,生存率低,后遗症和并发症较多,严重影响了患者的生命及生活质量[9]。所以亟需深入了解喉癌的发生和发展机制,寻找新的治疗策略提高喉癌的诊治和预后水平。
肿瘤细胞穿透基底膜的过程中,基质金属蛋白酶(MMPs)发挥着重要的作用,它能够降解细胞外基质从而形成肿瘤侵袭与转移的通道[10]。MMP-9与肿瘤的关系尤其密切,MMP-9基因位于染色体20q13.12,MMP-9蛋白含有催化结构域、血凝素样结构域、铰链结构域、信号肽和前肽结构[11-12]。MMP-9具有蛋白水解裂解活性,在细胞外环境中参与许多生物学过程,促进癌症的发生和发展[13]。MMP-9在肿瘤侵袭和转移过程中也起到重要的作用,相关研究表明,miR-188-5p通过MMP-9表达而抑制瘢痕疙瘩的增殖和侵袭[14]。本研究通过qRT-PCR 检测MMP-9在喉癌组织和喉癌细胞中的表达,发现喉癌组织中MMP-9 mRNA表达明显高于癌旁组织,与鼻咽永生化上皮细胞NP69比较,HEp2、TU212、TU686、TU177细胞中MMP-9 mRNA表达明显升高,证明了MMP-9在喉癌组织和喉癌细胞中高表达,具有促进肿瘤发展的作用。
本结果表明,沉默MMP-9的HEp2细胞增殖、侵袭能力明显降低,细胞愈合度也明显减少,从而说明抑制MMP-9能够抑制HEp2细胞增殖、侵袭和迁移,促进细胞凋亡。相关研究表明,沉默MMP-9能够抑制乳腺癌肿瘤细胞的生长、迁移及侵袭[15],与本结论相类似。MMP-9能够降解血管基底膜的主要成分Ⅳ型胶原,从而参与肿瘤细胞的侵袭和迁移,同时能够促进血管内皮生长因子来调节肿瘤血管的发生,因此沉默MMP-9可抑制肿瘤细胞的侵袭和迁移,从而抑制肿瘤血管的发生。
PI3K是具有催化活性的信号蛋白,与下游的AkT结合发生磷酸化,构成PI3K/Akt信号通路,该通路在细胞迁移过程中发挥着重要的作用[16-17]。相关研究发现,MMPs表达呈PI3K依赖的特点,即激活PI3K会使MMPs的表达水平上调,抑制PI3K会使MMPs的表达水平下调[18]。本结果显示,沉默MMP-9 的表达,p-PI3K和p-Akt蛋白水平明显低于Control组和siRNA Control组。由此推测,沉默MMP-9可通过抑制PI3K/Akt信号通路,阻止细胞外基质的降解,来减缓喉癌的发展。
综上所述,沉默MMP-9对喉癌细胞增殖、凋亡、侵袭和迁移能力的影响,并阐述了与PI3K/Akt蛋白磷酸化水平的关系,为喉癌的诊断和治疗研究提供了一定的理论基础。
利益冲突:所有作者声明无利益冲突
作者贡献声明
左文娜:设计研究方案,实施研究过程,论文撰写;朱虹:进行统计学分析;金爱燕:提出研究思路,分析试验数据,论文审核;王强:实施研究过程,资料搜集整理,论文修改;王洪琴:课题设计,论文撰写
