高脂对骨骼肌细胞miR-27a、生物钟基因及胰岛素敏感性的影响
2021-10-20王赛飞郑路任艳琦乔博吴静张好好
王赛飞,郑路,任艳琦,乔博,吴静,张好好
(1.郑州大学第一附属医院 a.内分泌科;b.小儿内科,河南 郑州 450052;2.长治医学院附属和平医院 内分泌科,山西 长治 046000)
流行病学调查显示,肥胖及2型糖尿病等代谢性疾病已成为威胁全球的公共健康卫生问题[1],胰岛素抵抗(insulin resistance,IR)是这些代谢性疾病重要的病理基础之一。骨骼肌是全身IR和2型糖尿病发展的关键,是胰岛素依赖性葡萄糖摄取的主要部位(75%~90%)[2]。据报道,营养过剩、环境光污染、睡眠时间或质量下降、时差和轮班工作导致的生物钟紊乱与IR有关,甚至直接诱发IR[3]。生物钟广泛分布于机体各组织器官,生物钟分子机制的核心是Bmal1和Clock形成的异二聚体转录因子复合物(Clock/Bmal1)[3-5]。研究表明,Bmal1、Clock蛋白水平的下调与骨骼肌IR有关,Bmal1siRNA或ClocksiRNA可诱导C2C12肌管细胞IR[3]。体内实验表明,高热量饮食可影响啮齿类动物肝脏生物钟基因振荡及功能[5],而能量过剩对骨骼肌生物钟的具体影响及其与胰岛素敏感性的关系,目前研究仍未明确。微小核糖核酸(microRNA,miRNA)是一种短链非编码RNA,通过在转录后与靶基因结合,降解或阻遏靶mRNA的翻译,进而参与调控靶基因表达[6]。miRNA广泛参与调控多种生命活动,其中miR-27a在胰岛素敏感性及细胞分化等多个生理过程中发挥重要作用[7]。既往研究表明miR-27a在肥胖患者血清中高表达[7],大鼠骨骼肌L6细胞miR-27a过表达可导致葡萄糖消耗及摄取能力下降[8]。近期研究提示miRNA参与昼夜节律的转录后调控[9]。miR-27a是参与哺乳动物昼夜节律的候选miRNA[10]。因此,推测高脂诱导的骨骼肌IR可能与昼夜节律紊乱和miR-27a的异常表达有关。然而,高脂对骨骼肌miR-27a表达的影响尚不清楚。因此,本研究旨在观察高脂对骨骼肌核心生物钟基因Clock、Bmal1及miR-27a表达及胰岛素敏感性的影响,为进一步了解营养状况影响骨骼肌胰岛素敏感性的具体机制提供理论依据。
1 材料与方法
1.1 材料C2C12成肌细胞(中国科学院细胞库)、棕榈酸(Sigma)、DMEM(BI)、胎牛血清(BI)、马血清(BI)、葡萄糖测定试剂(Sigma)、小鼠MyoD1多克隆抗体(Abcam)、小鼠Akt多克隆抗体(Cell Signaling)、p-Akt多克隆抗体(Cell Signaling)、油红O染料(索莱宝)、CCK8检测试剂盒(索莱宝)、激光扫描共聚焦显微镜(OLYMPUS)。
1.2 细胞培养及处理小鼠C2C12成肌细胞在体积分数为10%胎牛血清(fetal bovine serum,FBS)DMEM培养液中培养,置于37 ℃、体积分数为5%CO2培养箱中进行孵育,2~3 d传代1次。当细胞融合至90%时,换用体积分数为2%马血清的DMEM分化培养液进行分化诱导,2 d换液1次,分化4~7 d。将处于对数生长期C2C12肌管细胞按每孔104接种于12孔板,随机分为正常对照组(Con)、棕榈酸组(PA组,0.75 mmol·L-1)。棕榈酸干预16 h后收集细胞待测。
1.3 免疫荧光采用体积分数为4%的多聚甲醛固定细胞,以PBS浸洗玻片3次,每次3 min;用体积分数为0.5%的Triton X-100室温通透20 min,清洗3次;在玻片上滴加正常山羊血清,室温封闭30 min;加一抗(1∶200)并放入湿盒,4 ℃孵育过夜;弃一抗,滴加荧光二抗,湿盒中37 ℃孵育1 h,以PBS浸洗切片3次;滴加DAPI避光孵育5 min,对标本进行染核,采用PBST(5 min×4次)洗去多余的DAPI。于激光扫描共聚焦显微镜下观察采集图像。
1.4 CCK8试验严格按照CCK8试剂盒说明进行操作。用体积分数为10%FBS培养液配成单个细胞悬液,以每孔103~104个细胞接种到96孔板,每孔100 μL;培养3~5 d后,加入CCK8溶液10 μL。继续孵育4 h。用酶联免疫检测仪测定在450 nm处的吸光度,记录OD值,以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
1.5 葡萄糖消耗采用葡萄糖氧化酶法测定每孔培养液中的葡萄糖含量。葡萄糖消耗等于不含细胞的培养孔内培养液中的葡萄糖含量减去培养孔培养液中剩余葡萄糖含量。具体操作步骤详见试剂盒。
1.6 实时荧光定量PCR采用Trizol法提取总RNA并定量,反转录为cDNA,引物均由苏州金唯智有限科技公司设计合成,引物名称及序列见表1。将cDNA按实时荧光定量PCR反应体系(20 μL)反应,PCR过程如下。95 ℃预变性3 min。延伸40个循环:95 ℃ 5 s,60 ℃ 20 s。解离:95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s。以GAPDH和U6作为内参基因进行标准化。见表1。结果采用结果2-△△ct法进行计算。
1.7 Western blot取细胞总蛋白,用BCA法测蛋白含量。用体积分数为10%的SDS-PAGE电泳,后将蛋白转移至NC膜上,用含50 g·L-1脱脂牛奶封闭,分别加入兔抗Akt(1∶1 000)、p-Akt(Ser473)(1∶1 000)、GAPDH(1∶1 000),4 ℃孵育过夜。次日,以TBST洗涤3次,加入稀释好的二抗,避光室温下孵育1~2 h。采用Bio-Rad紫外凝胶成像分析系统进行吸光度扫描。采用Image J软件计算灰度值。
2 结果
2.1 骨骼肌C2C12肌管的形态学变化细胞在分化前呈梭形或不规则三角形,细胞间有一定的间隙,排列不规则。分化7 d后,细胞间隙缩小,边界清晰,肌管形态特征明显。免疫荧光结果显示,分化前肌管形成标志蛋白MyoD1未表达,分化后MyoD1表达明显,且形态呈现肌管状,提示小管形成,具有骨骼肌生物学特性,可用于后续实验。见图1。
2.2 高脂对骨骼肌C2C12细胞活力的影响考虑到棕榈酸对细胞的毒性,为排除骨骼肌细胞活力下降对实验结果的影响,行CCK8增殖实验,结果显示,0.75 mmol·L-1PA干预16 h后,两组OD值比较,差异无统计学意义(P>0.05)。见表2。
2.3 高脂对骨骼肌胰岛素敏感性的影响Western blot法结果显示,与对照组相比,PA组p-Akt/Akt水平较低(P<0.001)。见图2A。油红O染色结果显示,PA干预增加了C2C12肌管细胞的脂质含量。见图2B。PA组C2C12细胞葡萄糖消耗量较对照组少(P<0.001)。见表3。
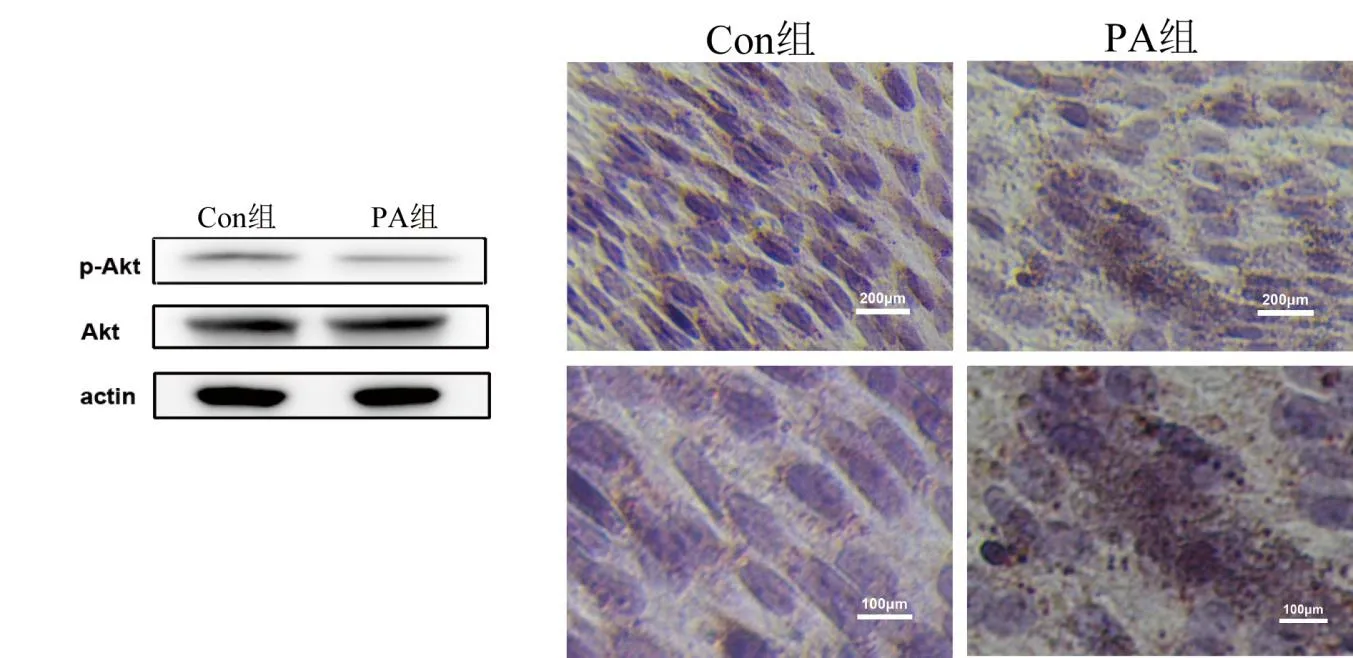
图2 棕榈酸对骨骼肌C2C12细胞胰岛素敏感性的影响
2.4 高脂对骨骼肌miR-27a和生物钟基因的影响采用实时荧光定量PCR检测高脂对骨骼肌核心生物钟基因的影响。PA组生物钟核心基因ClockmRNA及Bmal1mRNA表达水平较对照组低,miR-27a表达水平较对照组高(P<0.05)。见表4。miR-27a与ClockmRNA及Bmal1mRNA呈负相关(r=-0.847、-0.662,P<0.05)。见图3。
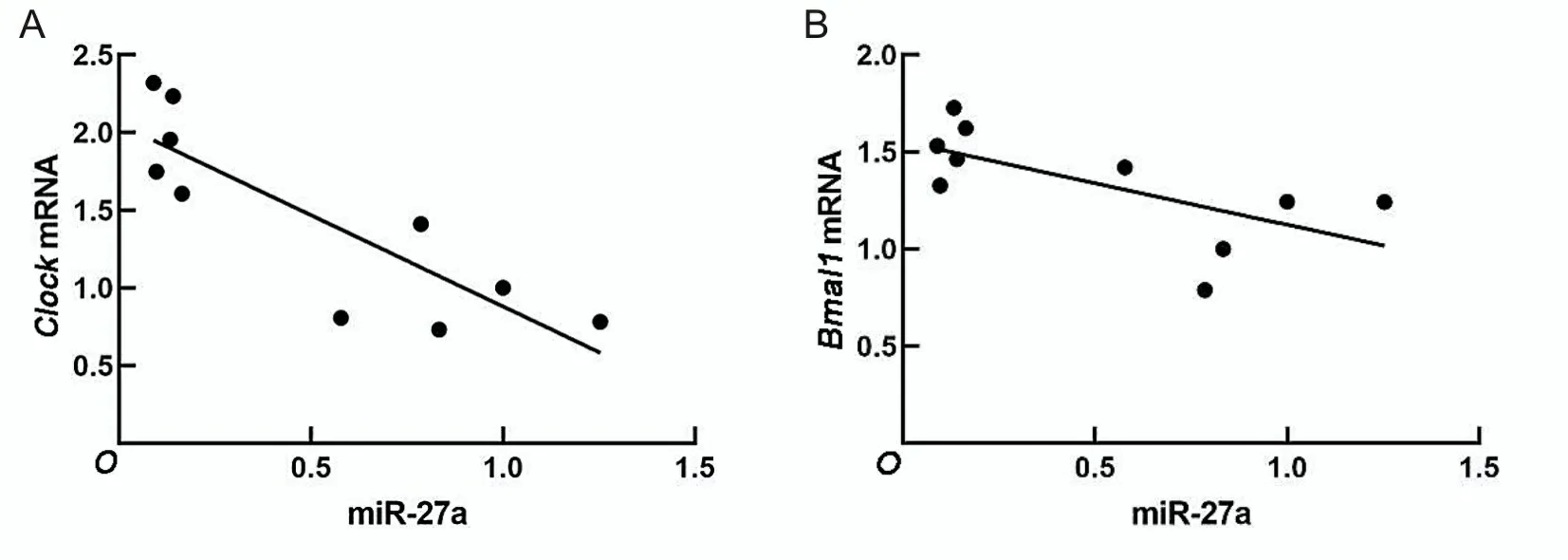
A为miR-27a水平与Clock mRNA表达水平相关性;B为miR-27a水平与Bmal1 mRNA表达水平相关性。
3 讨论
随着我国社会工业化的不断推进,国民对24 h消费服务的需求不断增加。据统计,亚洲至少有30%的工作人员参与轮班工作[11]。研究显示,连续5周24 h持续光照可使小鼠脂肪含量显著增加57%,且光照持续时间与脂肪细胞的数量和大小呈正相关[12],提示昼夜节律紊乱促进肥胖发生。此外,饮食结构改变尤其高脂饮食也是肥胖发生的重要因素。然而,高脂对骨骼肌生物钟的影响尚不清楚。本研究发现,PA干预降低骨骼肌p-Akt表达和葡萄糖消耗,同时增加异位脂质沉积。此外,PA组骨骼肌ClockmRNA及Bmal1mRNA表达水平较对照组低,miR-27a表达水平较对照组高,进一步分析表明miR-27a与ClockmRNA及Bmal1mRNA呈负相关。这提示棕榈酸诱导的骨骼肌IR与生物钟紊乱有关,且可能由miR-27a介导。
骨骼肌是胰岛素刺激状态下葡萄糖摄取的主要部位,骨骼肌IR被认为是代谢综合征发病的早期因素之一[2,13]。C2C12成肌细胞是肌肉重建的前体细胞,需进一步分化为肌管才具有骨骼肌生物活性,是体外研究骨骼肌的理想模型。免疫荧光结果显示,分化后肌管形态明显,MyoD1高表达。进一步细胞活力测定表明,PA处理16 h对细胞活力无明显影响。另一项研究表明,低于0.6 mmol·L-1的PA并不能抑制C2C12肌管的细胞活力,而高于0.8 mmol·L-1的PA具有显著的抑制作用[14]。然而,Meshkani等[15]发现0.75 mmol·L-1PA处理C2C12肌管24 h后,细胞活力降低至对照组的43%,可能为PA对细胞的损伤作用具有剂量依赖性和时间依赖性。此外,PA能下调骨骼肌细胞p-Akt蛋白水平和葡萄糖消耗,提示高脂干预导致骨骼肌IR。
转录-翻译反馈环路是构成生物节律的分子基础,其核心是Clock/Bmal1[3-5]。研究显示Clock/Bmal1可调节小鼠胰岛素敏感性的昼夜变化[3],Clock和Bmal1突变体均表现出糖耐量受损、胰岛素分泌减少[16]。研究表明,高脂肪饮食(60%脂肪)仅3 d即可在不引起肥胖的情况下使小鼠肝脏昼夜节律重新编程[17]。另一项研究提示,高脂和高糖均下调C2C12细胞核心生物钟基因mRNA表达,但高脂下调作用更为显著[18]。这提示Clock和Bmal1与系统胰岛素敏感性密切相关,且脂质变化对昼夜节律功能有重要影响。然而,高脂对骨骼肌昼夜节律的具体影响尚不清楚。本研究数据显示,0.75 mmol·L-1PA下调C2C12细胞ClockmRNA和Bmal1mRNA表达。然而,0.4 mmol·L-1和50 μmol·L-1PA分别处理人原代肌管细胞[19]和AML-12[5]后,Bmal1mRNA表达未见明显变化,可能与饮食中脂肪占比和PA水平有关,脂肪在总摄入量中的占比越高,水平越高,对昼夜节律的不良影响越明显。
为进一步探讨高脂诱导IR与核心生物钟基因的关系,检测miR-27a在C2C12肌管中的表达水平,发现PA组miR-27a表达水平较高。对哺乳动物中保守miRNA的预测分析表明miR-9、miR-24、miR-25、miR-26、miR-27、miR-29、miR-93、miR-211是昼夜节律的候选miRNA,且miR-27在人类白细胞中呈现节律性表达[10],提示miR-27可能参与生物节律的转录后调控。然而,目前尚未有研究证实miR-27a在骨骼肌生物钟紊乱诱导的IR中的作用。miR-27a与Bmal1mRNA和ClockmRNA的相关性分析表明,miR-27a与ClockmRNA和Bmal1mRNA呈负相关,提示PA所致昼夜节律紊乱可能通过miR-27a引起骨骼肌IR。
综上所述,高脂可导致骨骼肌昼夜节律紊乱和IR,该过程可能与miR-27a的异常表达有关,提示miR-27a可能是一个整合昼夜节律和胰岛素敏感性的新节点。然而,本研究仍存在一定的局限性:首先,未建立生物钟紊乱模型来观察miR-27a的表达;其次,未干预miR-27a从而证明高脂通过miR-27a诱导IR,这也是下一步的研究方向。总之,本研究为协调骨骼肌的昼夜节律和能量代谢提供了新方向,为研究与昼夜节律紊乱相关的骨骼肌IR提供了新策略。
