剔除巨噬细胞可通过抑制肌再生因子和Akt/mTOR信号通路损害骨骼肌再生
2018-04-20刘晓光肖卫华陈佩杰赵淋淋曾志刚周永战郑莉芳
刘晓光,肖卫华,陈佩杰,赵淋淋,曾志刚,2,周永战,郑莉芳
剔除巨噬细胞可通过抑制肌再生因子和Akt/mTOR信号通路损害骨骼肌再生
刘晓光1,肖卫华1,陈佩杰1,赵淋淋1,曾志刚1,2,周永战1,郑莉芳1
1. 上海体育学院 运动科学学院, 上海 200438; 2. 井冈山大学 体育学院, 江西 吉安 343009。
目的:探讨骨骼肌挫伤修复过程中巨噬细胞与肌再生因子及Akt/mTOR信号通路间的关系,以深入研究巨噬细胞在骨骼肌挫伤修复中的作用及其机制。方法:80只雄性C57BL/6小鼠随机分为骨骼肌损伤组(S,n=32),损伤+巨噬细胞剔除组(T,n=32),未损伤对照组(SCon,n=8),未损伤+巨噬细胞剔除对照组(TCon,n=8)。骨骼肌挫伤后1d、3d、7d和14d取双侧腓肠肌外层。苏木素-伊红(HE)染色观察骨骼肌形态学变化,荧光定量PCR(RT-PCR)及蛋白质印迹法(WB)检测肌再生相关因子及Akt/mTOR蛋白质合成信号分子表达变化。结果:1)HE结果显示,S组和T组骨骼肌在挫伤后第1 d和3 d肌纤维结构破坏、大量肌纤维坏死、肿胀。S组在损伤第7 d出现大量再生肌纤维,而T组在伤后第7 d仅出现少量再生肌纤维,伤后第14 d仍有大量再生肌纤维出现;2)RT-PCR结果显示,S组骨骼肌成肌分化抗原(MyoD)和肌细胞生成素(myogenin)mRNA在挫伤后表达均显著增加(<0.01)。而与S组相比,T组损伤骨骼肌中MyoD显著下调,myogenin显著上调表达(<0.05);3)S组骨骼肌损伤后,与SCon组相比,除机械生长因子(MGF)外,多种肌再生因子均显著上调表达。与S组相比,T组损伤骨骼肌中多种肌再生因子表达均显著下调。4)S组骨骼肌损伤后低氧诱导因子1α(HIF-1α)和血管生成素1(Angpt1)mRNA表达均显著增加,而血管内皮生长因子(VEGF)mRNA表达下降。与S组相比,T组HIF-1α和Angpt1在损伤后期显著上调表达;5)WB结果显示,骨骼肌损伤后,S组p-Akt/Akt、p-mTOR/mTOR、p-p70S6K/p70S6k和p-4EBP1/4EBP1表达均显著增加,而T组p-Akt/Akt、p-mTOR/mTOR、p-p70S6K/p70S6k和p-4EBP1/4EBP1与TCon及S组相比均无显著变化(>0.05)。结论:巨噬细胞在骨骼肌挫伤修复过程中发挥了重要作用,剔除巨噬细胞可损害挫伤骨骼肌再生,其机制可能与肌再生因子表达下调、蛋白质合成信号通路未激活有关。
骨骼肌;损伤修复;巨噬细胞;肌再生因子;血管再生因子;蛋白质合成信号通路
骨骼肌是具有高度可塑性的组织,损伤后可进行再生,恢复结构和功能[11]。骨骼肌这种强大的自我再生能力主要依赖于肌卫星细胞。肌卫星细胞是一类肌源性前体细胞,存在于肌膜和基底膜之间。骨骼肌未损伤时肌卫星细胞一般处于静息状态,而当骨骼肌损伤后,肌卫星细胞即可被激活,增殖、分化形成新的肌管或与受损肌纤维融合,参与骨骼肌损伤修复[31]。
研究表明,骨骼肌损伤修复过程中,巨噬细胞也发挥了重要作用[4]。M1型巨噬细胞可分泌肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)和白介素-6(IL-6)等炎性介质,吞噬坏死肌肉组织。M2型巨噬细胞可分泌胰岛素样生长因子-1(IGF-1)、肝细胞生长因子(HGF)、抗炎因子白介素-10(IL-10),及促纤维化因子转化生长因子-β(TGF-β),调控骨骼肌再生和纤维化[32]。此外,巨噬细胞还能分泌VEGF,参与血管再生[23],即巨噬细胞在损伤骨骼肌再生中发挥了多重作用,但其作用机制仍远未阐明。
现有研究发现,巨噬细胞在mdx小鼠[34]、毒素致伤[41,37,33]、氯化钡注射致伤[18]等肌损伤动物模型中有重要作用,但在运动医学领域常见损伤——骨骼肌挫伤中,巨噬细胞是否发挥作用及如何发挥作用,却少有研究。我们推测,和其他损伤模型相似,巨噬细胞在挫伤骨骼肌修复过程中也具有重要作用,巨噬细胞剔除可能会影响肌再生因子和蛋白质合成信号分子表达,从而损害挫伤骨骼肌再生。为验证上述假设,本研究建立了骨骼肌挫伤模型及巨噬细胞剔除模型,检测了骨骼肌中多种肌再生因子及蛋白质合成信号分子表达变化,深入探索了巨噬细胞在骨骼肌挫伤修复中的作用及其机制。
1 材料和方法
1.1 实验动物和分组
80 只8 周龄C57BL/6雄性小鼠(上海斯莱克实验动物有限公司)随机分为骨骼肌损伤组(S,n=32)、损伤+巨噬细胞剔除组(T,n=32)、未损伤对照组(SCon,n=8)和未损伤+巨噬细胞剔除对照组(TCon,n=8)。小鼠腓肠肌损伤后第1 d、3 d、7 d和14 d取材,每组每时间点8只。
1.2 骨骼肌挫伤模型
小鼠用400 mg/kg体重水合氯醛腹腔注射麻醉后,使小鼠固定于平台上,且膝关节伸直0°,踝关节背伸90°位。将重16.8 g,直径1.6 cm的钢珠,置于一管状装置顶端,自125 cm高处释放,击中一打击装置,打击装置底端撞击小鼠腓肠肌中部(打击面积28.26 mm2),制作骨骼肌挫伤模型[40,2]。
1.3 巨噬细胞剔除模型
小鼠腓肠肌挫伤前2 d,腹腔注射2 mg脂质体包被氯膦酸盐(购自www.clodronateliposomes.com),然后在损伤前 2 h小鼠腹腔注射0.5 mg脂质体包被氯膦酸盐,之后在损伤后第3、6、9和12 d都注射0.5 mg脂质体包被氯膦酸盐。此法可特异性剔除体内巨噬细胞,而不影响其他细胞,是巨噬细胞剔除的最常用方法[39,30,17]。
1.4 动物取材
在骨骼肌损伤修复相关研究中,通常不对肌纤维类型进行特殊说明,且腓肠肌为研究者最常用部位[14,6],因此本研究也选取腓肠肌进行相关实验。小鼠腓肠肌挫伤后在不同时间点(1 d、3 d、7 d和14 d)取材。小鼠麻醉后颈椎脱位致死,迅速取双侧受损腓肠肌外层,对照组取腓肠肌相同部位,通过HE染色、RT-PCR及WB检测相关指标。
1.5 HE染色
骨骼肌经4%多聚甲醛(国药集团化学试剂有限公司)固定24 h后,石蜡包埋,横切3~4 μm厚的连续薄片,切片脱蜡复水,苏木精染色,1%盐酸-酒精分化,伊红染色,梯度酒精脱水,二甲苯透明,中性树胶封片。光学显微镜(Olympus DX70)下观察并拍摄。
1.6 RNA 抽提和cDNA合成
取约60 mg肌肉组织,剪碎后加入1 ml Trizol(美国Invitrogen公司),用机械匀浆器(IKA T10,德国IKA公司)粉碎匀浆。静置10 min后,加入200 μl氯仿(国药集团化学试剂有限公司)并上下颠倒充分混匀后,静置5 min,会出现明显分层。然后12 000 rpm,4℃离心15 min后小心吸取500 μl上清移入一新离心管中,在此离心管中加入等量异丙醇(国药集团化学试剂有限公司),颠倒混匀并静置 20 min。冷冻离心机(centrifuge5417R,德国Eppendorf公司)中12 000 rpm,4℃离心10 min,白色羽毛状沉淀即为 RNA。该沉淀用75%酒精(国药集团化学试剂有限公司)洗涤2 次后,加入30 μl DEPC水(生工生物工程(上海)股份有限公司)溶解。测OD值,OD260/280为1.8~2.0的样品可用。取2 μg总RNA,按cDNA合成试剂盒说明(K1622, Thermo Scientific 公司)加0.2μg随机引物,20 mM dNTP mix, 5× Reaction buffer,20U RiboLockTMRNase Inhibitor 和200 U of RevertaidTMM-MuLV Reverse Transcriptase总体积是20 µl。在梯度PCR仪(Mastercycler EP,德国 Eppendorf 公司),进行反转录。反应过程中的温度控制是25℃ 5 min,42 ℃ 60 min,70 ℃ 5 min,然后,温度降低到4 ℃,cDNA合成完成。合成的cDNA储存在-20 ℃备用[22, 23]。
1.7 荧光定量PCR
荧光定量PCR反应体系包括12.5 µl 2×Maxima SYBR Green/ROX qPCR Master mix(K0221,Thermo Scientific公司)、1 µl cDNA、无核酸酶水和300 nM的上下游引物。引物由生工生物工程(上海)股份有限公司设计并合成,见表1。 使用荧光定量PCR仪(ABI SteponePlus Real Time PCR System7500,USA)进行扩增。反应条件为:预变性95 ℃ 10 min,95 ℃ 变性15 s,60 ℃1 min退火/延伸,共40个循环。通过2-△△CT方法计算所测样本mRNA的相对含量[24,25]。

表1 荧光定量PCR引物序列
1.8 蛋白质印迹实验
取60~80 mg腓肠肌移入2 ml EP管中,加入含磷酸酶抑制剂的蛋白裂解液(P0013B,上海碧云天生物技术有限公司)后,剪碎组织并充分匀浆;4 ℃离心机12 000 rpm离心5 min,取上清液;二喹啉甲酸(BCA)法测蛋白样本浓度(P009,上海碧云天生物技术有限公司);SDS-PAGE电泳,5%浓缩胶,70 V恒压电泳30 min,10%分离胶,110 V恒压电泳90 min后(Protean tetra电泳槽,美国Biorad公司),用湿转法(Trans-Blot 转印槽,美国 Biorad 公司)转至聚偏氟乙烯(PVDF)膜(美国默克密理博公司)上;PVDF膜于5%脱脂牛奶(光明乳业股份有限公司)中室温封闭1.5 h;分别加入一抗Akt、磷酸化Akt、mTOR、磷酸化mTOR、p70 s6k、磷酸化p70 s6k、4EBP1、磷酸化4 EBP1和GAPDH(所有一抗为兔抗小鼠1:1000,CST公司),4°过夜,TBST洗膜3次,加入HRP标记二抗(1:5 000,Santa Cruz公司)室温孵育1 h,ECL发光法(Tanon 5200自动发光仪,中国天能仪器有限公司)检测蛋白条带,采用Image J分析软件测定条带灰度值。
1.9 统计学分析

2 结果
2.1 巨噬细胞剔除模型的成功建立
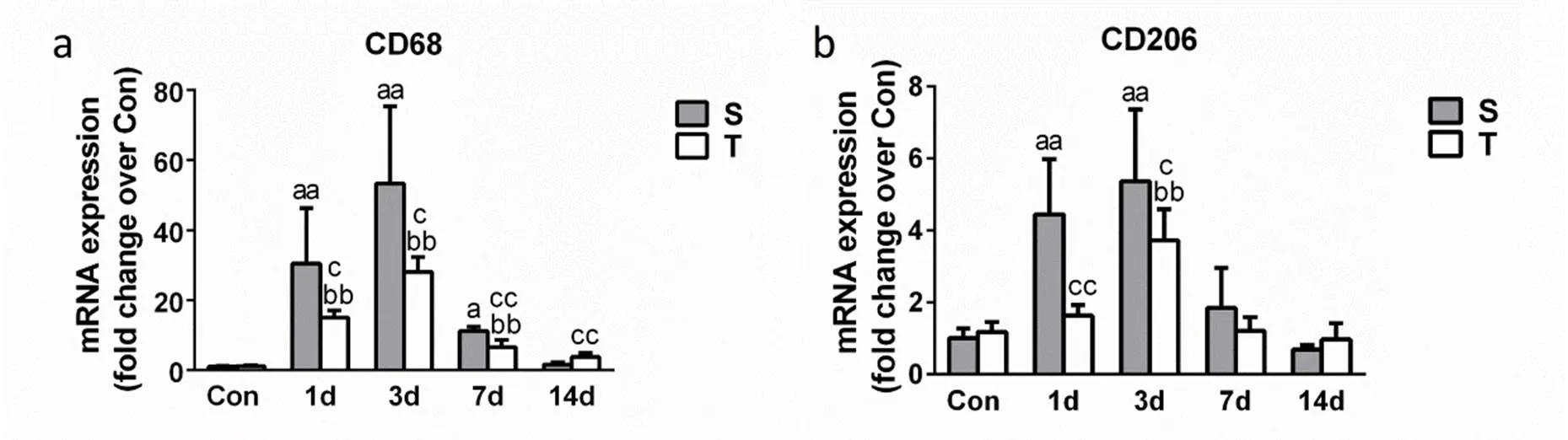
图1 脂质体包被氯膦酸盐对损伤骨骼肌巨噬细胞标志物表达的影响
Figure 1 Effects of CL-liposomes on the Specific Markers of Macrophages of Muscle Post-injury.
注:a:CD68;b:CD206; S:骨骼肌损伤组;T:损伤+巨噬细胞剔除组;SCon:未损伤对照组;TCon:未损伤+巨噬细胞剔除对照组;与SCon组比较,a<0.05;aa<0.01;与TCon组比较,b<0.05;bb<0.01;S组与T组同一时间点比较,c<0.05;cc<0.01;CD68:M1巨噬细胞特异标志物;CD206:M2巨噬细胞特异标志物。
RT-PCR结果显示,S组骨骼肌中CD68(M1巨噬细胞标志物)[38,34,32,10]mRNA在伤后第1 d、3 d和7 d表达量均显著增加(<0.05)。与S组相比,T组CD68 mRNA在伤后1 d、3d和7d表达量均显著降低(<0.01),但在损伤后第14 d表达量显著高于S组(<0.01)。同时,T组CD206(M2巨噬细胞标志物)[15,24]mRNA在损伤后1 d和3 d表达量均显著低于S组(<0.01,图1)。
同时,本课题组前期通过流式细胞术检测损伤骨骼肌中巨噬细胞含量。结果发现,骨骼肌损伤后第1 d和第3 d脂质体包被氯膦酸盐处理组中巨噬细胞百分比显著低于损伤组[39,17]。此结果和Shen等[27]相似,他们发现,小鼠经脂质体包被氯膦酸盐处理,在伤后第1 d骨骼肌中巨噬细胞浸润减少了73.2%,第2 d减少了80.2%,第3 d减少77.4%,以上结果证实,巨噬细胞剔除模型得以成功建立。
2.2 骨骼肌挫伤模型的成功建立及巨噬细胞剔除对骨骼肌再生的影响
本研究采用重物击打腓肠肌,建立骨骼肌挫伤模型。HE结果显示,SCon组骨骼肌细胞形态规则,肌细胞核位于肌膜下,肌纤维结构完整性较好。损伤后第1 d,肌纤维结构破坏,炎性细胞浸润。伤后第3 d,大量炎性细胞浸润到损伤部位,且S组骨骼肌中可见少量再生肌纤维(中央核肌纤维)。骨骼肌损伤后第7 d,坏死肌纤维被大量中央成核肌纤维所代替,损伤后第14 d仍可见部分中央成核肌纤维。提示,骨骼肌挫伤后第14 d损伤骨骼肌未完全恢复。此结果证实,骨骼肌挫伤模型得以成功建立[40,2]。
虽然S组骨骼肌在伤后第3 d可见少量再生肌纤维,但T组骨骼肌中未见再生肌纤维。S组骨骼肌伤后第7 d可见大量新生肌纤维,T组仅有少量中央成核肌纤维零星分布,且仍有少量炎性细胞浸润。在伤后第14 d,S组中大部分再生肌纤维已成熟,仅出现少量再生肌纤维,而在T组中出现大量再生肌纤维,表明巨噬细胞剔除使骨骼肌再生得以延迟,有损骨骼肌再生(图2)。
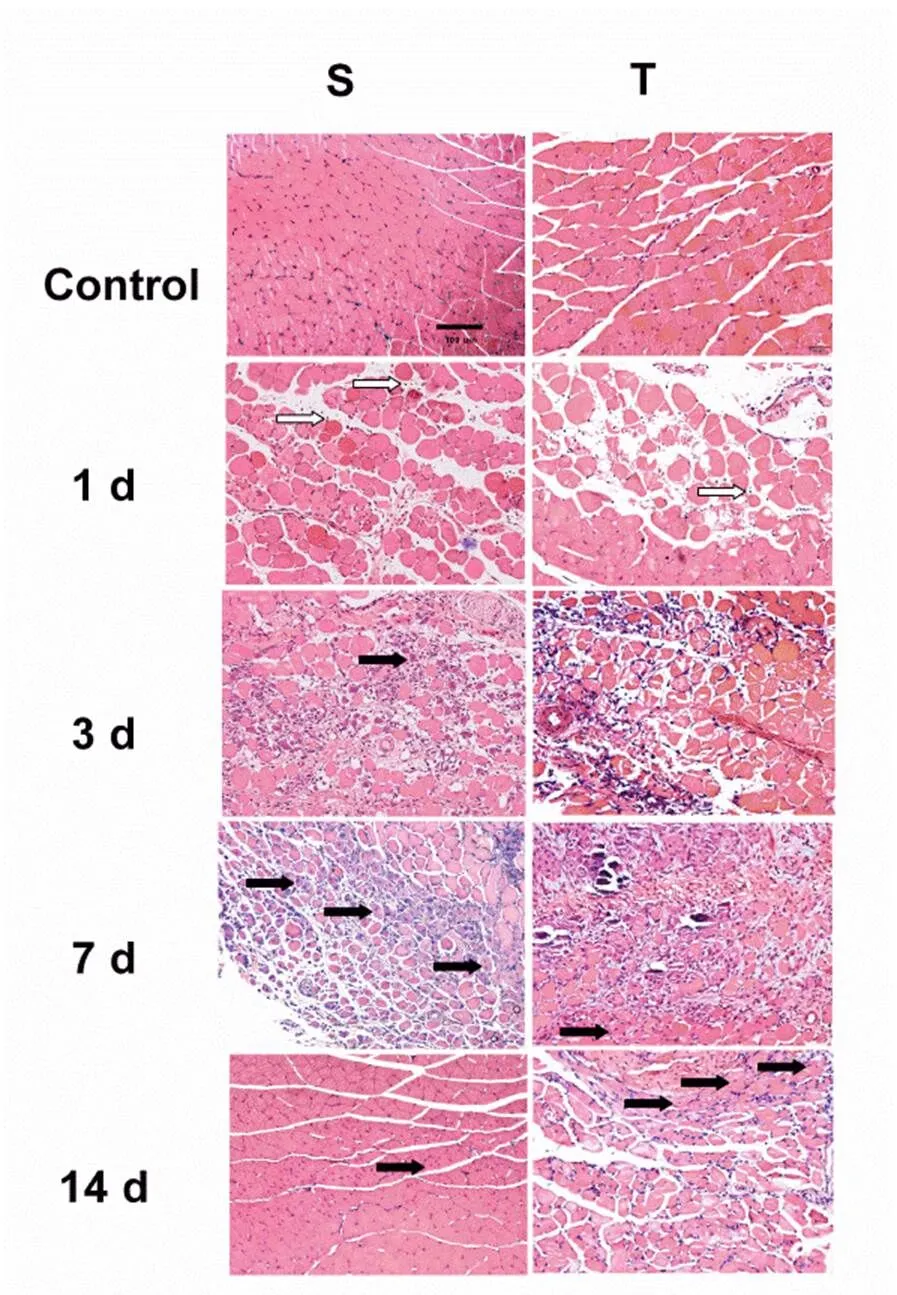
图2 巨噬细胞剔除损害骨骼肌再生
Figure 2 Macrophages Depletion Showed Markedly Impaired Muscle Regeneration after Injury.

2.3 巨噬细胞剔除对损伤骨骼肌肌卫星细胞增殖分化标志物表达的影响
MyoD通常视为肌卫星细胞增殖标志物,myogenin 为肌卫星细胞分化标志物[9]。与SCon组相比,S组MyoD mRNA在骨骼肌伤后第1 d和3 d表达显著增加(<0.01)。T组MyoD mRNA与S组相比,在伤后第7 d表达显著降低(<0.05) (图3 a)。S组myogenin mRNA在伤后第1 d和3 d表达均显著增加(<0.01)。与S组相比,T组myogenin mRNA在伤后第14 d的表达显著增加(<0.05,图3)。

图3 巨噬细胞剔除对损伤骨骼肌肌卫星细胞增殖分化物表达的影响
Figure 3 Effects of Macrophages Depletion on the Marker of Proliferation and Differentiation of Satellite Cell Post Injury.
S:骨骼肌损伤组;T:损伤+巨噬细胞剔除组;SCon:未损伤对照组;TCon:未损伤+巨噬细胞剔除对照组;与SCon组比较,a<0.05;aa<0.01;与TCon组比较,b<0.05;bb<0.01;S组与T组同一时间点比较,c<0.05;cc<0.01;

图4 巨噬细胞剔除对损伤骨骼肌肌再生因子表达的影响
Figure 4 Effects of Macrophages Depletion on Regulatory Factors for Muscle Regeneration
S:骨骼肌损伤组;T:损伤+巨噬细胞剔除组;SCon:未损伤对照组;TCon:未损伤+巨噬细胞剔除对照组;与SCon组比较,a<0.05;aa<0.01;与TCon组比较,b<0.05;bb<0.01;S组与T组同一时间点比较,c<0.05;cc<0.01;
2.4 巨噬细胞剔除对损伤骨骼肌肌再生因子表达的影响
荧光定量PCR结果显示,S组HGF mRNA在伤后第1 d、3 d和7 d表达量均显著增加(<0.01)。而T组HGF mRNA在伤后第1 d和3 d表达量均显著低于S组(<0.05,图4 a)。
S组中uPA和IGF-1 mRNA的表达与HGF相似,在损伤后表达量显著增加,巨噬细胞剔除后T组中uPA和IGF-1的表达显著低于S组(图4 b,c)。
骨骼肌损伤后S组MGF的表达与SCon组相比,无显著变化(>0.05)。T组MGF mRNA在损伤前显著高于S组(<0.01),而在损伤后第1 d和3 d表达量显著低于S组(<0.01)。
S组生长分化因子11(GDF11)mRNA在伤后第1 d表达显著增加(<0.01),T组GDF11 mRNA在伤后第7 d显著低于S组(<0.05)。
S组大麻素受体2(CB2R)mRNA在伤后第1 d和3 d表达均显著增加(<0.01),而T组CB2R mRNA在伤后1 d和7 d表达均显著低于S组(图4)。
2.5 巨噬细胞剔除对损伤骨骼肌血管再生因子表达的影响
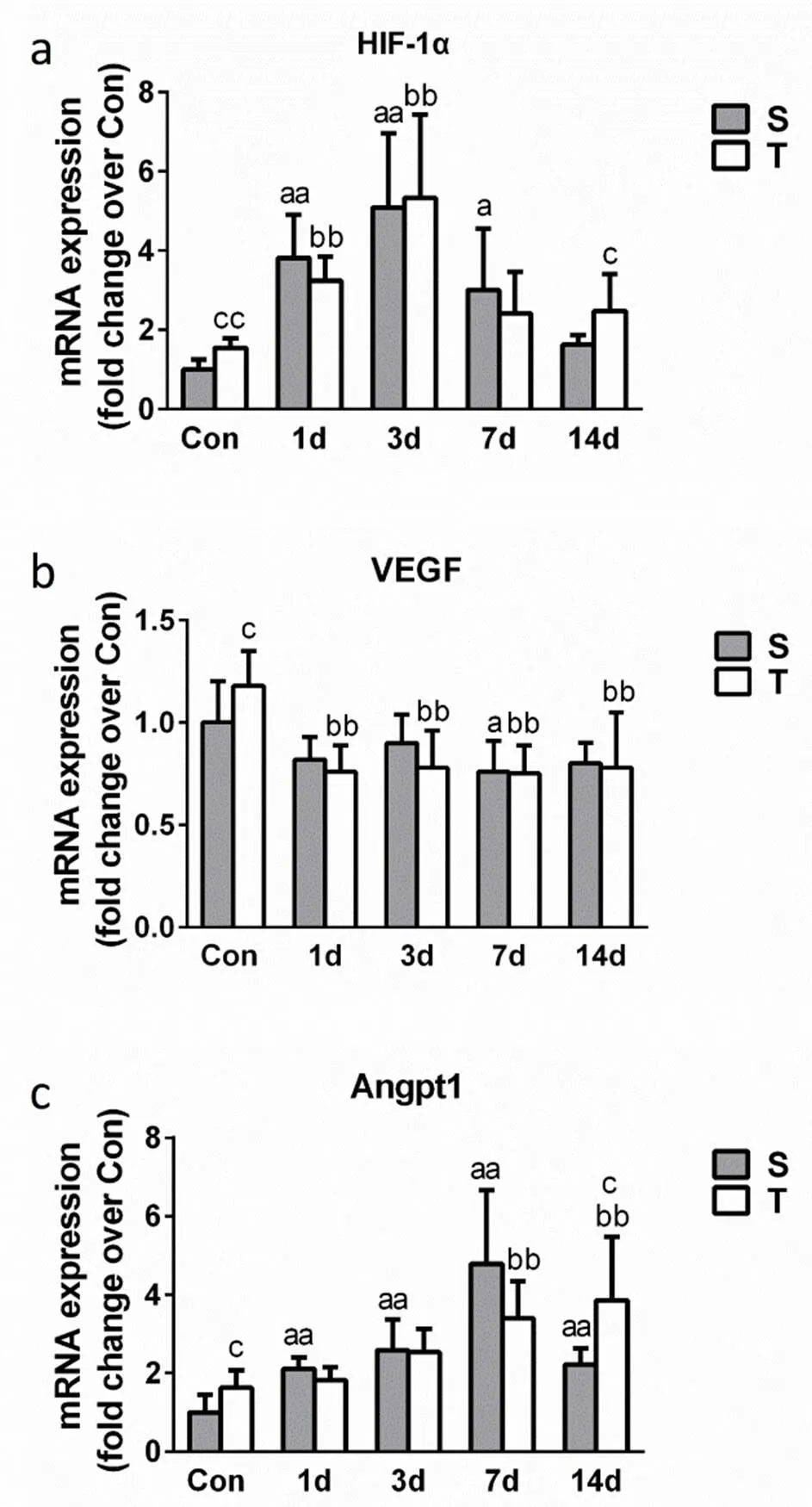
图 5 巨噬细胞剔除对损伤骨骼肌血管再生因子表达的影响
Figure. 5 Effects of macrophage depletion on the expression of angiogenesis factors
S:骨骼肌损伤组;T:损伤+巨噬细胞剔除组;SCon:未损伤对照组;TCon:未损伤+巨噬细胞剔除对照组;与SCon组比较,a<0.05;aa<0.01;与TCon组比较,b<0.05;bb<0.01;S组与T组同一时间点比较,c<0.05;cc<0.01;
荧光定量PCR研究发现,S组HIF-1α mRNA在伤后1 d、3 d和7 d表达显著增加,而在伤后14d T组HIF-1α mRNA表达显著高于S组(<0.05,图5 a)。
S组Angpt1 mRNA在伤后1-7d表达均显著增加(<0.01),伤后14 d虽进行性下降,但仍显著高于SCon组(<0.01)。巨噬细胞剔除后T组中Angpt1在损伤前以及损伤后第14 d表达均显著高于S组(<0.05,图5c)。
VEGF mRNA在伤后第7d表达显著低于SCon组(<0.05),而TCon组VEGF mRNA显著高于SCon组(<0.05,图5 b)。
2.6 巨噬细胞剔除对损伤骨骼肌Akt/mTOR蛋白质合成信号分子的影响
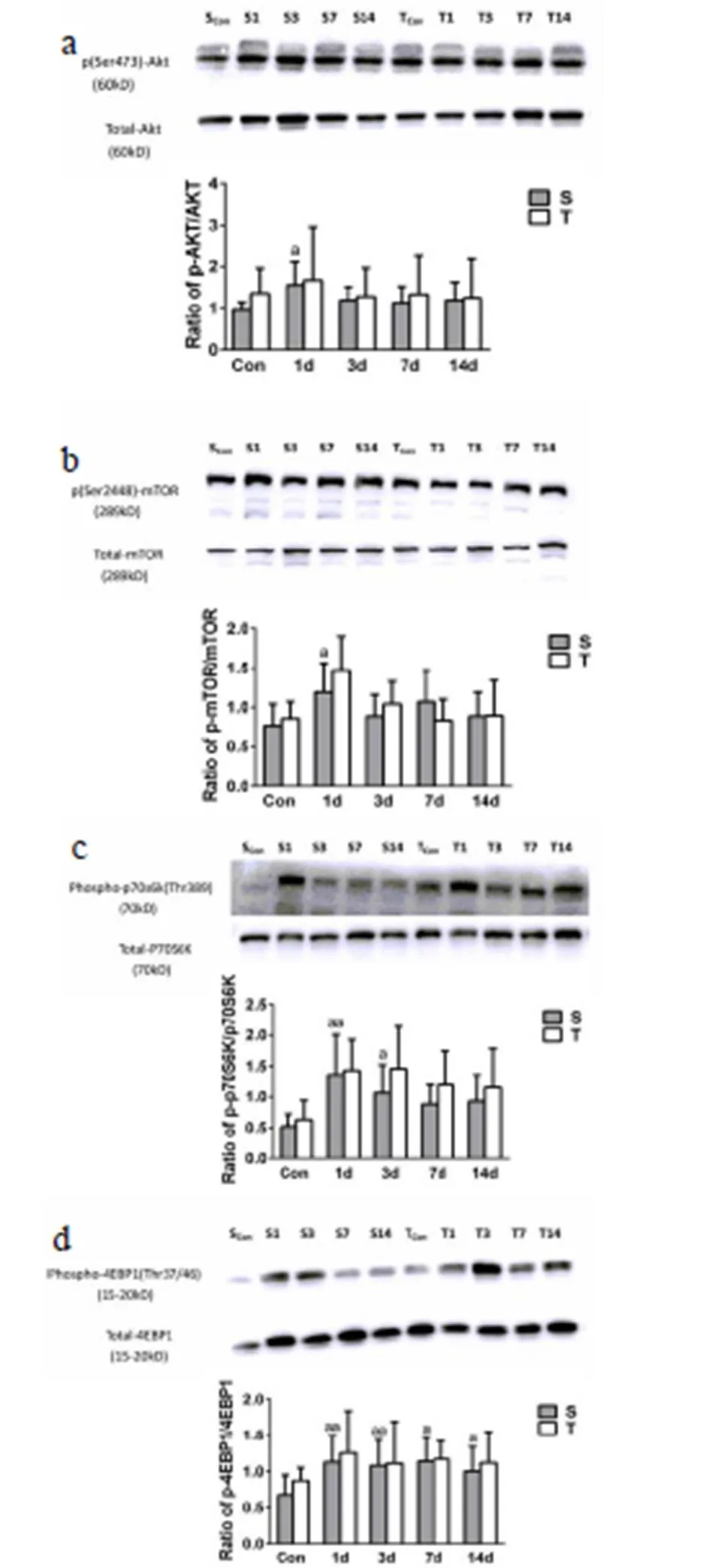
图 6 巨噬细胞剔除对损伤骨骼肌蛋白质合成信号分子表达的影响
Figure. 6 Effects of macrophage depletion on the pathway of protein synthesis
S:骨骼肌损伤组;T:损伤+巨噬细胞剔除组;SCon:未损伤对照组;TCon:未损伤+巨噬细胞剔除对照组;与SCon组比较,a<0.05;aa<0.01;与TCon组比较,b<0.05;bb<0.01;S组与T组同一时间点比较,c<0.05;ccP<0.01;
WB结果显示,S组骨骼肌p-Akt/Akt和p-mTOR/mTOR均在伤后第1d表达显著增加(<0.05),p-p70S6K/p70S6k在伤后1d和3d表达均显著增加,p-4EBP1/4EBP1在伤后1d、3d、7d和14d表达均显著增加。而T组p-Akt/Akt、p-mTOR/mTOR、p-p70S6K/p70S6K和p-4EBP1/4EBP1与SCon组及S组相比虽有增加,但并无显著变化(>0.05,图6a,b,c,d)
3 讨论
3.1 巨噬细胞剔除下调肌再生因子表达,损害骨骼肌再生
MyoD一般作为生肌调节因子参与卫星细胞激活,而myogenin则参与肌卫星细胞分化[40]。本研究中,T组myogenin表达量在伤后1 d、3 d和7 d相比,于S组均不同程度降低,但第14 d却处于高表达状态。结合形态学结果来看,T组在第14天时,仍有较多再生肌纤维(图2),提示,巨噬细胞剔除可能延迟了肌卫星细胞分化,损害了骨骼肌再生。此结果和Segawa等[26]相似,他们发现,抑制巨噬细胞活性可影响损伤骨骼肌中肌卫星细胞增殖和分化,损害骨骼肌再生。但Summan等[30]的研究认为,剔除巨噬细胞并不影响肌卫星细胞增殖和分化。从其实验设计来看,Summan等仅用伤后第3 d研究巨噬细胞剔除对肌卫星细胞增殖分化的影响,存在一定的局限性,本研究采用多点检测(伤后1-14 d),结果可能更为客观。
骨骼肌再生过程中,多种肌再生因子发挥了重要作用,如IGF-1与骨骼肌蛋白质合成有关,其异构体MGF则可能参与了肌卫星细胞的激活[29,1];HGF可激活骨骼肌中静息态肌卫星细胞[12],uPA则促进巨噬细胞向损伤骨骼肌趋化[7];CB2R可调节损伤骨骼肌中炎症反应和纤维化[42],而GDF11可影响成肌细胞分化[3]。这些因子中,有多种因子如IGF-1[18]、HGF[25]和uPA[21]等可由巨噬细胞分泌。本研究中,巨噬细胞剔除使挫伤骨骼肌修复受损,是否与这些因子有关?我们对此展开了相关研究。结果表明,骨骼肌挫伤后,多种肌再生因子(MGF除外)均显著上调表达,参与损伤骨骼肌修复,而巨噬细胞剔除后,这些肌再生因子出现显著下调。提示,这些肌再生因子可能参与了巨噬细胞剔除损害骨骼肌再生这一过程。
3.2 巨噬细胞剔除调节骨骼肌血管再生因子表达损害骨骼肌再生
血管再生是骨骼肌损伤后修复过程中的一个重要环节,骨骼肌损伤后新生的血管不仅能为再生组织提供充足的O2和营养物质,还能进一步促进骨骼肌细胞的再生,维持局部组织内环境稳态[35,28]。有研究证实,HIF-1α、Angpt1和 VEGF不仅与血管再生有关,且可直接参与骨骼肌损伤修复过程[36,20,5]。巨噬细胞也是血管再生所必须的,它可通过分泌一些血管再生因子促进血管内皮细胞分化,促进血管形成[44]。剔除巨噬细胞小鼠其血管再生水平显著降低,骨骼肌损伤修复能力受损[13]。但对于巨噬细胞剔除如何影响挫伤骨骼肌再生过程中血管再生却鲜有报道。本研究发现,巨噬细胞剔除可显著提高伤后第14 d HIF-1α和Angpt1表达。HIF-1α是低氧环境诱导产生的关键因子,其高水平表达提示,损伤处氧气供应不足,血管损伤未完成修复[36,22]。巨噬细胞剔除后,这两种血管再生因子在损伤修复后期仍处于高表达状态,提示,巨噬细胞剔除可能加剧损伤骨骼肌修复后期缺氧状态、延长了血管再生过程,进而损害骨骼肌再生。同时,本课题组前期研究也发现,巨噬细胞剔除后,在骨骼肌损伤修复后期仍有较高水平的炎症反应和氧化应激反应,提示,巨噬细胞剔除延迟了骨骼肌损伤修复进程[39]。
3.3 巨噬细胞剔除抑制Akt/mTOR蛋白质合成信号通路损害骨骼肌再生
在骨骼肌损伤后的修复过程中,蛋白质合成需大于分解,才能有效完成修复过程。Akt/mTOR信号通路是蛋白质合成的主要信号通路,骨骼肌损伤后可能通过激活Akt/mTOR及其下游信号分子促进蛋白质合成,加速骨骼肌损伤后修复过程[43,16]。与其他骨骼肌损伤模型相似,本研究发现,骨骼肌挫伤后第1 d即可激活Akt/mTOR及其下游信号分子p70S6K和4EBP1,提示骨骼肌损伤后,Akt/mTOR蛋白质合成信号通路被激活,促进蛋白质合成[19,8]。但巨噬细胞剔除是否影响挫伤骨骼肌修复过程中蛋白质合成信号通路的激活,却未见相关报道。本实验研究发现,巨噬细胞剔除后,挫伤骨骼肌中Akt/mTOR及其下游信号分子p70S6K和4EBP1与剔除对照组及损伤组相比均无显著变化。提示,巨噬细胞剔除后损伤骨骼肌中Akt/mTOR蛋白质合成信号通路可能未被激活。因此,巨噬细胞剔除损害骨骼肌再生可能与巨噬细胞剔除后未能激活损伤骨骼肌中Akt/mTOR蛋白质合成信号通路有关。
4 结论
巨噬细胞在骨骼肌挫伤修复过程中发挥了重要作用,剔除巨噬细胞可损害挫伤骨骼肌再生,其机制可能与肌再生因子表达下调、蛋白质合成信号通路未激活有关。
[1] 刘晓光, 徐苗苗, 陈佩杰, 等. IGF-1在治疗骨骼肌损伤中的应用潜能及其相关机制[J]. 生命的化学, 2016, (04): 496-502.
[2] 刘晓光, 赵淋淋, 曾志刚, 等. 骨骼肌损伤修复过程中肌再生调节因子和血管再生因子表达规律研究[J]. 中国康复医学杂志, 2016, (12): 1294-1300.
[3] 刘晓光, 赵淋淋, 田向阳, 等. 生长分化因子11在延缓衰老中的作用[J]. 中国老年学杂志, 2015, (17): 5016-5019.
[4] 肖卫华, 陈佩杰, 刘宇. 巨噬细胞在骨骼肌急性损伤修复中的作用研究进展[J]. 中国运动医学杂志, 2014, (3): 269-274.
[5] ARSIC N, ZACCHIGNA S, ZENTILIN L,. Vascular endothelial growth factor stimulates skeletal muscle regeneration in vivo[J]. Mol Ther, 2004, 10(5): 844-854.
[6] BEDAIR H S, KARTHIKEYAN T, QUINTERO A,. Angiote-nsin II receptor blockade administered after injury improves musc-le regeneration and decreases fibrosis in normal skeletal muscle [J]. Am J Sports Med, 2008, 36(8): 1548-1554.
[7] BRYER S C, FANTUZZI G, VAN ROOIJEN N,. Urokinase-type plasminogen activator plays essential roles in macrophage chemotaxis and skeletal muscle regeneration[J]. J Immunol, 2008, 180(2): 1179-1188.
[8] CONTE T C, SILVA L H, SILVA M T,. The beta2-adrenocep-tor agonist formoterol improves structural and functional regener-ative capacity of skeletal muscles from aged rat at the early stages of postinjury[J]. J Gerontol A Biol Sci Med Sci, 2012, 67(5): 443-455.
[9] CORNELISON D D, WOLD B J. Single-cell analysis of regulato-ry gene expression in quiescent and activated mouse skeletal mus-cle satellite cells[J]. Dev Biol, 1997, 191(2): 270-283.
[10] DENG B, WEHLING-HENRICKS M, VILLALTA S A,. IL-10 triggers changes in macrophage phenotype that promote muscle growth and regeneration[J]. J Immunol, 2012, 189(7): 3669-3680.
[11] ENDO T. Molecular mechanisms of skeletal muscle development, regeneration, and osteogenic conversion[J]. Bone, 2015, 80: 2-13.
[12] GRASMAN J M, DO D M, PAGE R L,. Rapid release of growth factors regenerates force output in volumetric muscle loss injuries[J]. Biomaterials, 2015, 72: 49-60.
[13] KOH Y J, KOH B I, KIM H,. Stromal vascular fraction from adipose tissue forms profound vascular network through the dyna-mic reassembly of blood endothelial cells[J]. Arterioscler Thromb Vasc Biol, 2011, 31(5): 1141-1150.
[14] KOWALSKI K, ARCHACKI R, ARCHACKA K,. Stromal derived factor-1 and granulocyte-colony stimulating factor treatm-ent improves regeneration of Pax7-/- mice skeletal muscles [J]. J Cachexia Sarcopenia Muscle, 2016, 7(4): 483-496.
[15] LEE K C, LIN H C, HUANG Y H,. Allo-transplantation of mesenchymal stem cells attenuates hepatic injury through IL1Ra dependent macrophage switch in a mouse model of liver disease [J]. J Hepatol, 2015, 63(6): 1405-1412.
[16] LI H Y, ZHANG Q G, CHEN J W,. The fibrotic role of phosphatidylinositol-3-kinase/Akt pathway in injured skeletal muscle after acute contusion[J]. Int J Sports Med, 2013, 34(9): 789-794.
[17] LIU X, LIU Y, ZHAO L,. Macrophage depletion impairs skeletal muscle regeneration: The roles of regulatory factors for muscle regeneration[J]. Cell Biol Int, 2017, 41(3): 228-238.
[18] LU H, HUANG D, SAEDERUP N,. Macrophages recruited via CCR2 produce insulin-like growth factor-1 to repair acute skeletal muscle injury[J]. FASEB J, 2011, 25(1): 358-369.
[19] MIYABARA E H, CONTE T C, SILVA M T,. Mammalian target of rapamycin complex 1 is involved in differentiation of regenerating myofibers in vivo[J]. Muscle Nerve, 2010, 42(5): 778-787.
[20] MOFARRAHI M, MCCLUNG J M, KONTOS C D,. Angiopoietin-1 enhances skeletal muscle regeneration in mice[J]. Am J Physiol Regul Integr Comp Physiol, 2015, 308(7): R576-589.
[21] NOVAK M L, BRYER S C, CHENG M,. Macrophage-specific expression of urokinase-type plasminogen activator prom-otes skeletal muscle regeneration[J]. J Immunol, 2011, 187(3): 1448-1457.
[22] ONO Y, SENSUI H, SAKAMOTO Y,. Knockdown of hypoxia-inducible factor-1alpha by siRNA inhibits C2C12 myoblast differentiation[J]. J Cell Biochem, 2006, 98(3): 642-649.
[23] PERDIGUERO E, SOUSA-VICTOR P, RUIZ-BONILLA V,. p38/MKP-1-regulated AKT coordinates macrophage transitions and resolution of inflammation during tissue repair[J]. J Cell Biol, 2011, 195(2): 307-322.
[24] SACLIER M, YACOUB-YOUSSEF H, MACKEY A L,. Differentially activated macrophages orchestrate myogenic precur-sor cell fate during human skeletal muscle regeneration[J]. Stem Cells, 2013, 31(2): 384-396.
[25] SAWANO S, SUZUKI T, DO M K,. Supplementary immun-ocytochemistry of hepatocyte growth factor production in activat-ed macrophages early in muscle regeneration[J]. Anim Sci J, 2014, 85(12): 994-1000.
[26] SEGAWA M, FUKADA S, YAMAMOTO Y,. Suppression of macrophage functions impairs skeletal muscle regeneration with severe fibrosis[J]. Exp Cell Res, 2008, 314(17): 3232-3244.
[27] SHEN W, LI Y, ZHU J,. Interaction between macrophages, TGF-beta1, and the COX-2 pathway during the inflammatory phase of skeletal muscle healing after injury[J]. J Cell Physiol, 2008, 214(2): 405-412.
[28] SHIMIZU-MOTOHASHI Y, ASAKURA A. Angiogenesis as a novel therapeutic strategy for Duchenne muscular dystrophy through decreased ischemia and increased satellite cells[J]. Front Physiol, 2014, 5: 50.
[29] SONG Y H, SONG J L, DELAFONTAINE P,. The therapeut-ic potential of IGF-I in skeletal muscle repair[J]. Trends Endocrin-ol Metab, 2013, 24(6): 310-319.
[30] SUMMAN M, WARREN G L, MERCER R R,. Macrophages and skeletal muscle regeneration: a clodronate-containing liposo-me depletion study[J]. Am J Physiol Regul Integr Comp Physiol, 2006, 290(6): R1488-1495.
[31] TIDBALL J G. Mechanisms of muscle injury, repair, and regener-ation [J]. Compr Physiol, 2011, 1(4): 2029-2062.
[32] TIDBALL J G, VILLALTA S A. Regulatory interactions between muscle and the immune system during muscle regeneration[J]. Am J Physiol Regul Integr Comp Physiol, 2010, 298(5): R1173-1187.
[33] TYNER J W, UCHIDA O, KAJIWARA N,. CCL5-CCR5 interaction provides antiapoptotic signals for macrophage survival during viral infection[J]. Nat Med, 2005, 11(11): 1180-1187.
[34] VILLALTA S A, RINALDI C, DENG B,. Interleukin-10 reduces the pathology of mdx muscular dystrophy by deactivating M1 macrophages and modulating macrophage phenotype[J]. Hum Mol Genet, 2011, 20(4): 790-805.
[35] WAGATSUMA A. Endogenous expression of angiogenesis-related factors in response to muscle injury[J]. Mol Cell Biochem, 2007, 298(1-2): 151-159.
[36] WAGATSUMA A, KOTAKE N, YAMADA S. Spatial and tempo-ral expression of hypoxia-inducible factor-1alpha during myogen-esis in vivo and in vitro[J]. Mol Cell Biochem, 2011, 347(1-2): 145-155.
[37] WANG H, MELTON D W, PORTER L,. Altered macrophage phenotype transition impairs skeletal muscle regeneration[J]. Am J Pathol, 2014, 184(4): 1167-1184.
[38] XIAO W, CHEN P, DONG J. Effects of overtraining on skeletal muscle growth and gene expression[J]. Int J Sports Med, 2012, 33(10): 846-853.
[39] XIAO W, LIU Y, CHEN P. Macrophage depletion impairs skele-tal muscle regeneration: the roles of pro-fibrotic factors, inflam-mation, and oxidative Stress[J]. Inflammation, 2016, 39(6): 2016-2028.
[40] XIAO W, LIU Y, LUO B,. Time-dependent gene expression analysis after mouse skeletal muscle contusion[J]. J Sport Heal Sci, 2016, 5(1): 101-108.
[41] ZHANG C, LI Y, WU Y,. Interleukin-6/signal transducer and activator of transcription 3 (STAT3) pathway is essential for macrophage infiltration and myoblast proliferation during muscle regeneration[J]. J Biol Chem, 2013, 288(3): 1489-1499.
[42] ZHANG M, JIANG S K, TIAN Z L,. CB2R orchestrates fibrogenesis through regulation of inflammatory response during the repair of skeletal muscle contusion[J]. Int J Clin Exp Pathol, 2015, 8(4): 3491-3502.
[43] ZHANG P, LIANG X, SHAN T,. mTOR is necessary for proper satellite cell activity and skeletal muscle regeneration[J]. Biochem Biophys Res Commun, 2015, 463(1-2): 102-108.
[44] ZORDAN P, RIGAMONTI E, FREUDENBERG K,. Macro-phages commit postnatal endothelium-derived progenitors to angi-ogenesis and restrict endothelial to mesenchymal transition during muscle regeneration[J]. Cell Death Dis, 2014, 5: e1031.
Depletion of Macrophage Impairs Skeletal Muscle Regeneration by Inhibited the Expression of Muscle Regeneration Regulatory Factors and Akt / mTOR Protein Synthesis Signaling Pathway
LIU Xiao-guang1, XIAO Wei-hua1, CHEN Pei-jie1, ZHAO Lin-lin1, ZENG Zhi-gang1,2, ZHOU Yong-zhan1, ZHENG Li-fang1
1.Shanghai University of Sport, Shanghai 200438, China; 2.Jinggangshan University, Ji’an 343009, China
Objective: The purpose of this study is to explore the relationship between macrophage and muscle regeneration regulatory factors and Akt/mTOR signaling pathway, in order to investigate the role and mechanism of macrophages in the regeneration of injured skeletal muscle. Methods: Eighty C57BL/6 mice were randomly divided into muscle contusion (S, n=32), muscle contusion+ macrophages depleted (T, n=32), control (SCon, n=8), and macrophages depleted control groups (TCon, n=8). Their outer layer of the gastrocnemius muscles were harvested at the time points of 1, 3, 7 and 14d post-injury. The changes of skeletal muscle morphology were assessed by hematoxylin and eosin (HE) stains. The gene and protein expression was analyzed by real-time polymerase chain reaction (RT-PCR) and western blotting (WB). Results: 1) The HE results showed that skeletal muscle fibers were significantly impaired and the injured fibers had almost degenerated at 1d and 3d post-injury in both S and T groups. At 7d after injury, the damaged muscle area in the group S had been replaced mostly by newly formed muscle fibers, whereas numerous necrotic myofibers and inflammatory cells dominated the injured muscle regions of group T. In addition, a large number of regenerated muscle fibers were observed at 14d after injury in the group T. 2) The Myogenic Differentiation Antigen (MyoD) and myogenin mRNA increased significantly post-injury (p<0.01). As compared to the S group, macrophage depletion significantly inhibited MyoD mRNA level and increased myogenin mRNA level in the group T post-injury (p<0.05). 3) The regulatory factors of muscle regeneration (except mechano growth factor, MGF) mRNA increased significantly in the group S post-injury. However, compared with group S, the expression of regulatory factors of muscle regeneration of T group was significantly down regulated. 4) Hypoxia-inducible factor-1α (HIF-1α) and angiopoietin1 (Angpt1) mRNA increased significantly post-injury in group S. Compared with group S, HIF-1 and Angpt1 in T group were significantly up-regulated in the later stage of muscle regeneration. 5) WB analysis showed that p-Akt/Akt, p-mTOR/mTOR, p-p70S6K/p70S6k and p-4EBP1/4EBP1 increased significantly post-injury in group S. However, there were no significantly change in the expression of p-Akt/Akt, p-mTOR/mTOR, p-p70S6K/p70S6k and p-4EBP1/4EBP1 in the group T after injury. Conclusion: Macrophages play important roles in muscle regeneration after injury. Macrophage depletion impairs muscle regeneration and that the inhibition of muscle regeneration regulatory factors and Akt/mTOR pathway may involve in the process.
1000-677X(2018)03-0056-09
10.16469/j.css.201803006
G804.7
A
2017-10-10;
2018-02-03
国家自然科学基金资助项目(31300975, 31271273); 上海市人类运动能力开发与保障重点实验室资助项目(11DZ2261100)。
刘晓光,男,在读博士研究生,主要研究方向为运动健康促进的生物学机制,E-mail:xiaoguangliu2008@126.com;肖卫华,男,博士,副教授,研究方向为运动健康促进的生物学机制,E-mail: xiaoweihua@sus.edu.cn; 陈佩杰,男,博士,教授,研究方向为运动免疫与运动健康促进,E-mail:chenpeijie@sus.edu.cn。
