生姜提取物对鱿鱼肌原纤维蛋白氧化的影响
2021-10-19刘鑫鑫陈徐欢王莹莹霍健聪缪文华
刘鑫鑫,陈 彧,陈徐欢,王莹莹,霍健聪,缪文华
(浙江海洋大学食品与药学学院 浙江舟山316022)
近年来,随着远洋鱿钓的发展,鱿鱼产量在远洋捕捞中所占的比重越来越大。《2018 中国渔业统计年鉴》 数据显示我国鱿鱼捕获量达57.43 万t,占全部远洋捕捞产量的25.44%。然而,由于鱿鱼含水量高(70%~85%)、不饱和脂肪酸含量高、组织脆弱等原因,在生产加工过程中,其肌原纤维蛋白(Myofibrillar protein,MFP)容易被氧化。大量研究表明氧化会引起MFP 结构特性的改变,进而降低其功能特性[1-3]。针对氧化带来的不利影响,常通过添加抗氧化剂以控制氧化反应。目前的抗氧化剂以合成抗氧化剂为主,因安全性问题而导致其使用一直备受质疑[4]。
利用天然多酚物质作为抗氧化剂以抑制蛋白质的氧化成为当前的研究热点。大量研究发现多酚物质与蛋白质之间存在相互作用,在有些方面这种相互作用被认为是有利的,如多酚通过与MFP 相互作用提高了MFP 膜抗张强度[5-6]。然而,多酚物质与MFP 的相互作用对其抗氧化性的发挥是否有利,有待进一步的验证。Sisse[7]在研究白葡萄提取物对气调包装下蛋白质和脂质的影响时发现,白葡萄提取物的添加加速了MFP 巯基的损失,并降低了肌球蛋白间的相互交联。贾娜等[8]将不同浓度的没食子酸添加到含MFP 的Fenton 氧化体系中,发现没食子酸造成MFP 羰基、巯基和溶解度降低,对MFP 的二级结构也造成了影响。有研究者认为多酚物质的浓度决定其在对MFP的氧化过程中所扮演的是抗氧化还是促氧化角色[9]。
生姜提取物(GE)中含有多种酚类物质,其具有优良的抗氧化特性[10]。本课题以从鱿鱼胴体中提取的MFP 为研究对象,按一定比例添加GE,然后利用Fenton 氧化体系,对MFP 进行不同程度氧化,分析羰基含量、总巯基含量、Ca2+-ATPase 活性、表面疏水性等指标的变化,并进行SDS-PAGE电泳,研究GE 对MFP 氧化的控制作用。这对于控制水产品生产加工过程中因蛋白质氧化而造成的功能特性下降具有重要意义。
1 材料与方法
1.1 材料与试剂
试验原料:试验所用秘鲁鱿鱼购于舟山国际水产城。
试验试剂:乙二胺四乙酸、2,4-二硝基苯肼、5,5'-二硫代双(2-硝基苯甲酸)等均为AR 级,购于国药化学试剂有限公司。SDS-PAGE 凝胶电泳试剂盒,购于上海碧云天生物技术有限公司;彩虹180 广谱蛋白Marker(11-180KD),购于北京索莱宝科技有限公司;超微量Ca2+-ATPase 活性检测试剂盒,购于南京建成生物工程研究所。
1.2 主要仪器与设备
751UVGD 型紫外-可见光分光光度计,上海第三分析仪器厂;DYY-8C 型电泳仪,北京市六一仪器厂;FJ200-SH 型数显高速分散均质机,上海标本模型厂;CF-16RN 高速冷冻多用途离心机,日本日立公司;WD-9405B 型水平摇床,北京市六一仪器厂。
1.3 试验方法
1.3.1 GE 的制备及其总酚含量的测定 取生姜洗净,切成片状于60 ℃烘干。烘干后的生姜用组织捣碎机磨成粉,过60 目筛得生姜粉。准确称取生姜粉10 g 于250 mL 三角瓶中,按料液比1∶15(g∶mL)加入95%乙醇,25 ℃下超声波(100 W)萃取15 min 后过滤。旋蒸除去滤液中的乙醇,剩余黄棕色浸膏状物质即为GE。取GE 稀释液0.5 mL,加入福林酚试剂1.0 mL,再加入5%碳酸钠溶液15.0 mL,转移至100 mL 棕色容量瓶,加水稀释至刻度,摇匀后静置2 h,在波长760 nm 处测定吸光度。同时以没食子酸绘制标准工作曲线y=104.828x+0.04286,R=0.9993,经测定样品中总酚含量为10.97 mg/mL。
1.3.2 肌原纤维蛋白的提取 参照Bertram 等[11]的方法进行肌原纤维蛋白的提取。取经过预处理的鱿鱼胴体肉,加3 倍体积A 液(0.1 mol/L KCl,0.02 mol/L Tris-HCl,pH 7.5)和1 倍体积B 液(1% TritonX-100,0.1 mol/L KCl,0.02 mol/L Tris-HCl,pH 7.5),匀浆(8 000 r/min)90 s 后冷冻离心(10 000 r/min,15 min,4 ℃),取沉淀。重复以上步骤3 次。最后加入用4 倍体积A 液浸提,冷冻离心(10 000 r/min,15 min,4 ℃),最后取得的沉淀即为肌原纤维蛋白,考马斯亮蓝法测定其蛋白含量。
1.3.3 肌原纤维蛋白的氧化方法和GE 的添加设计 试验A(MFP 氧化方法):固定体系中FeCl3和抗坏血酸钠浓度,改变H2O2浓度,即0.1 mmol/L FeCl3和0.1 mmol/L 抗坏血酸,H2O2浓度分别选择0,0.1,1,5,10 和20 mmol/L。将提取的肌原纤维蛋白溶于以上氧化体系中,使得蛋白质的最终质量浓度为20 mg/mL。试验组分别添加1 mL 总酚质量浓度为0.2 mg/mL 的GE 溶液,而对照组则添加等量蒸馏水。然后将样品在4 ℃下放置3 h,使肌原纤维蛋白发生不同程度的氧化,通过添加1 mL乙二胺四乙酸二钠(1 mmol/L)来中止氧化反应。
试验B(GE 添加设计):固定体系中含0.1 mmol/L FeCl3和0.1 mmol/L 抗坏血酸,蛋白质质量浓度为20 mg/mL,H2O2浓度为50 mmol/L,各组添加1 mL 总酚质量浓度分别为0,0.1,0.2,0.5,1 mg/mL 的GE 溶液,对照组未添加H2O2和GE 溶液,其它操作同试验A。
1.4 分析方法
1.4.1 羰基含量测定方法 参考Levine 等[12]的方法并做适当修改。取1 mL 蛋白溶液放入塑料离心管并加入1 mL 2,4-二硝基苯肼(DNPH)溶液(10 mol/L 含2 mol/L HCl),室温条件下避光静置1 h(每15 min 振荡1 次),添加3 mL 20%的三氯乙酸(TCA)后10 000 r/min 离心5 min,弃上清液,用乙酸乙酯-乙醇(体积比1∶1)清洗沉淀至澄清,加入6 mol/L 盐酸胍溶液0.5 mL,室温下放置15 min 使沉淀溶解,然后10 000 r/min 离心3 min 去除不溶物。所得溶液于370 nm 波长下测定吸光度。使用分子吸光系数22 000 L/(mol·cm)计算每mg 蛋白中羰基含量。
1.4.2 总巯基含量的测定 参考Youngsawatdigul等[13]的方法并做适当修改。取1 mL 蛋白溶液于试管中并添加9 mL、50 mmol/L 磷酸盐缓冲液(含0.6 mol/L NaCl,10mmol/L EDTA,8 mol/L 尿素,pH 7.0)。取5 mL 上述混合液加入0.5 mL 0.2 mmol/L 的DTNB 试剂(溶解在 0.1 mol/L 磷酸盐缓冲液中,pH 7.0),25 ℃保温25 min,于412 nm波长下测定吸光度。使用分子吸光系数13 600 L/(mol·cm)计算每mg 蛋白中总巯基的含量(nmol)。
1.4.3 Ca2+-ATPase 活性测定 取1 mL 蛋白溶液,经10 000 r/min 离心5 min 后,倒去上清液并加入1 mL 0.6 mol/L 的KCl 溶液旋涡振荡溶解。然后利用南京建成生物工程研究所的超微量Ca2+-ATPase 活性检测试剂盒进行测定。
1.4.4 表面疏水性的测定 参考李艳青[14]的方法并做适当修改。取1 mL 蛋白溶液,经10 000 r/min 离心5 min 后,倒去上清液并加入1 mL 20 mmol/L pH 6.0 的磷酸盐溶液中,80 μL 的溴酚蓝(BPB,1 mg/mL),混匀,室温下搅拌10 min,然后10 000 r/min 离心15 min,取上清液(适当稀释后)在595 nm 下测定吸收值A1。溴酚蓝空白样是用1 mL pH 6.0,20 mmol/L 的磷酸盐缓冲液加入200 μL BPB,然后相同条件下测定吸光度A0,按下列公式计算表面疏水性:
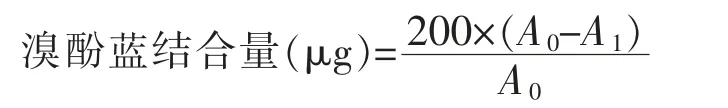
1.4.5 SDS-PAGE 电泳 参考Laemmli[15]的方法并做适当修改。选用分离胶体积分数12%(含12%丙烯酰胺,SDS,1.5 mol/L pH 8.8 Tris-HCl,过硫酸铵,TEMED),浓缩胶体积分数3.75%(含3.75%丙烯酰胺,SDS,1.5 mol/L pH 6.8 Tris-HCl,过硫酸铵,TEMED),1L 电极缓冲含Tris 3.02 g,甘氨酸18.8 g,10% SDS 10 mL。电泳采用1 mm 凝胶板;上样量为10 μL;开始电泳时电压为80 V,待样品进入分离胶后改为120 V;电泳结束后,取出胶片用考马斯亮蓝染色1 h(100 mL 染色液含有0.25 g 考马斯亮蓝R250,甲醇45 mL,冰醋酸10 mL),然后用甲醇/冰醋酸脱色液脱至透明(脱色液中含有5%的甲醇和7.5%的冰醋酸)。
1.5 统计分析
所得数据均为3 次平行的平均值,结果表示为“平均数±标准差”。利用Microsoft Excel 软件处理数据,OriginPro 8 软件作图以及SPSS Statistics 22 中的单因素方差分析进行显著性分析,以P<0.05 表示差异显著。
2 结果与分析
2.1 GE 对MFP 氧化时羰基含量的影响
羰基的形成(醛基和酮基)是蛋白质氧化后的一个显著变化,被广泛用于测量蛋白质的氧化程度[16]。如图1a所示,与未氧化的蛋白相比,氧化的蛋白质羰基含量显著增加,尤其是未添加GE 的组别。H2O2浓度为20 mmol/L 的组别与0 mmol/L的组别相比,其羰基含量增加了90.35%(P<0.05),而GE 在一定程度上抑制了MFP 羰基的形成,当H2O2浓度为20 mmol/L 时,添加GE 后,其羰基含量显著下降了19.19%(P<0.05)。如图1b所示,GE抑制羰基含量效果与浓度呈正相关,GE 添加量越大,则羰基含量越低。分别添加0.1,0.2,0.5,1 mg/mL 的GE 溶液后,其羰基含量分别降低了3.95%,9.21%,23.25%,30.26%(P<0.01),这可能与姜酚类物质所具备的酚羟基结构有关,通常认为酚类物质通过接收羟基自由基的方式[10],避免了蛋白质侧链被氧化修饰,从而抑制了蛋白羰基含量的增加。

图1 GE 对MFP 羰基含量的影响Fig.1 The effect of GE on carbonyl content of MFP
2.2 GE 对MFP 氧化时总巯基含量的影响
MFP 的巯基极易与多酚物质发生交联作用导致总巯基含量的降低[7-8],因此通过MFP 总巯基含量的变化可直观地了解氧化条件下GE 与MFP 的交联程度。如图2a所示,添加或未添加GE 的组别经氧化后,MFP 均发生了显著降低(P<0.05)。当H2O2浓度为0 mmol/L 时,添加GE 后蛋白总巯基降低了3.92%(P<0.05),Prodpran 等[5]在研究酚类物质对肌原纤维蛋白交联性影响中发现了同样的情况。而在氧化环境下,GE 进一步促进了蛋白总巯基含量的下降。当H2O2浓度分别为1,5,10,20 mmol/L 时,添加GE 后蛋白质总巯基含量分别降低了16.72%,23.87%,26.13%,14.81%(P<0.05)。类似的情况同样在图2b 中被观察到,分别添加0.1,0.2,0.5,1 mg/mL 的GE 溶液后,与未添加GE的组别相比,其总巯基含量分别降低了2.36%,5.91%,26.63%,32.54%(P<0.01)。以上数据充分说明,GE 促进了总巯基含量的降低,且促进效果与GE 浓度呈正相关,即GE 浓度越高总巯基含量越低。相关研究发现多酚化合物与巯基之间存在相互作用,即在氧化条件下多酚化合物被氧化为相应的醌类物质,进而与巯基反应生成巯基-醌化合物[17-19]。Jongberg 等[20]认为巯基-醌化合物的生成不仅避免了巯基被氧化为二硫键,还提高了多酚物质的抗氧化活性。

图2 GE 对MFP 总巯基含量的影响Fig.2 The effect of GE on total sulfhydryl content of MFP
2.3 GE 对MFP 氧化时Ca2+-ATPase 酶活性的影响
肌球蛋白头部催化中心具有两个活性巯基(-SH1和-SH2),其中-SH1负责Ca2+-ATPase 酶活性[21]。羟基自由基对这些基团的氧化修饰会导致肌球蛋白构象的改变,影响其与底物的相互作用,进而影响Ca2+-ATPase 酶活性[22]。通过Peason 相关性分析可知,两者之间(图2b,图3b)相关系数为0.911,P=0.000,因此Ca2+-ATPase 酶活性变化与总巯基含量的变化之间有着极高的相关性。
如图3a所示,各组MFP 的Ca2+-ATPase 的活性随H2O2浓度的增加均发生了显著下降(P<0.05)。未氧化MFP 的Ca2+-ATPase 的活性为2.45 U/mg,经氧化后分别下降了34.73%(0.1 mmol/L),72.36%(1 mmol/L),90.18%(5 mmol/L),91.32%(10 mmol/L),95.64%(20 mmol/L)。当H2O2浓度为0.1 mmol/L 时,与未添加GE 的组别相比,添加GE 的MFP Ca2+-ATPase 活性相对下降了72.89%(P<0.05)。陈洪生等[23]在研究中同样发现多酚类物质在氧化条件下加速Ca2+-ATPase 活性下降的情况。通过图3b 我们可发现,在氧化条件下,高质量浓度GE(0.2,0.5,1 mg/mL)的添加抑制了Ca2+-ATPase 活性(P<0.05),而低质量浓度GE 的添加(0.1 mg/mL)未对酶活性造成显著性影响(P>0.05)。巯基-醌化合物的生成虽然避免了巯基被氧化为二硫键,但仍然对肌球蛋白的Ca2+-ATPase 活性造成了显著影响。

图3 GE 对氧化MFP Ca2+-ATPase 活性的影响Fig.3 The effect of GE on Ca2+-ATPase activity of MFP
2.4 GE 对MFP 氧化时表面疏水性的影响
氧化导致蛋白质二级、三级结构发生改变,一些疏水基团从蛋白质内部暴露,致使表面疏水性的增加[11,16]。如图4a所示,所有MFP 样品的表面疏水性均随H2O2浓度的增加而显著增加。当H2O2浓度分别为10,20 mmol/L 时,添加GE 后其表面疏水性分别降低了7.18%,16.41%(P<0.05)。如图4b所示,GE 抑制表面疏水性效果与GE 浓度呈正相关,即GE 添加量越大,则MFP 的表面疏水性越低。分别添加0.1,0.2,0.5,1 mg/mL 的GE 溶液后,其表面疏水性分别降低了8.29%,15.43%,25.49%和26.54%,以上数据说明GE 具有抑制氧化MFP表面疏水性增加的效果,且浓度越高抑制效果越好。GE 抑制MFP 表面疏水性的增加可能存在多种途径:1)GE 通过清除羟基自由基,维持了MFP正常的空间构象;2)酚类物质与MFP 相结合,使得蛋白质分子表面极性增强[24];3)GE 的添加造成蛋白的聚集从而抑制表面疏水性的增加[25]。

图4 GE 对氧化MFP 表面疏水性影响Fig.4 The effect of GE on surface hydrophobicity of MFP
2.5 SDS-PAGE 电泳
不同分子质量条带对应的蛋白质分别为:肌球蛋白重链(MHC,约200 ku),副肌球蛋白(PM,100~135 ku),肌动蛋白(Actin,35~48 ku),以及肌球蛋白轻链(MLC,11~17 ku)。蛋白质氧化的一个主要结果是通过共价键和非共价键的方式形成蛋白质聚合物[26-27],导致一些蛋白分子堆积在分离胶顶部,甚至可能存在于浓缩胶中。如图5a所示,MFP 经20 mmol/L 的H2O2氧化3 h 后,产生部分分子质量大于200 ku 的蛋白聚合物(I),相同的情况可在图5c 中观察到(Ⅱ)。在添加GE 后,如图5b、5c所示,氧化前后蛋白条带并未发现显著变化,同时添加不同浓度的GE 也未能对蛋白条带产生显著性影响(Ⅱ)。因此认为,蛋白与多酚类物质交联形成的聚合物是可被还原的[8]。

图5 GE 对氧化MFP SDS-PAGE 电泳图谱影响Fig.5 The effect of GE on SDS-PAGE pattern of oxidized MFP
3 结论
GE 的添加具有抑制蛋白氧化的效果,表现在其抑制了羰基和表面疏水性的增加。同时,GE 与MFP 的活性巯基相互作用生成巯基-醌加成物,这极大地促进了总巯基含量的降低,但却避免了活性巯基被氧化为二硫键。然而,巯基-醌化合物的生成不可避免地造成肌球蛋白Ca2+-ATPase 活性的下降。通过SDS-PAGE 电泳图谱可知,GE 与MFP 之间的交联是可被还原的。今后还需要深入研究酚类氧化产物与MFP 侧链氨基酸交联的具体位点与方式,同时不同的多酚物质对蛋白结构和功能性影响也有待进一步探索。
