鲜菌草工厂化栽培银耳物质转化特性研究
2021-10-18林兴生王泽辉马运龙林占熺林冬梅罗海凌
林兴生, 王泽辉, 马运龙, 林占熺, 林 辉, 林冬梅, 罗海凌
(福建农林大学国家菌草工程技术研究中心, 福州 350002)
1 引 言
银耳(TremellafuciformisBerk.) ,又称雪耳、白木耳,有“菌中之冠”之称,隶属于银耳科(Tremellaceae),银耳属(Tremella)[1],在我国有悠久的食用历史,现代医学研究证明银耳子实体种中含有多糖、黄酮及氨基酸等多种成分,其中银耳多糖为其重要的活性物质[2].常规人工栽培银耳的方式主要有段木栽培和代料栽培两种[3].1983年福建农林大学林占熺研究员尝试以五节芒、类芦、芦苇等草本植物为主要原料栽培银耳等食药用菌,发明了菌草技术,菌草定义为适宜栽培食药用菌的草本植物,菌草是一类新的草种类别,是新型生物材料.1989年在福建省尤溪县用五节芒等野生菌草栽培银耳示范生产获得成功[4].2009年开展鲜菌草栽培银耳的研究[5],取得重要进展,表明鲜菌草栽培银耳可行,利用鲜菌草栽培银耳利于可持续发展.绿洲1号(Arundodonaxcv. Lvzhou No.1)隶属于芦竹属,种名未定,是近年来培育推广的主要菌草之一.
气相色谱-质谱联用法(Gas Chromatography Quadrupole Time of Flight Mass Spectrometry, GC-MS)具有分离效果好、灵敏度高及易于定性定量分析等优点,代谢组学是反应生物生理状态的重要工具[6-7],已在食用菌研究中广泛应用[8],张燕揭示了平菇多糖调节肝损伤病大鼠的液柠檬酸、苹果酸和D-葡萄糖醛酸等代谢通路,从而改善肝损伤大鼠症状,具明显的保肝作用[9].李佳琪揭示刺芹侧耳栽培料中木质素的代谢产物关系到软木质单体合成、香豆素合成、丁香油酚合成等代谢途径[10].李翔从椴木银耳、袋栽银耳中检测出86种挥发性成分,证明椴木银耳中相对含量最高的是乙酸,袋栽银耳中相对含量最高的是正乙醛[11].银耳子实体生长,需要香灰菌把培养料中大分子物质分解成小分子物质[12].培养料中只有在原基处既可检测到银耳菌丝,又能检测到香灰菌[13],因此原基处是银耳生长过程中营养转化的重要部位.目前关于银耳栽培中物质转化特性鲜有报道,本文旨在通过GC-MS法研究鲜菌草工厂化栽培银耳不同生长期原基处的物质转化特性,为鲜菌草工厂化栽培银耳提供理论依据.
2 材料与方法
2.1 材 料
2.1.1 供试菌株 银耳XY-04(A4)菌株,由福建省祥云生物科技发展有限公司提供.
2.1.2 供试配方 鲜菌草替代部分棉籽壳工厂化栽培银耳的培养基配方:鲜绿洲1号菌草55.5%、棉籽壳15.5%、麦麸28%、石膏1%、含水量58%,鲜绿洲1号菌草采自福建农林大学尤溪洋中科教基地,于配料前一天收割粉碎备用.
2.1.3 供试样品 在福建省祥云生物科技发展有限公司栽培车间内工厂化栽培银耳,分别在菌丝生长期G1(接种后12 d)、原基分化期G2(接种后24 d )和子实体生长期G3(接种后36 d )三个生长期的培养基表面原基分化处取培养料采样,迅速冻存样品,每组样品3个重复.

图1 G1、G2和G3三个不同生长期长势图Fig.1 Growth situation of Tremella fuciformis in three stages of G1, G2 and G3
2.1.4 主要仪器和试剂 Agilent气相色谱-7890A,LEVO质谱仪-PEGASUS HT,Agilent色谱柱-DB,Thermo Fisher Scientific 离心机-Heraeus Fresco17,Thermo Fisher Scientific超低温冰箱-Forma 900 series,Sartorius分析天平-BSA124S-CW,Merck Millipore纯水仪-明澈 D24 UV.甲醇(Methanol),氯仿(Chloroform),吡啶(Pyridine),甲氧铵盐(Methoxyaminatio hydrochloride),L-2-氯苯丙氨酸(2-Chloro-L-phenylalanine):BSTFA(with 1% TMCS,v/v);饱和脂肪酸甲酯(FAMEs).
2.2 方 法
2.2.1 样本提取 将样品混合均匀后取100 mg 于2 mL EP 管中,向管中先加入1 000 μL 预冷提取液(V甲醇∶V水=3∶1),混合均匀后加入10 μL 的内标溶液(L-2-氯苯丙氨酸),盖紧瓶盖放在涡旋混匀器上涡旋30 s;向EP管中加入瓷珠,使用研磨仪在35 Hz条件下处理 4 min,超声5 min,重复3次,全程在冰水浴中进行;将处理还得样本进行4 ℃离心,离心条件为10 000 r/rpm 、15 min;取200 μL上清液于转入新的1.5 mL EP 管中;将装有上清液的EP管放入真空浓缩器中干燥提取物:从真空浓缩机中取出已经干燥好的提取物,向干燥后的代谢物加入60 μL甲氧胺盐试剂(甲氧胺盐酸盐,溶于吡啶 20 mg/mL),轻轻混匀后,放入烘箱中 80 ℃孵育 30 min;孵育完成后,向每个样品中加入80 μL BSTFA(含有1% TMCS,v/v),混合后放入烘箱中70 ℃孵育1.5 h;孵育结束后将样品上机检测.
2.2.2 GC-MS检测 使用Agilent7890气相色谱仪和飞行时间质谱仪对样品进行GC-TOF-MS分析.系统采用DB-5MS毛细管柱.1 μL样品均以无分裂方式注入.以氦为载气,前入口吹扫流量3 mL/min,通过柱的气体流量1 mL/min.初始温度保持在50 ℃下1min,然后以10 ℃/min的速率提高到310 ℃/ min,然后在310 ℃下保持8 min. 进样口、传输线和离子源温度分别为280 ℃、280 ℃和250 ℃.在电子冲击模式下,能量为-70 eV.质谱数据在全扫描模式下获得,m/z范围为50~500,溶剂延迟6.30 min后,每s12.5光谱的速率.
2.2.3 数据处理与分析 使用Chroma TOF软件对质谱数据进行了峰提取、基线矫正、解卷积、峰积分、峰对齐等分析[14],用 LECO-Fiehn Rtx5数据库对代谢物质进行定性,包括质谱匹配和保留时间指数匹配[15].对处理后的数据进行主成分分析(Principal component analysis, PCA)、偏最小二乘法判别分析(Partial least squares discrimination analysis,PLS-DA)及正交偏最小二乘判别分析(Orthogonal PLS-DA,OPLS-DA),找出差异代谢物,通过匹配KEGG Pathway、HMDB和PubChem等数据库得到差异表达代谢物的代谢通路信息.
3 结果与分析
3.1 总离子流色谱图
如总离子流色谱图所示,鲜菌草工厂化栽培银耳三个不同生长期培养基中共检测到1004个峰,对质谱数据进行预处理后获得737个代谢特征峰,表明鲜菌草工厂化栽培银耳三个不同生长期的代谢物明显不同(图2).

图2 三个生长期样品GC-TOF-MS 总离子流图Fig.2 GC-TOF-MS total ion current from 3 stages of samples
3.2 主成分分析(PCA)
不同生长期的原基处的代谢组主成分分析结果如图3,反映了组内和组间的变异度,提高筛选差异代谢物的可靠性.图中每个点代表一个样品,不同颜色代表不同组别,两种颜色符号的离散程度代表了两组样本在PC1和PC2轴上的分布趋势,两种颜色符号的离散程度越大,表明对应样品的代谢差异越明显.不同生长期的样品分别落在自己的置信区间,位于图中的左右两侧,表明不同生长期样品的代谢差异较大,组内样品差异较小,表明同一生长期重复性好.

图3 三个不同生长期样品的PCA得分图
3.3 偏最小二乘法判别分析(PLS-DA)
为更大程度反应组别之间的差异和挖掘代谢信息,采用偏最小二乘法判别分析法(Partial least squares discrimination analysis, PLS-DA)对数据进行分析,计算变量重要投影度(Variable Importance in the Projection, VIP),通过VIP值的大小来衡量不同的代谢物对不同样品影响大小和解释能力.结果如图4所示,横坐标代表第一主成分得分,纵坐标代表正交主成分得分,从PLS-DA得分表明,不同组别之间都得到了很好的区分,验证了不同生长期存在着显著差异,样本全部都处95%置信区间内,可信度高.

图4 三个不同生长期样品的PLS-DA得分图
3.4 正交偏最小二乘法判别分析(OPLS-DA)
OPLS-DA比PLS-DA多一步正交换算,把模型分类不相关的信息过滤掉,以便最大化凸显模型组别之间的差异, OPLS-DA的解释能力更强.如图5所示,横坐标代表主要成分的得分值(Tp)主要反应组间的差异,纵坐标代表主要成分的正交得分值(TO)主要反映组内样品间的差异.结果显示组内间差异较小,组间即不同生长期差异明显.

图5 三个不同生长期样品的OPLS-DA得分图
3.5 代谢物质相对含量计算以及差异代谢物筛选
3.5.1 内标参照与质量控制 样本中检测到物质的相对含量值以内标物质的质谱峰面积作为参照计算而来,内标物质为L-2-氯苯丙氨酸溶液.如表1,一方面通过内标物质的响应情况判定检测仪器的稳定状况,在质谱上机过程中,共检测10例样本,其中第1例和第10例为重复样本,以重复样本中内标的稳定性判断检测过程中是否有系统偏差,内标在重复样品中峰面积相对标准偏差(RSD)≤10%,说明仪器数据采集稳定,本次检测结果为RSD值为1.07%,说明系统十分稳定;另一方面以内标物质作为后续样本中物质的相对定量参照,以内标物质的质谱峰面积作为参照,对质谱检测得到的下机数据质谱峰进行过滤,保留缺失值在实际样本中< 80%的峰值;对保留下来数据的缺失值进行最小值二分之一填补;然后利用每个样本的总离子流及内标物质的峰面积值进行数据归一化处理,得到各个检测物质的相对含量值.

表1 内标参照及响应
3.5.2 代谢物贡献值评价和差异代谢物筛选 采用PLS-DA模型第一主成分的变量投影重要度(VIP)的大小来评价代谢物对模型的贡献值,VIP>1表明数据对模型的贡献值高,差异性大,结合t检验中的P值,P<0.05说明对模型的贡献值大.G2与G1共有426种代谢物差异,其中263种物质呈现代谢下调,163种物质呈现代谢上调,另有163种物质没有明显变化.G3与G2共有423种差异代谢物,其中185种物质呈现代谢下调,238种物质呈现代谢上调,另有256种物质没有明显变化.G3与G1 共466种差异代谢物,其中242种物质呈现代谢下调,204种物质呈现代谢上调,另有207种物质没有明显差异.根据FC的大小筛选得到三个不同生长期的代表性物质,如表2~4所示.

表2 G2与G1差异代谢物分析

表3 G3与G1差异代谢物分析

表4 G3 与 G2差异代谢物分析
3.6 代谢通路分析
为了进一步解释差异代谢物在银耳生长过程中可能的生物学功能,对已经筛选得到的差异代谢物进行代谢通路分析.显著差异代谢物的路径分析气泡图如图6所示,结果表明,三个不同生长期代谢差异主要集中在脂肪酸合成,乙醛酸和二羧酸代谢及柠檬酸循环(TCA循环)这三个代谢途径,在银耳生长的三个不同生长期存在明显的差异,除去这三个途径外,G2与G1在不饱和脂肪酸合成途径存在明显差异,这可能与银耳菌丝二种形态的转变有密切的关系;G3与G2在丙氨酸、天冬氨酸和谷氨酸代谢途径存在差异,这可能与后期自身生长需要大量蛋白质和酶有密切关系;G3与G1甘油酯代谢存在明显差异.
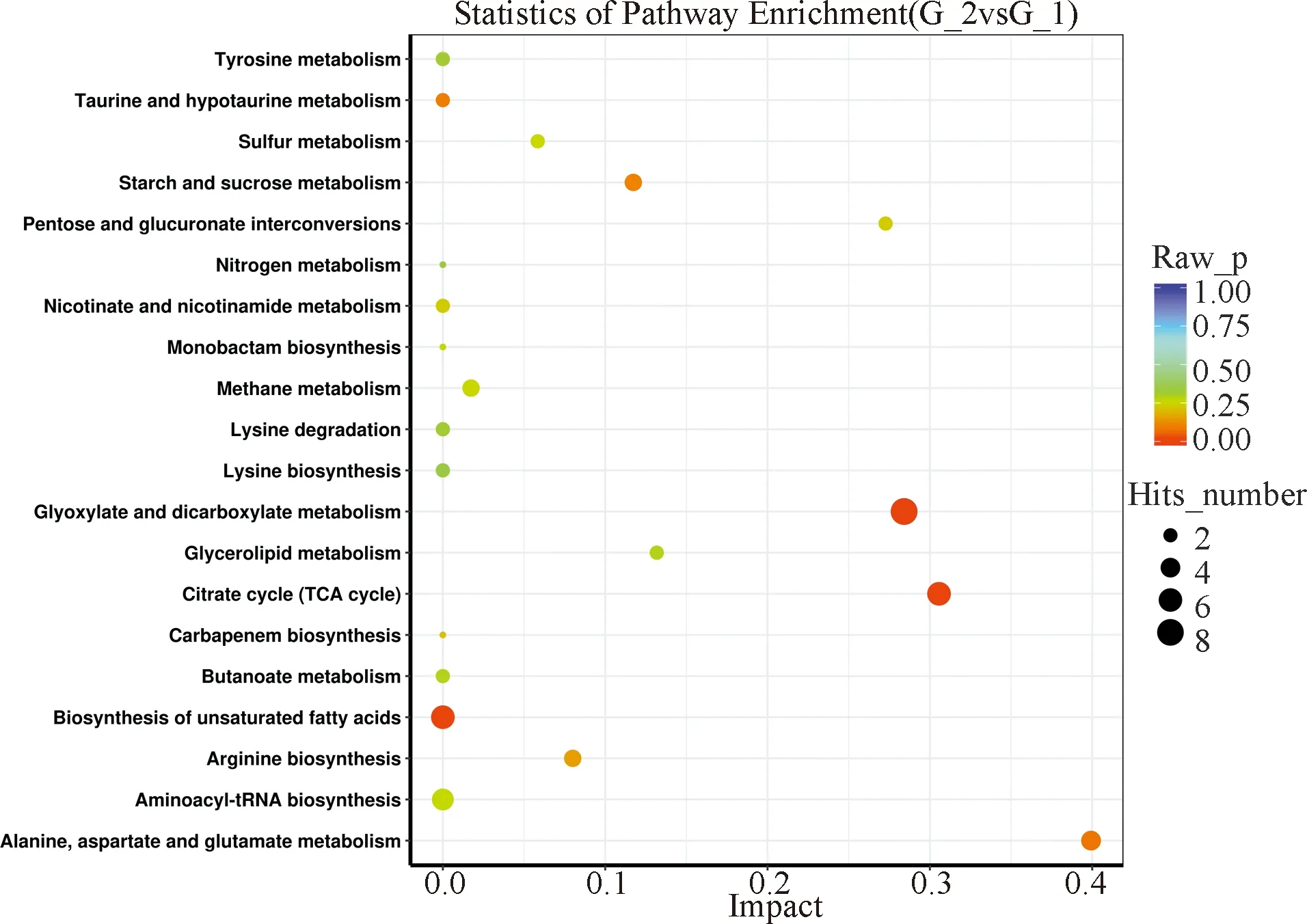
图6 显著差异代谢物的路径富集分析气泡图Fig.6 Bubble map of path enrichment analysis of Significant differences in metabolites
4 讨 论
在鲜菌草工厂栽培银耳过程中,菌丝生长期G1(接种后12 d)、原基分化期G2(接种后24 d )和子实体生长期G3(接种后36 d )是银耳栽培和生长发育的具有代表性的阶段,代表从营养生长到生殖生长的全过程,三个不同生长期的原基处代谢物质存在明显的差异,通过对三个生长期两两对比筛选,G2比G1观察到426个显著差异代谢物特征峰;G3比G2共发现423个显著差异代谢物特征峰; G3比G1共有466个显著差异代谢物特征峰.其中G2期与G1期的糖类(蔗糖、麦芽糖和海藻糖等)相对于G3期代谢上调,表明银耳在前期原基形成和子实体生长中需要大量的糖类物质供给,这也可能与银耳菌丝可利用单糖和双糖等简单的糖类作为主要的碳源,不能直接利用多糖和淀粉等大分子物质有关[1].G3期与G 1期在脂肪类、萜类等挥发性物质含量增加,表现出代谢上调,间接表明银耳子实体内的萜类、芳香类物质的合成主要集中在子实体生长后期.
对差异代谢物进一步筛选和进行代谢通路进行匹配,发现三个不同生长期的差异途径主要集中在脂肪酸合成,乙醛酸和二羧酸代谢及柠檬酸循环(TCA循环),其中脂肪酸代谢对维持细胞膜的完整结构[16]、为菌丝生长提供能量[17]和调节脂质代谢[18]有重要的作用;乙醛酸和二羧酸代谢是糖类物质和脂类物质的转化有重要的作用;柠檬酸循环在代谢中有核心的作用,糖类,氨基酸和脂肪都是柠檬酸循环的中间体[19-20],并且可为呼吸链提供还原当量[21],说明这三个代谢途径在原基处为原基的形成和子实体生长提供重要的代谢物质.除这三个途径外G2与G1在不饱和脂肪酸合成途径存在明显差异,这可能与银耳原基形成需有着密切的关系;G3与G2在丙氨酸、天冬氨酸和谷氨酸代谢途径存在差异,氨基酸类物质代谢的增加,伴随着氨基酸多肽的大量形成,以便合成蛋白质和酶提供给银耳子实体的生长;G3与G1甘油酯代谢存在明显差异,这与后期子实体生长需要大量的胶状物质有密切的关系.
