腹膜透析相关的混合菌感染的发生和治疗失败的危险因素
——814 例多中心回顾性研究
2021-10-14刘美君杨立明朱学研张晓暄庄小花白晓莹周文华崔文鹏
刘美君,杨立明,朱学研,张晓暄,张 禹,庄小花,白晓莹,周文华,罗 萍,崔文鹏
1吉林大学第二医院肾病内科,吉林 长春 130041;2吉林大学第一医院二部肾病内科,吉林 长春 130031;3吉林市中心医院肾病内科,吉林 吉林 132011;4吉林省一汽总医院肾病内科,吉林 长春130011
腹膜透析(PD)是终末期肾脏病患者主要的肾脏替代治疗方法之一,腹膜透析相关性腹膜炎(PDAP)是当前导致患者退出PD治疗的重要原因。PDAP大多为单一致病菌感染,仅4.8%~16.0%的PDAP为混合菌感染[1-8]。学者普遍认为,混合菌PDAP患者当次治疗效果不佳,这使得研究混合菌PDAP对减少PD患者的退出具有重要意义。
目前该领域临床研究不多,样本量最大的多中心研究来自澳大利亚,研究发现合并肺部疾病是发生混合菌PDAP的独立危险因素;同时认为混合菌PDAP较单一致病菌PDAP的拔管率与病死率高,以混合真菌感染或混合非假单胞菌属的革兰阴性菌感染的当次治疗结果最差,此外,年龄也被指出是混合菌PDAP当次治疗失败的独立危险因素[2]。另一样本量较大的研究来自中国香港地区,他们发现年龄和合并真菌、厌氧菌或假单胞菌感染是初始治疗效果不佳的独立危险因素,而合并真菌感染是4月内治疗失败的独立危险因素,但该研究并未以单一菌PDAP作为对照组进行对比[5]。近10年仅有两项研究探讨了混合菌PDAP的临床特点与治疗情况[9,10]。西班牙学者发现混合菌PDAP当次治疗结果较差,外科手术探查率高[9]。来自我国上海的研究指出万古霉素联合美罗培南或者头孢哌酮/舒巴坦可以提高混合菌PDAP的治疗有效率[10]。然而,当前研究存在以下局限性:第一,现有研究多为小样本、单中心临床研究[1,3,11],澳大利亚地区与香港地区的研究样本量大,但年代久远[2,5];第二,混合菌感染对PDAP当次治疗结果的影响方面,部分研究仅进行了卡方检验,而未进行多因素校正[1,2,5];为了更好的防治混合菌PDAP,我们开展了本领域近10年样本量最大的多中心临床研究,通过回顾性分析吉林省4家三甲医院的PDAP患者资料,分析混合菌PDAP的致病菌构成与药敏特点,首次利用多因素回归分析的方法明确混合菌感染对当次PDAP治疗结果的影响,并探讨了影响混合菌PDAP发生与当次治疗失败的危险因素。
1 资料和方法
1.1 研究资料
回顾性收集2013年1月1日~2019年12月31日期间,于吉林大学第二医院、吉林大学第一医院二部、吉林市中心医院和吉林省一汽总医院腹膜透析中心随访的PDAP患者。纳入标准:符合2016年国际腹膜透析协会(ISPD)颁布的PDAP诊断标准[12]。排除标准:临床资料不完整;透出液未培养;透出液培养阴性;培养出混合致病菌,但具体菌种不详。根据透出液培养结果分为:混合菌PDAP 组(致病菌大于1 种)和对照组(单一致病菌)。PDAP一旦确诊即给予经验性抗感染治疗,透出液培养阳性者依据药敏结果进行相应药物调整。本研究为回顾性研究,获得吉林大学第二医院伦理委员会的批准(审批编号:2020026)。
1.2 数据收集
基线资料:年龄、性别、透析龄、原发病、伴随疾病、当次PDAP性质(复发、再发、重现、其他)、抗生素治疗天数;实验室指标:PDAP发生时的血白细胞计数、血红蛋白、血白蛋白、血肌酐、估算的肾小球滤过率(eGFR)、第1天腹水白细胞计数;腹透液微生物培养结果、药敏资料;当次PDAP疗效指标:初始治疗有效、治愈、复发、拔管、PDAP相关性死亡。
1.3 相关标准
(1)PDAP:符合2016年国际腹膜透析协会(ISPD)PDAP指南[12],具备以下诊断标准中至少2点:腹痛或腹透液浑浊,伴或不伴发热;透出液白细胞计数>0.1×109/L,多核细胞百分比>50%(留腹≥2 h);透析液微生物培养阳性;(2)治愈:PDAP患者经合理抗感染治疗2~3周后,PDAP的症状完全缓解,透出液转清,且透出液白细胞计数下降至正常水平[13];(3)复发:上一次PDAP痊愈后4周内再次发生的PDAP,致病菌相同,或病原菌培养阴性的PDAP;(4)PDAP相关性死亡:PDAP发生30 d内的死亡[14];(5)治疗失败:PDAP相关性死亡或拔管;(6)初始治疗有效:合理抗感染治疗48~72 h内,患者PDAP症状明显改善,透出液转清,且腹水白细胞计数明显下降,不需要调整治疗方案,或根据培养结果调整为敏感抗生素进行治疗[12];(7)难治性PDAP:规范的抗感染治疗5 d后,PDAP的症状无改善且透出液未转清[12];(8)合并心血管疾病:包括合并冠状粥样硬化心脏病、糖尿病心肌病、高血压性心脏病、先天性心脏病、心肌梗死病史、心衰病史。
1.4 统计学方法
采用SPSS26.0统计软件进行数据分析。符合正态分布的计量资料以均数±标准差表示,组间比较采用t检验;不符合正态分布的计量资料以中位数和四分位间距表示,组间比较采用秩和检验;计数资料以频数或百分比表示,组间比较采用卡方检验或Fisher确切概率法。采用多因素Logistic回归模型分析混合菌对当次PDAP疗效的影响,发生混合菌PDAP的危险因素,以及影响混合菌PDAP治疗失败的危险因素。P<0.05(双侧)为差异有统计学意义。
2 结果
2.1 混合菌PDAP占全部PDAP中的比例及年代变化
从2013 年1 月1 日~2019 年12 月31 日期间,4 家PD中心共发生1085例次PDAP。其中,82例次混合菌PDAP 占PDAP 总发生次数的7.6%,并且这一比例由2013~2016年的5.3%,上升至2017~2019年的9.4%(P=0.012)。按排除标准进一步筛选后,最终纳入814例次PDAP。后者根据腹透液培养结果分为混合菌PDAP组(致病菌大于1种),共79例次PDAP;对照组(单一致病菌),共735例次PDAP,纳入患者的筛选流程见图1。

图1 患者纳入流程图Fig.1 Flow chart of patient inclusion.
2.2 混合菌PDAP的致病菌组成
混合菌PDAP组的致病菌组合中,单纯2种及以上革兰阳性菌混合感染22例次(27.8%);单纯2种及以上革兰阴性菌混合感染15例次(19.0%);革兰阳性菌和革兰阴性菌混合感染24例次(30.4%);革兰阳性菌和真菌混合感染9例次(11.4%);革兰阴性菌和真菌混合感染6例次(7.6%);革兰阳性菌、革兰阴性菌和真菌混合感染1例次(1.3%);单纯2种及以上真菌感染2例次(2.5%)。共培养出混合菌PDAP的致病菌166株,具体致病菌构成见表1。

表1 腹透液中培养出的致病菌Tab.1 Pathogenic microorganism cultured from peritoneal dialysate
2.3 混合菌PDAP的临床特点
与对照组相比,混合菌PDAP组患者中老年人(>65岁)占比更高(48.1%vs33.7%,P=0.013),透出液第1天白细胞水平更高(4320.0×106/Lvs2400.0×106/L,P=0.030),难治性PDAP 占比更高(38.0%vs22.0%,P=0.002),抗生素治疗天数更长(13.0 dvs12.0 d,P=0.016),其余指标的差异均无统计学意义。两组患者的临床基本资料见表2。
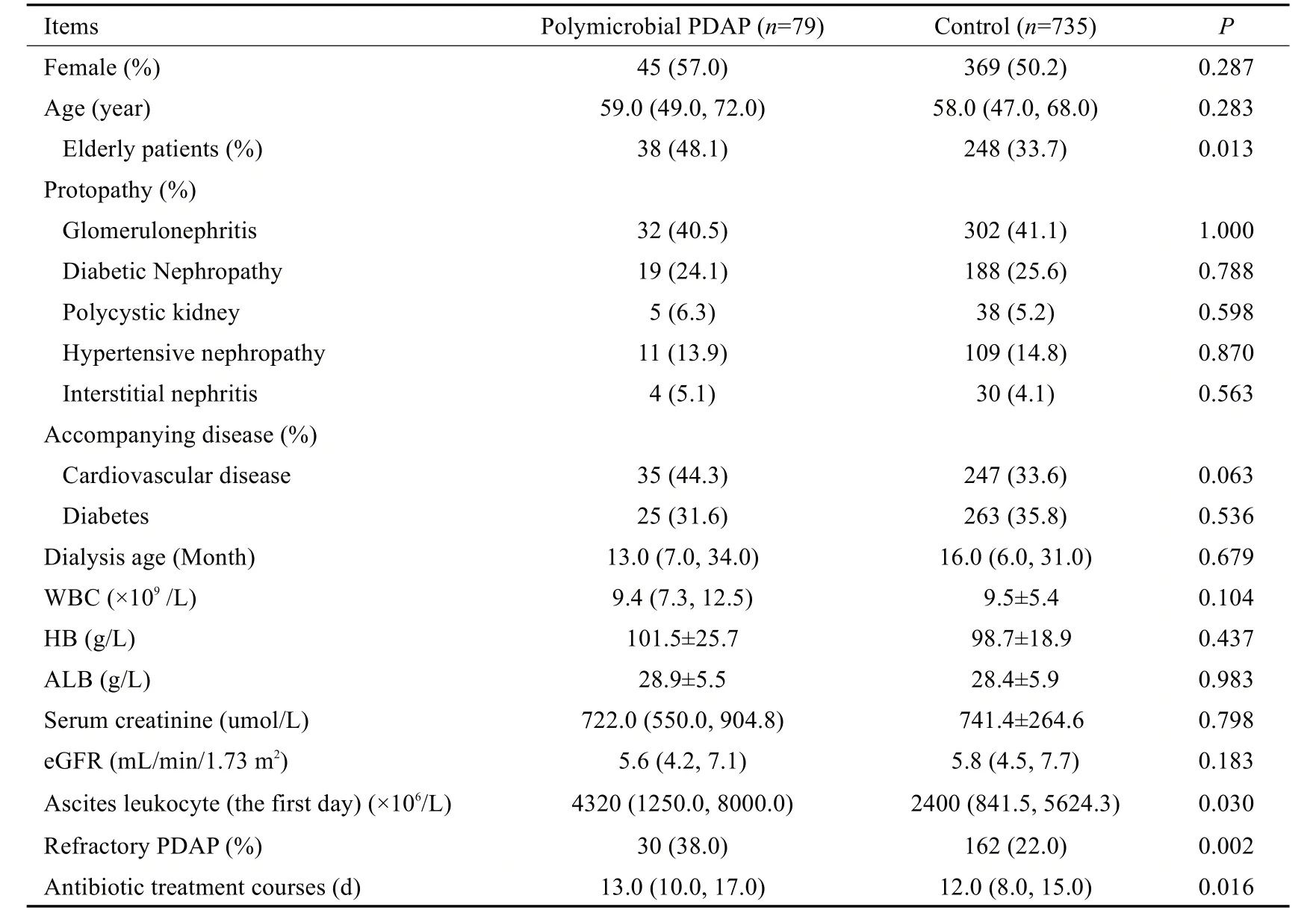
表2 混合菌PDAP与对照组基线资料比较Tab.2 Comparison of the clinical data between the two groups
2.4 混合菌PDAP抗生素敏感性及耐药性分析
分析79例次混合菌感染患者的药敏结果,革兰阳性菌耐药率排名前3 的抗生素分别是克林霉素(55.6%)、青霉素(51.6%)、复方新诺明(44.4%);敏感率排名前3的分别是万古霉素(100%)、利奈唑胺(100%)、利福平(88.2%,图2A)。革兰阴性菌耐药率排名前3的抗生素分别是头孢噻肟(62.5%)、复方新诺明(41.9%)、环丙沙星(30.6%);敏感率排名前3的分别是阿卡米星(90.6%)、美罗培南(88.9%)、哌拉西林(85.3%,图2B);真菌对于米卡芬净(33.3%)、卡泊芬净(33.3%)、阿尼芬净(33.3%)耐药率较高,对两性霉素B(88.9%)、氟康唑(88.9%)、5-氟胞嘧啶(88.9%)、伏立康唑(88.9%)敏感率较高(图2C)。

图2 混合菌PDAP腹水培养微生物常用抗生素的耐药率与敏感率Fig.2 Drug resistance rate and sensitivity rate for common antibiotics of the microorganisms cultured from the ascites of patients with polymicrobial PDAP.A:G+bacteria.B:G-bacteria.C:Fungus.
2.5 两组患者当次治疗结果评价
与对照组相比,混合菌PDAP组患者的初始治疗有效率(72.2%vs78.0%,P=0.241)、治愈率(67.1%vs76.6%,P=0.061)、复发率(2.5%vs8.8%,P=0.052)和PDAP相关性死亡(7.6%vs5.0%,P=0.296)均无统计学差异,而拔管率显著高于对照组(22.8%vs9.5%,P<0.001,图3)。多因素Logistic 回归结果显示,混合菌PDAP组患者拔管和治疗失败(拔管+PDAP相关性死亡)的风险分别是对照组的2.972倍(OR=2.972,95%CI1.634~5.407,P<0.001)和2.692 倍(OR=2.692,95%CI1.578~4.591,P<0.001,图4)。
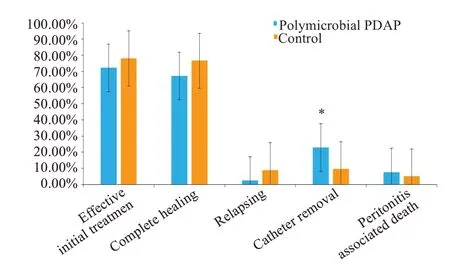
图3 混合菌PDAP与对照组当次治疗情况比较Fig.3 Evaluation of treatment outcomes of peritoneal dialysis-associated peritonitis in the two groups.Compared with the control group,*P<0.001.
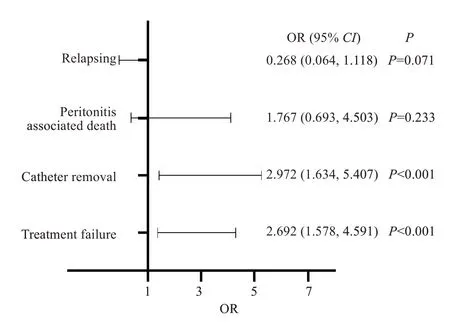
图4 混合菌PDAP对患者当次治疗的影响(多因素logistic 回归分析)Fig.4 Logistic regression analysis of the effect of polymicrobial peritonitis on treatment outcomes of peritoneal dialysisassociated peritonitis.Relapsing was corrected for albumin,age,whether was the First-Recorded Peritonitis Episodes,dialysis age;Peritonitis associated death was adjusted eGFR,with albumin,hemoglobin,age;Catheter removal was adjusted for dialysis age,age,hemoglobin,albumin,whether was the First-Recorded Peritonitis Episodes;Treatment failure was adjusted for dialysis age,whether was the First-Recorded Peritonitis Episodes,albumin,age.
2.6 发生混合菌PDAP的危险因素分析
依次校正混杂因素后,Logistic回归结果显示,老年人(>65岁)发生混合菌PDAP的风险是中青年人的1.937倍(OR=1.937,95%CI1.207~3.109,P=0.006,表3)。
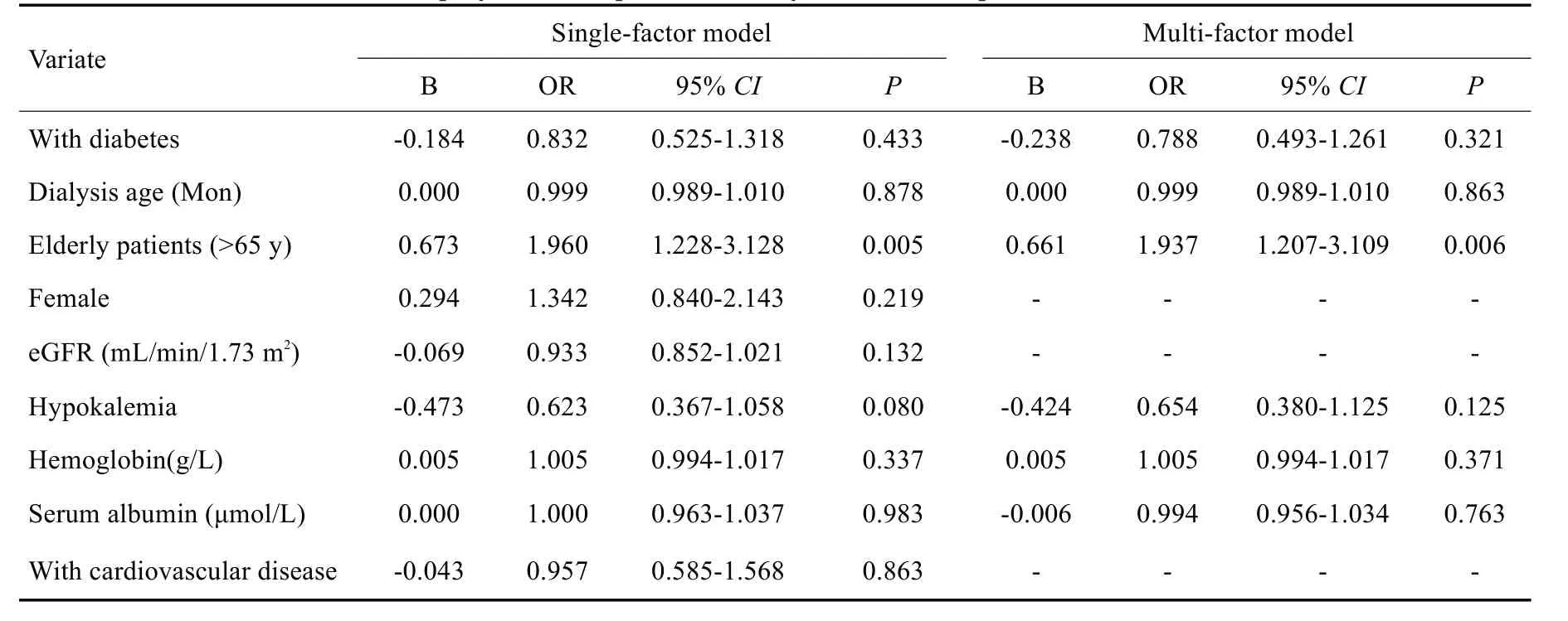
表3 混合菌PDAP发生的危险因素分析Tab.3 Risk factors of occurrence of polymicrobial peritoneal dialysis-associated peritonitis
2.7 混合菌PDAP患者治疗失败的危险因素分析
多因素Logistic回归分析显示,合并糖尿病(OR=5.554,95%CI1.021~30.201,P=0.047)、致病菌类型为混合真菌感染(OR=343.687,95%CI21.554~5480.144,P<0.001)或混合铜绿假单胞菌感染(OR=11.518,95%CI1.632~81.310,P=0.014)分别可使混合菌PDAP患者治疗失败(拔管+PDAP相关性死亡)的风险增加4.554倍、342.687倍、10.518倍(表4)。

表4 混合菌PDAP当次治疗失败的危险因素Tab.4 Risk factors of treatment failure of polymicrobial peritoneal dialysis-associated peritonitis
3 讨论
本研究是近10年围绕混合菌PDAP展开的最大规模的多中心临床研究,旨在研究混合菌PDAP的临床特点以及影响发生和治疗失败的危险因素。我们的结果发现,近3年混合菌PDAP占PDAP总发生次数的比例有所升高。首次发现混合菌感染可使当次PDAP拔管与治疗失败的风险分别增加1.972倍和1.692倍。我们证实了老年人是混合菌PDAP发生的独立危险因素,此外,我们还首次发现合并糖尿病与混合真菌或铜绿假单胞菌感染是混合菌PDAP治疗失败的独立危险因素。
本研究结果显示,混合菌PDAP 的发生占同期PDAP总发生次数的7.6%,与以往研究报道的混合菌在总体PDAP致病菌中的构成比在4.8%~16.0%相似[1-7]。此外,本地区近3年混合菌PDAP占全部PDAP的构成比显著升高,我们分析可能原因是高龄以及长透析龄PD患者逐渐增多,并且临床抗感染疗程长,应用的抗生素抗菌谱更广,而预防性抗真菌药物未规律使用。因此,上述情况应引起我们的重视。
根据中国腹膜透析相关感染防治专家组在2018年对“初始治疗有效率”进行的新定义[13],本研究混合菌PDAP组患者初始治疗有效率低于对照组,虽无统计学差异,但偏低的初始治疗有效率预示早期经验治疗对于混合菌PDAP效果不佳,这可能是由于不同类型的致病菌混合感染所导致。目前国内外报道混合菌PDAP治疗结局的差异较大,研究报道肠源性混合菌PDAP复发率为7.2%[9],Szeto等[5]报道混合菌PDAP的完全治愈率为40.0%,复发率为22.9%[5],而本研究混合菌PDAP的完全治愈率可达67.1%,复发率为2.5%。现有报道[5]的复发率与我们存在明显差异(22.9%vs2.5%),这可能是因为PD为香港地区肾脏替代的首选治疗方案,血液透析次之,因此医生会采用“穷追猛打”的治疗方法尽可能避免腹透导管的拔除[5],但这也增加了复发的概率。与Szeto 等[5]的研究未将混合菌PDAP 与单一致病菌PDAP的治疗结果进行对比不同,另有研究则发现,混合菌PDAP组患者的拔管率为43.2%,显著高于单一致病菌PDAP组的19.2%[2],这与Holley等[11]研究结果相似。本研究同样发现,与单一致病菌PDAP相比,混合菌PDAP的拔管率更高(22.8%vs9.5%)。进一步分析拔管事件发现,我们的拔管率低于10年前澳大利亚与20年前芝加哥的报道[1,2],而与20年前香港地区的报道相似[5],这可能与不同地域PDAP的治疗策略不同有关,此外近年抗生素的规范化治疗也有效降低了拔管率。值得注意的是,以往研究针对混合菌感染对于当次PDAP治疗结果影响方面仅应用卡方检验进行分析,未校正混杂因素[1,2],因此降低了结果的可靠性。较以往研究不同,本研究首次利用多因素Logistic回归模型校正混杂因素,结果表明混合菌PDAP组患者的拔管与治疗失败的风险分别是对照组的2.972倍和2.692倍,这可能与混合菌PDAP组的整体人群偏老龄化以及多种致病菌混合对抗生素的反应较差有关。
混合菌PDAP的发病机制目前尚不明确,在便秘、腹泻及结肠炎等腹部疾病状态下,肠道细菌可以透过肠壁移位至腹腔导致肠源性细菌腹膜炎的发生,这可能是绝大多数革兰氏阴性混合菌PDAP的原因。一般来讲,革兰氏阳性菌感染主要是由于操作过程不规范所致[11,15,16],而合并真菌感染的混合菌PDAP常被认为与早期的抗生素使用史、免疫抑制状态、糖尿病、营养不良等有关[17-19]。研究认为黑种人更容易发生混合菌PDAP,但这两项研究均未通过多因素分析校正混杂因素[1,11]。Barraclough等[2]通过多因素分析指出,合并肺部疾病是混合菌PDAP发生的独立危险因素。与他们的研究不同,我们的研究发现,老年人(>65岁)是PD人群发生混合菌PDAP的独立危险因素。我们分析造成这种不同的可能原因是,两项研究所选取的对照组不同,Barraclough等[2]选取了未发生PDAP与首次发生单一致病菌PDAP的患者作为对照组,而本研究仅以单一致病菌作为对照组。以往研究表明,老年人是PDAP发生相关的危险因素[20],这是因为与年轻人相比,老年群体的PD患者免疫防御功能较差,营养状况欠佳,并且更容易出现肠道功能紊乱,因此易受到多种致病菌的打击[21];且多数老年人的PD患者需要配偶或者其他人辅助换液操作,其操作规范性与依从性较自我操作的年轻PD患者较差[22]。因此,对于老年PD患者,加强营养,避免肠道功能紊乱,提高换液操作人员的操作水平将有助于减少混合菌感染的可能。
本研究利用多因素Logistic回归分析探讨影响混合菌PDAP当次治疗失败的危险因素,发现合并糖尿病与致病菌混合真菌感染或混合铜绿假单胞菌感染是当次治疗失败的独立危险因素。Htay等[23]的研究发现糖尿病是PDAP相关性死亡的独立危险因素,这可能与糖尿病患者持续微炎症状态、蛋白易丢失及分解增加等原因相关[24,26]。Barraclough等[2]的研究与我们的研究结果既有相似之处,又有不同。他们指出混合菌PDAP中真菌和非假单胞菌革兰氏阴性菌感染可分别导致拔管和PDAP相关性死亡风险增加,而我们则发现与增加治疗失败(拔管+PDAP 相关性死亡)风险密切相关的致病菌是真菌和铜绿假单胞菌,后两者的难治性以及对PDAP治疗结果的不利影响已在以往研究中得到充分证实[27,29]。这一发现提示我们,对于混合有真菌或铜绿假单胞菌的混合菌PDAP,应根据药敏合理选择抗生素,必要时及时拔管,以保护腹膜功能、挽救患者生命。
本研究存在一定的局限性:第一,本研究是回顾性研究,因而可能存在选择偏倚;第二,因发生两种以上致病菌的PDAP例次偏少,本研究未能进一步针对致病菌数量对预后的影响进行探讨。
综上,近3年混合菌PDAP发生率较以往升高,与单一致病菌PDAP相比,混合菌PDAP的当次治疗结果均较差,老年人(>65岁)是发生混合菌PDAP的独立危险因素,合并糖尿病与致病菌混合真菌或铜绿假单胞菌感染是混合菌PDAP当次治疗失败的独立危险因素。总之,混合菌PDAP具有独特的临床特征与治疗转归,应得到足够的关注。
