神经生长因子联合牙髓干细胞可促进大鼠种植体周围骨结合
2021-10-14路晓淼田瑞雪刘姗姗徐锦程
路晓淼,田瑞雪,刘姗姗,徐锦程
蚌埠医学院第一附属医院口腔科,安徽 蚌埠233004
口腔种植是临床常用的治疗手段,种植体的成功植入依赖于种植体周围骨结合的形成。在骨结合形成的过程中,成骨细胞发挥至关重要的作用,由其介导的骨形成能够促进种植体周围的骨组织发生重建[1,2]。但是,受到牙周组织健康状况、种植体植入手术创伤等因素的影响,种植体植入后骨结合的形成耗时较长,也有部分患者无法形成良好的骨结合,最终对种植体植入的治疗效果产生不利影响[3,4]。
近些年,组织工程技术被用于多种牙周疾病的辅助治疗,牙髓干细胞(DPSCs)是从恒牙中分离得到的具有高度增殖活性及分化潜能的一类干细胞,在一定诱导条件下可以向成骨细胞、脂肪细胞、软骨细胞、神经细胞等分化。已有研究报道,DPSCs可用于修复牙髓牙本质复合体、减轻牙周炎的牙周组织破坏、促进种植体周围骨结合的形成[5-8],但上述修复效果受到DPSCs向成骨分化能力的影响,需要联合使用合适的干预手段以促进干细胞的成骨分化。神经生长因子(NGF)是参与神经发育、再生的细胞因子,也在骨代谢、成骨分化中起促进作用[9,10]。近年来有学者证实了神经生长因子联合多种干细胞共同作用促进骨细胞的增殖[11],但是未对其机制进行深入研究。我们课题组前期研究亦发现,NGF能促进兔DPSCS体外增殖、成骨分化[12],但是两者联合作用于种植体骨结合界面的研究未见报道.因此,本实验联合使用NGF与DPSCs来调控种植体周围骨结合,具体分析了联合干预措施促进骨结合的作用及机制,以期更好地帮助加快种植体成骨,指导临床。
1 材料和方法
1.1 实验材料
1.1.1 动物 雄性SD大鼠购自上海吉辉实验动物饲养有限公司、生产许可SCXK(沪)2017-0012。
1.1.2 药品及试剂 NGF、K252a、β-甘油磷酸钠、维生素C、地塞米松、茜素红(Sigma),CD44、CD29、CD45、CD34 抗体(BD),HE 染色试剂盒(上海歌凡生物),RIPA裂解液、BCA蛋白定量试剂盒(上海贝博生物科技公司),OCN、RUNX2抗体(Abcam)。
1.1.3 仪器 细胞培养箱(Thermo),流式细胞仪(BD),显微镜(Nikon),micro-CT仪(Skyscan),凝胶成像系统(Bio-rad)。
1.2 方法
1.2.1 DPSCs的分离及鉴定 处死大鼠并游离下颌骨,在含有青霉素和链霉素的磷酸盐缓冲液中浸泡,分离切牙牙髓组织并充分剪碎,放入3 g/LⅠ型胶原酶消化液中、37 ℃消化90 min,1000 r/min离心15 min后弃去上清、保留沉淀,加入含有10%胎牛血清的培养基重悬、接种在培养皿中,每3 d更换1次培养基,待贴壁细胞融合至80%后用0.25%胰蛋白酶消化并按照1∶3的比例传代,取部分第3 代DPSCs 细胞进行鉴定,孵育CD44、CD29、CD45、CD34 的抗体后在流式细胞仪上检测表达量。
1.2.2 DPSCs的分组及给药 第4代DPSCs接种在培养板内,分为对照组、NGF组、NGF+K252a组,给药方法如下:对照组用不含药物的培养基处理,NGF组用含有100 μg/L NGF 的培养基处理,NGF+K252a 组用含有100 μg/L NGF及100 μg/L K252a的培养基处理。每个处理调节设置4个复孔。
1.2.3 DPSCs的成骨诱导分化及茜素红染色 第4 代DPSCs 调节密度至1×107/L,接种在6 孔板内、每孔3 mL,24 h以后细胞贴壁并弃去培养基。按照1.2.2的分组给药,用0.1 μmol/L地塞米松、10 mmol/L β-甘油磷酸钠、50 mg/L维生素C、10%胎牛血清的成骨诱导培养基配置药物,1次、3 d更换培养基,连续培养3周后进行茜素红染色,在显微镜下观察染色情况并对钙结节进行计数。
1.2.4 动物分组、造模及给药 实验动物随机分为对照组、DPSCs 组、DPSCs+NGF 组、DPSCs+K252a 组、DPSCs+NGF+K252a组,每组各8只,均按照下列方法建立股骨种植模型:腹腔注射10%水合氯醛0.3 mL/kg,麻醉后在右后肢股骨外侧做切口,钝性分离肌肉层、股骨干中段,用骨钻做2 mm×4 mm种植体窝,将1枚种植体稍稍加压放入种植体窝,逐层拉拢缝合切口。DPSCs组、DPSCs+NGF组、DPSCs+K252a组、DPSCs+NGF+K252a组,在放入种植体前,在局部注射密度为1×109/mL的DPSCs 悬液1 mL,对照组注射不含细胞的培养基1 mL;术后当天开始,DPSCs+NGF 组给予2.0 U/kg NGF腹腔注射,DPSCs+K252a组给予100 μg/kg K252a腹腔注射,DPSCs+NGF+K252a组给予2.0 U/kg NGF腹腔注射及100 μg/kg K252a腹腔注射,均为1次/d,连续4周。动物实验已经过伦理审查,批号为[2020]第193号。
1.2.5 种植体周围骨组织micro-CT扫描 大鼠股骨纵轴与micro-CT检查床的移动轴平行,扫描分辨率47 μm、扫描时间14 min,围绕骨痂上下各取50个层面,得到图像后计算骨矿密度(BMD)、骨小梁厚度(Tb.Th)、骨小梁数量(Tb.N)。
1.2.6 种植体周围骨组织HE染色 取出种植体、保留种植体周围骨组织,4%多聚甲醛固定后石蜡包埋、制作病理切片,采用HE染色试剂盒对切片进行染色,按照试剂盒说明书进行操作,显微镜下观察骨小梁结构、新骨组织形态、骨基质排列,拍照记录。
1.2.7 蛋白表达的Western blot 检测 取分组给药的DPSCs 及分组干预后的大鼠种植体周围骨组织,加入RIPA裂解液裂解细胞、提取蛋白,测定蛋白含量后将30 μg 蛋白样本加入SDS-PAGE 进行电泳,而后电转移至PVDF膜,5%脱脂牛奶室温封闭PVDF膜1 h,1∶1000 稀释的RUNX2、OCN 一抗4 ℃孵育PVDF 过夜;次日,洗PVDF 膜3 遍后室温孵育1∶2000 稀释的二抗1 h,再次洗PVDF膜3遍,在凝胶成像系统中显影得到蛋白条带,Image J软件对条带进行灰度值分析,根据灰度值计算蛋白表达量。
1.3 统计学方法
采用SPSS23.0软件录入数据并进行统计分析,计量资料以均数±标准差表示,多组间比较采用单因素方差分析、进一步比较采用SNK-q检验;P<0.05为差异有统计学意义。
2 结果
2.1 DPSCs表面干细胞标志物的检测
经流式细胞仪检测,DPSCs 表面干细胞标志物CD44、CD29的阳性率均在95%以上,造血系统来源细胞表面标志物CD45、CD34阴性表达(图1)。

图1 DPSCs表面CD44、CD29、CD45、CD34表达的流式细胞术检测Fig.1 Flow cytometric detection of stem cell surface biomarkers CD44,CD29,CD45 and CD34 on DPSCs.
2.2 NGF促进DPSCs成骨分化
与对照组比较,NGF组DPSCs成骨诱导分化后的钙结节数量明显增加(P=0.0025),Runx2的表达水平均明显增加(P=0.002)、OCN的表达水平均明显增加(P<0.001);与NGF组比较,NGF+K252a组DPSCs成骨诱导分化后的钙结节数量明显减少(P=0.0253),Runx2的表达水平均明显减少(P=0.003)、OCN的表达水平均明显减少(P=0.0012,图2、图3、表1)。

表1 3组DPSCs钙结节数量及Runx2、OCN表达水平的比较Tab.1 Number of calcium nodules and expression levels of Runx2 and OCN in the DPSCs in the 3 groups(n=4)
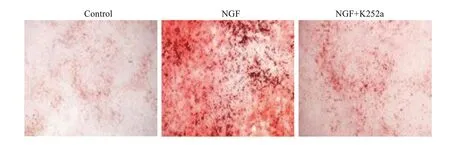
图2 3组DPSCs成骨诱导分化的茜素红染色Fig.2 Alizarin red staining of DPSCs in the 3 groups after osteogenic differentiation (Original magnification:×200).

图3 3组DPSCs中Runx2、OCN的蛋白条带Fig.3 Protein expression levels of Runx2 and OCN in DPSCs in the 3 groups.
2.3 NGF联合DPSCs对大鼠种植体周围骨组织micro-CT的影响
与对照组比较,DPSCs 组种植体周围骨组织的BMD明显增加(P=0.0046)、Tb.Th明显增加(P=0.0396)、Tb.N 均明显增加(P=0.024);DPSCs+NGF 组种植体周围骨组织的BMD 高于DPSCs 组(P=0.0138)、Tb.Th 高于DPSCs 组(P=0.0246)、Tb.N 高于DPSCs 组(P=0.0351);DPSCs+K252a 组种植体周围骨组织的BMD 与DPSCs 组无显著差异(P=0.314)、Tb.Th 与DPSCs组无显著差异(P=0.175)、Tb.N与DPSCs组无显著差异(P=0.269);与DPSCs+NGF 组比较,DPSCs+NGF+K252a 组种植体周围骨组织的BMD 明显减少(P=0.0299)、Tb.Th明显减少(P=0.029)、Tb.N均明显减少(P=0.0186,表2,图4)。

表2 5组大鼠种植体周围骨组织micro-CT参数的比较Tab.2 Micro-CT scanning results of the bone tissues surrounding the implants in the 5 groups(n=8)

图4 5组大鼠种植体周围骨组织micro-CT的图像Fig.4 Micro-CT scanning of bone tissues surrounding the implants in the 5 groups of rats.
2.4 NGF联合DPSCs对种植体周围骨组织HE染色的影响
对照组种植体周围骨组织中骨小梁稀少、纤维骨痂排列散乱;DPSCs组及DPSCs+K252a组植体周围骨组织中骨小梁较多、骨基质排列紧凑;DPSCs+NGF组骨小梁进一步增多、骨基质排列致密且有完整的纤维骨痂形成;DPSCs+NGF+K252a组植体周围骨组织中的骨小梁、骨基质较DPSCs+NGF组减少(图5)。
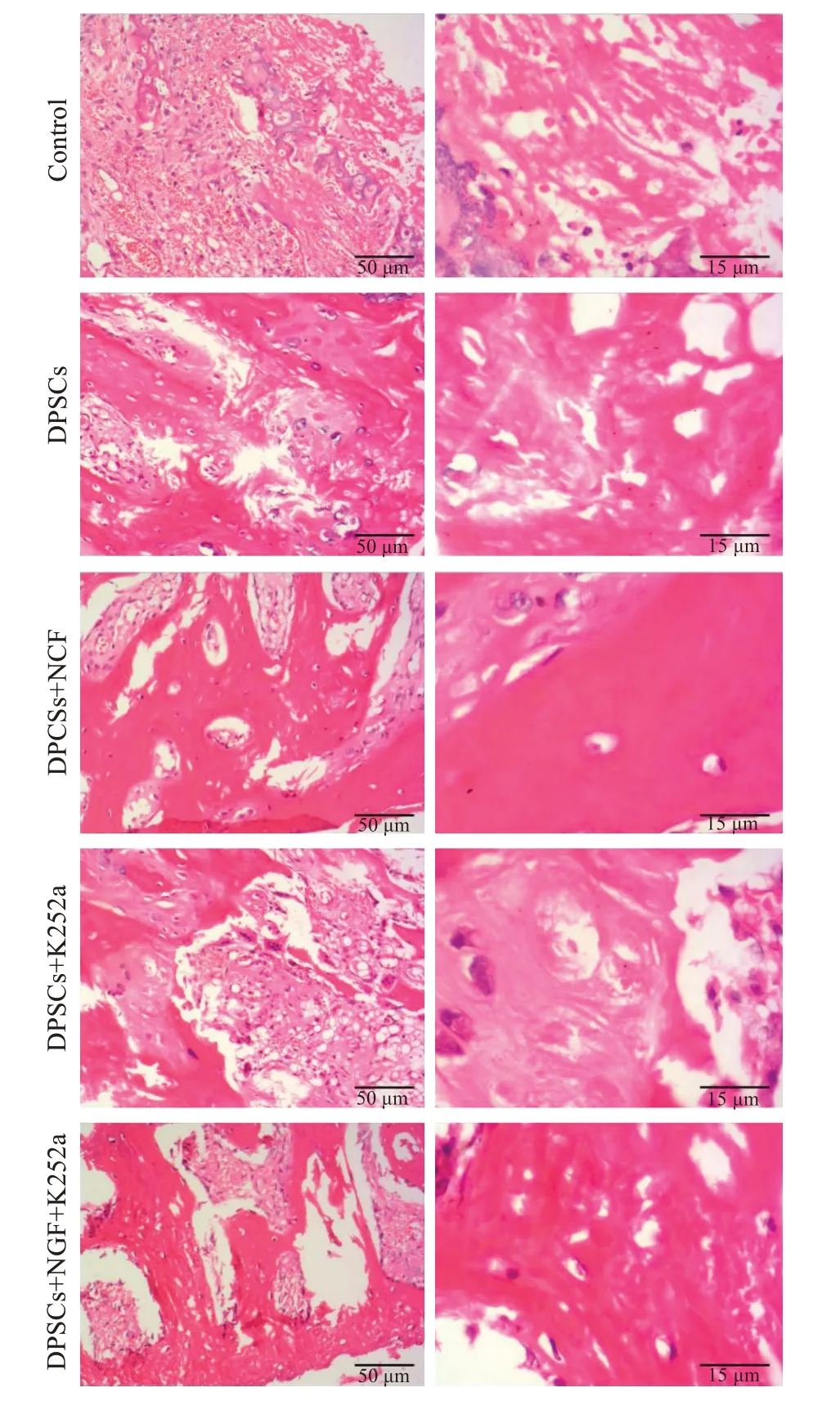
图5 5组大鼠种植体周围骨组织的HE染色Fig.5 HE staining of the bone tissues surrounding the implants in the 5 groups.
2.5 NGF 联合DPSCs 对种植体周围骨组织中Runx2、OCN表达的影响
与对照组比较,DPSCs 组种植体周围骨组织中Runx2的表达水平均明显增加(P=0.003)、OCN的表达水平明显增加(P=0.0259),DPSCs+NGF组种植体周围骨组织中Runx2 的表达水平高于DPSCs 组(P=0.0057)、OCN的表达水平高于DPSCs组(P=0.0166);DPSCs+K252a组种植体周围骨组织中Runx2的表达水平与DPSCs组无显著差异(P=0.061)、OCN的表达水平与DPSCs组无显著差异(P=0.321);与DPSCs+NGF组比较,DPSCs+NGF+K252a 组种植体周围骨组织中Runx2的表达水平明显减少(P=0.0003)、OCN 的表达水平明显减少(P=0.003,图6,表3)。

表3 5组大鼠种植体周围骨组织中Runx2、OCN表达水平的比较Tab.3 Runx2 and OCN levels in the bone tissue around the implants in the 5 groups(n=8)

图6 5组大鼠种植体周围骨组织中Runx2、OCN的蛋白条带Fig.6 Runx2 and OCN expression levels in the bone tissues surrounding the implants in the 5 groups detected by Western blotting.
3 讨论
口腔种植治疗过程中,种植体植入后局部骨组织重建耗时较长、部分患者骨组织重建不良,对种植治疗的效果产生不利影响[13,14]。NGF是近年来新发现的促进骨代谢调控的细胞因子[15]。TrkA是NGF的高亲和力受体,NGF的多种生物学作用均由TrkA介导[16-21]。本实验首先探索NGF对DPSCs成骨分化的影响,结果发现,经成骨诱导分化后DPSCs中的钙结节数目明显增加,DPSCs中成骨标志基因RUNX2及OCN的表达水平也明显增加,这提示NGF能够促进DPSCs的成骨分化。为了验证NGF是否通过TrkA促进DPSCs的成骨分化,TrkA的拮抗剂K252a被用于实验,在NGF干预的同时将K252a后,成骨诱导分化的钙结节数目及RUNX2、OCN的表达水平均减少,表明TrkA拮抗剂K252a逆转了NGF促进DPSCs成骨分化的作用,进而提示NGF通过TrkA促进DPSCs的成骨分化。
DPSCs 促进种植体周围骨缺损修复、种植体周围骨结合的作用已经被多项实验证实[22,23],也有研究报道在DPSCs 移植的同时外源性使用一氧化氮、转化生长因子、脑源性神经营养因子能够增强DPSCs修复种植体周围骨缺损、促进种植体周围骨结合的作用[24-26]。然而DPSCs联合NGF作用于种植体周围的研究未多见,本研究的离体细胞实验结果已经证实NGF能够通过TrkA促进DPSCs成骨分化,在此基础上将NGF联合DPSCs 用于种植体大鼠模型,在建立股骨种植模型中单用DPSCs 或联用DPSCs 及NGF,经micro-CT 检查种植体周围骨组织的重建情况可知,单用DPSCs 或联用DPSCs 及NGF 均能增加BMD、Tb.Th、Tb.N,单用DPSCs 增加种植体周围骨组织骨密度的结果与既往其他研究报道DPSCs 促进种植体周围骨结合的结果一致;在DPSCs 的基础上联用NGF 能够较单用DPSCs 更有效的增加BMD、Tb.Th、Tb.N,表明NGF 能够增强DPSCs 促进种植体周围骨结合的作用,与NGF 在离体细胞中促进DPSCs 成骨分化的作用吻合。
DPSCs移植在种植体周围能够通过自身的成骨分化能力向成骨细胞分化,进而在种植体周围形成骨结合,进而逐步实现种植体周围骨组织的改建[27-30]。在本研究的动物实验中,股骨种植模型大鼠接受DPSCs移植后,在骨组织切片中观察到种植体周围形成小梁状新骨、间质内胶原纤维束状排列,成骨标志基因RUNX2、OCN的表达增多,表明DPSCs向成骨细胞分化、增强了种植体周围骨结合;在DPSCs移植的同时使用NGF,种植体周围小梁状新骨的形成及间质内胶原纤维均增多,成骨标志基因RUNX2、OCN的表达也进一步上调,表明NGF能够增强DPSCs的成骨分化,与micro-CT观察到骨密度增加的结果吻合。在NGF联合DPSCs干预的同时,加用TrkA的拮抗剂K252a后,NGF联合DPSCs增加骨密度、上调RUNX2及OCN表达的作用发生逆转,表明NGF联合DPSCs促进种植体周围骨结合的作用与TrkA有关。
综上所述,NGF 联合DPSCs 能够促进大鼠种植体周围骨结合,增加骨密度、上调成骨标志基因表达,NGF通过TrkA促进DPSCs成骨分化是NGF联合DPSCs 发挥上述作用的可能分子机制。通过此研究,可以验证NGF 结合DPSCs 对种植体周围早期成骨的促进作用,为构建组织工程化种植体提供理论和实验依据,以期缩短种植体骨结合修复的时间,更好地服务临床。
