川芎通过多成分、多靶点、多信号通路和多生物学功能发挥抗肺癌脑转移作用
2021-10-14徐廉松黄富豪张语涵牛雯雯庞金龙李姗姗
徐廉松,黄富豪,张语涵,牛雯雯,庞金龙,李姗姗,李 娴,2,3
1蚌埠医学院,安徽 蚌埠 233030;2中药饮片制造新技术安徽省重点实验室,安徽 亳州 236800;3安徽协和成药业饮片有限公司博士后工作站,安徽 亳州236800
中药川芎是伞形科植物川芎Ligusticum chuanxiong hort的干燥根茎[1],具有活血行气、祛风止痛的功效,是中医临床治疗脑病常用的中药之一[2]。现代药理研究表明,川芎具有保护心脑血管[3]、抗肿瘤[4]、抗炎[5]、抗氧化[6]、保护神经系统[7]等作用。有研究者分析了中医治疗脑部肿瘤的用药规律,结果发现川芎具有很高的使用频率[8]。然而目前缺乏从细胞及分子水平系统地阐述川芎治疗肺癌脑转移的作用机制及物质基础。
本研究以肺癌脑转移为切入点,通过网络药理学方法构建“活性成分-靶标-通路-疾病”网络图,探讨川芎治疗肺癌脑转移的潜在靶点、活性组分、信号通路及生物学过程,并结合分子对接技术,进一步验证筛选出的活性成分与其靶点蛋白的亲和性,以期为川芎治疗脑部肿瘤的作用机制研究提供参考和借鉴。
1 材料和方法
1.1 筛选川芎的活性成分
利用TCMSP数据库检索川芎的化学成分。根据药代动力学原理,以药物口服生物利用度(OB)≥30%、药物相似性(DL)≥0.05和血脑屏障≥-0.3为条件,筛选川芎的活性成分。
1.2 预测川芎活性成分的靶点
基于TCMSP数据库平台所预测的成分靶点,并提取相应成分的靶点,命名为“target.txt”,借助Uniprot数据库(http://www.uniprot.org/)官方命名,将靶点的全称转换为简称,并删除无对应基因名的靶点,得到基因注释文件“targetSymbol.txt”。
1.3 筛选肺癌脑转移的疾病靶点
利用GeneCards(http://www.genecards.org/)数据库,以“lung cancer brain metastasis”为关键词检索,以相关性打分(Relevance score)≥10为筛选条件,得到疾病相关的基因文件“Disease.txt”。
1.4 获得药物靶点与疾病靶点的交集基因
将1.2项得出的药物靶点和1.3项得到的疾病靶点构建交集后,获得川芎与肺癌脑转移疾病的交集靶点文件“Drug-Disease”,即川芎治疗肺癌脑转移的潜在作用靶点。
1.5 构建“成分-靶点-疾病”的网络
将1.4 项得出的药物与疾病的交集基因输入Cytoscape3.7.1软件中,构建“成分-靶点-疾病”可视化网络图,利用cytoNCA插件对网络图节点进行分析,同时输出type文件,标注每个节点的属性是药物、疾病或者有效成分、靶基因等,其中标注为分子属性的有效成分将输出为mollistLists文件,即为川芎治疗肺癌脑转移的有效成分。
1.6 构建与分析蛋白互作作用(PPI)网络
将1.4项得到的药物-疾病交集靶基因文件“Drug-Disease”数据导入STRING(http://string-db.org/),设定物(organism)条件为人(homo sapiens),选combine score ≥0.4的数据,完整构建PPI网络模型。根据网络中基因与邻接基因的数目,找出网络中的核心基因。
1.7 GO富集分析和KEGG通路富集分析
将1.1项获得的川芎活性成分和1.6项获得的核心靶点,利用RX64.4.0.3 软件计算及相关脚本运行后,得出GO 富集分析和KEGG 通路富集分析,筛选条件为P<0.05。同样以P<0.05得到的KEGG通路被认为是最重要的信号通路。
1.8 分子对接
从PubChem 数据库(http://pubchem.nc-bi.nih.gov/)下载川芎中潜在活性成分的小分子配体2D结构,通过ChemOffice 软件将2D结构转化为3D结构,利用pymol去除蛋白结构的水分子及小分子配体,并导入AutoDockTools 进行加氢等预处理。将受体和配体进行分子对接,分析其结和活性。
1.9 细胞体外实验验证
1.9.1 药品及试剂 川芎饮片(安徽协和成药业饮片有限公司),经蚌埠医学院李红梅副教授鉴定为伞形科藁本属植物川芎Ligusticum ChuanXiong Hort的干燥根茎。川芎水提物:称取川芎饮片60 g,加300 g的水,浸泡30 min后,冷凝回流提取2次,第1次35 min,第2次30 min。合并两次提取液,过滤。冷冻干燥将药液浓缩到含生药0.2 g/mL,4 ℃冰箱内存放备用。RPMI 1640培养基、PBS(武汉赛维尔科技有限公司);胎牛血清(浙江天杭生物有限公司);胰酶细胞消化液、青霉素-链霉素(北京Labgic有限公司)。
1.9.2 细胞培养及处理 人肺腺癌细胞PC9(广州赛库生物有限公司)。PC9 细胞培养于含有10%胎牛血清和青霉素-链霉素的RPMI 1640培养基中,置于37 ℃、5%CO2饱和湿度的恒温培养箱中。
1.9.3 Western blot检测 将处于对数生长期的PC9细胞接种于10 cm培养皿,川芎处理(0、100、1000 μmol/L)24 h后,将细胞刮下,转移至离心管内,2500 r/min条件下离心10 min,收集蛋白样品后进行蛋白定量。将配平的蛋白样品在95 ℃条件下水浴5 min后进行电泳(80 V,30 min;120 V,2 h)、转膜(200 mA,2 h)。使用脱脂牛奶封闭2 h后,孵育一抗,4 ℃过夜,次日在室温下孵育二抗2 h。ECL显影液浸泡后使用凝胶成像系统获取蛋白条带并用ImageJ软件(NIH,Bethesda,MD,USA)进行分析。
2 结果
2.1 筛选川芎活性成分及预测靶点
通过TCMSP 数据库,以OB≥30%,DL≥0.05,BBB≥-0.3 为筛选条件,得到川芎的48 个活性成分(表1)。同时预测得到川芎成分靶点1357个,经过Perl软件标准化注释并删除重复靶点后得到399个作用靶点。

表1 川芎主要活性成分信息Tab.1 Main active ingredients of Ligusticum Chuanxiong Rhizoma
2.2 预测肺癌脑转移疾病靶点
通过GeneCards(http://www.genecards.org/)数据库,以“lung cancer brain metastasis”进行检索,以相关性打分(Relevance score)≥10为筛选条件,得到肺癌脑转移疾病靶点2432个。
2.3 药物靶点与疾病靶点交集基因
将川芎活性成分的399个作用靶点与肺癌脑转移对应的2432个靶点,删除重复后取二者的交集靶点,共获得出49个交集基因(图1)。
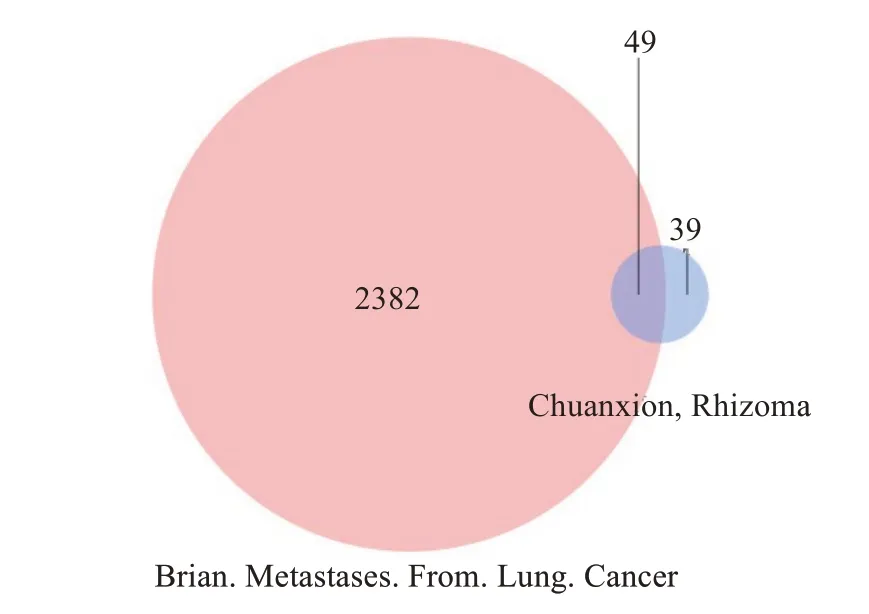
图1 药物活性成分-疾病靶点交集Fig.1 Intersection of active components and disease targets.
2.4 “成分-靶点-疾病”网络
利用Cytoscape 3.7.1 绘制川芎治疗肺癌脑转移的“成分-靶点-疾病”的可视化网络图(图2)。该网络图共包含94个节点,其中活性成分节点43个,靶基因节点49个。通过CytoNCA分析川芎中最主要的前10种活性成分为:油酸(度=25),杨梅酮(度=19),丁苯酞(度=12),2-戊酰基苯甲酸甲酯(度=10),3-正丁烯基苯酞(度=10),4-羟基-3丁基苯酞(度=9),β-细辛脑(度=9),(Z)-藁本内酯(度=9),(-)-壬烯(度=8),洋川芎内酯-E(度=7)(表2)。分析节点度值较高的前20个靶基因(表3),其中,度值分值大于10,间距中心度和紧密中心度均较大,且在网络中与前9种活性成分存在关联的靶点有:前列腺素G/H 合酶2(PTGS2),前列腺素G/H合酶1(PTGS1),胆碱能受体M3型(CHRM3),溶质载体家族6成员2(SLC6A2),维甲酸X受体α(RXRA),肾上腺素能受体β2(ADRB2),核受体辅活化子2(NCOA2),溶质载体家族6成员4(SLC6A4),钠电压门控通道α亚单位5(SCN5A),提示这些基因可能是川芎治疗肺癌脑转移的核心靶点。

表2 川芎度值前10位的活性成分Tab.2 Top 10 active components of Ligusticum Chuanxiong Rhizoma

表3 川芎治疗肺癌脑转移的核心靶点Tab.3 Core targets of Chuanxiong Rhizoma in the treatment of brain metastasis of lung cancer

图2 “成分-靶点-疾病”网络Fig.2 "Component-target-disease"network.Yellow nodes represent the active ingredients of drugs,green square node lattices represent the disease-drug common target gene,pink represents traditional Chinese medicine,purple represents the disease,and black lines represent the interaction between the two nodes.
2.5 PPI 蛋白互作网络和核心基因预测
利用STRING 数据库构建PPI 蛋白互作网络图(图3),网络中共94节点,289条边,图中节点代表基因,两个节点之间的连线代表两个基因之间具有蛋白互作关系,不同的颜色代表不同的证据。蓝色,来自策划数据库;紫色,实验测定;深绿,基因邻接;红色;基因融合;深蓝,基因共现;浅绿,文本挖掘;黑色,共表达;深蓝,蛋白质同源性。运用CytoCNA插件筛选出PPI网络中川芎治疗肺癌脑转移的核心基因按度值排序依次为INS(度值=34),BDNF(度值=27),FOS(度值=27),VEGFA(度值=26),PTGS2(度值=24),ESR1(度值=23),MAPK14(度值=17)等(图4)。

图3 PPI 网络模型Fig.3 PPI network model.

图4 PPI 网络CytoCNA插件分析核心基因Fig.4 Analysis of core genes by PPI network CytoCNA plug-in.A:First screening of core targets in the PPI network map.B:Second screening of the core targets in the PPI network map.C:Final identification of the core targets in the PPI network map.
2.6 GO富集分析和KEGG通路富集分析
经过GO富集分析共得到57条富集结果(图5),其中生物过程0个;细胞组分2个,主要涉及阴阳离子同向转运体、信号转录受体激活性;分子功能55个,主要涉及核受体活性、配体激活、转录因子活性、类固醇激素受体活性、RNA聚合酶II DNA结合转录因子结合、DNA结合转录因子等。
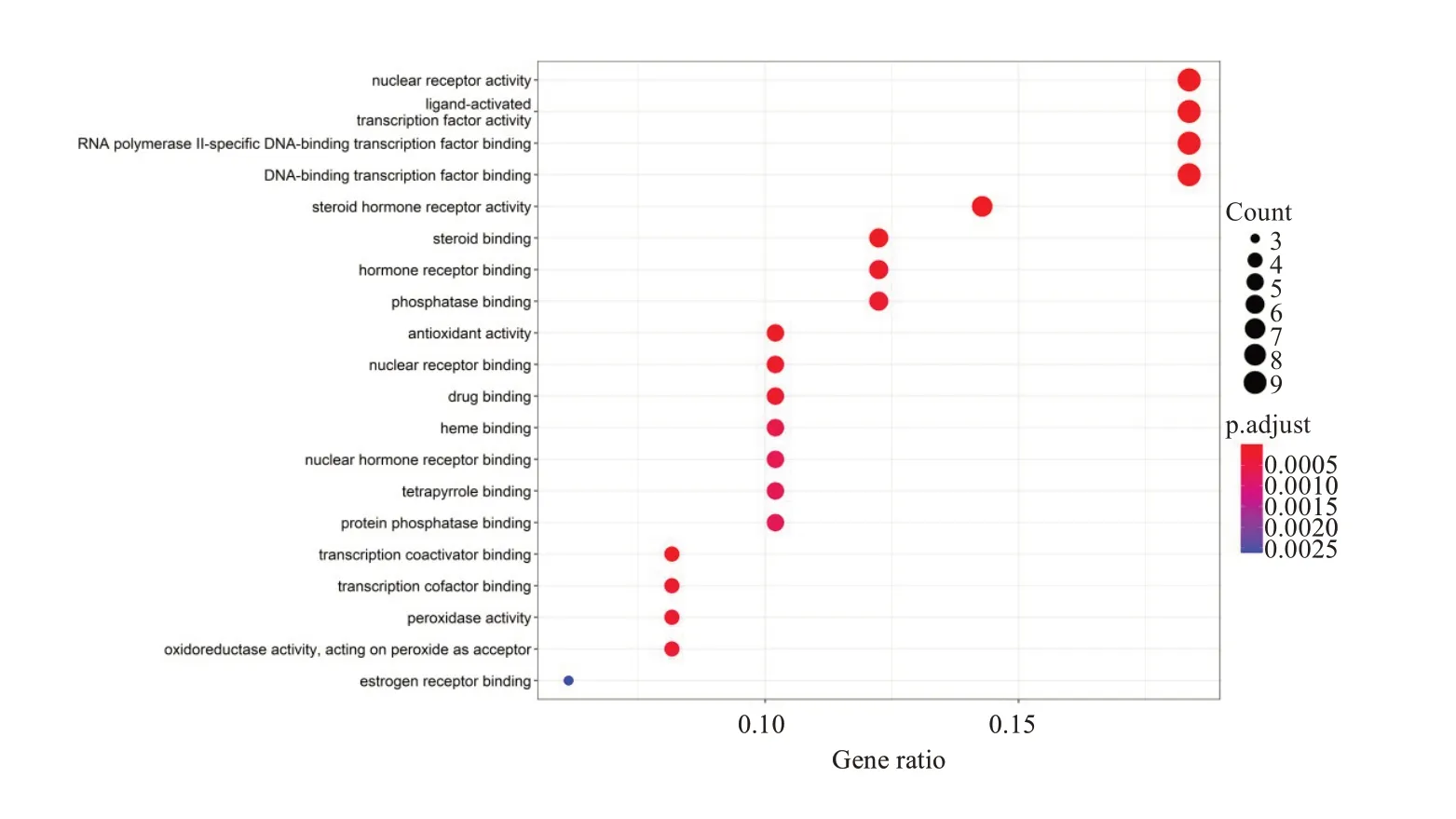
图5 交集靶点GO分析Fig.5 GO analysis of intersection targets.
经过KEGG 富集分析共得到40 条通路富集结果(图6),显示前20条通路,主要涉及催乳素信号通路、乳腺癌、雌激素信号通路、MAPK信号通路、前列腺癌、内分泌抗性、调节脂肪细胞分解、VEGF信号通路、钙信号通路、HIF1信号通路等。提示川芎可能通过以上通路发挥对肺癌脑转移的治疗作用。
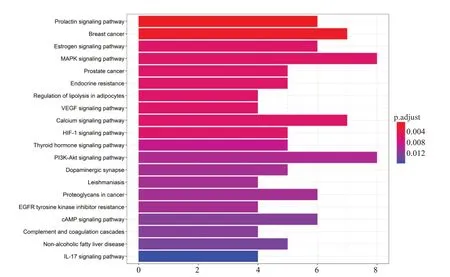
图6 交集靶点KEGG 通路富集分析Fig.6 Enrichment analysis of KEGG pathway.
2.7 分子对接
选取活性化合物中degree≥7的10个核心成分,分别与位于前7位的核心基因INS,BDNF,FOS,VEGFA,PTGS2,ESR1,MAPK14进行分子对接,结果显示分子与靶标蛋白的最低结合能均小于0(表4),说明配体与受体可以自发结合。当结合能≤-5.0 kJ·mol-1,说明分子与靶点对接较好,如BDNF与10个核心成分的结合能均≤-5.0 kJ·mol-1,其中丁苯酞、(Z)-藁本内酯、洋川芎内酯-E结合能分别为-7.7、-8.1、-8.3 kJ·mol-1;FOS与9个核心成分的结合能≤-5.0 kJ·mol-1,其中杨梅酮、4-羟基-3-丁基苯酞的结合能分别为-8.8、-7.8 kJ·mol-1;PTGS2与10个核心成分结合能均≤-5.0 kJ·mol-1,其中杨梅酮、丁苯酞、4-羟基-3-丁基苯酞、(Z)-藁本内酯、洋川芎内酯-E的结合能分别为-8.4、-8.4、-8.0、-7.9、-8.1 kJ·mol-1;MAPK14与9个核心成分结合能均≤-5.0 kJ·mol-1,其中杨梅酮、(Z)-藁本内酯、洋川芎内酯-E 的结合能分别为-7.8、-8.7、-8.5 kJ·mol-1,均展现出良好的结合能力。以(Z)-藁本内酯为例进行展示(图7)。

图7 (Z)-藁本内酯与靶点对接结果Fig.7 (z)-docking results of ligustilide with target.A:(z)-Ligustilide and PTGS2;B:(z)-Ligustilide and MAPK14;C:(z)-Ligustilide and ESR1;D:(z)-Ligustilide and BDNF;E:(z)-Ligustilide and VEGFA;F:(z)-Ligustilide and FOS;G:(z)-Ligustilide and INS.
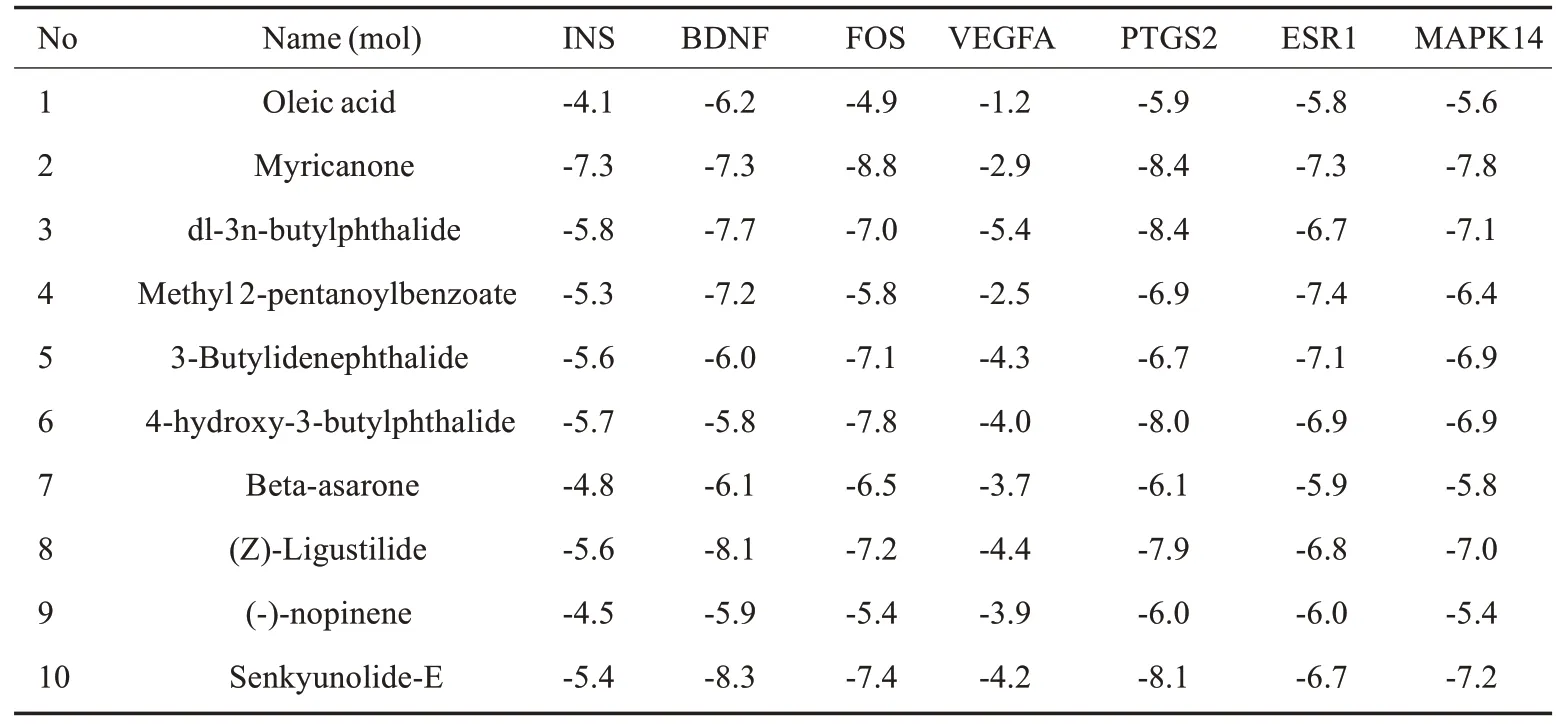
表4 川芎中核心化合物的分子对接Tab.4 Molecular docking of the core compounds in Rhizoma Chuanxiong Rhizoma(kJ·mol-1)
2.8 体外肺癌细胞实验验证
Western blot 显示,川芎处理能显著降低PI3K 和AKT的磷酸化及VEGF水平(P<0.01,图8)。

图8 川芎对人肺癌PC9细胞中PI3K/AKT、VEGF蛋白表达的影响Fig.8 Effect of Chuanxiong on PI3K/AKT and VEGF protein expression in PC9 cells.A:Western blot analysis of the expression of PI3K/AKT and VEGF in PC9 cells after treatment with Chuanxiong (0,100,1000 μmol/L) for 24 h;B:Quantification of the protein expression.*P<0.01,**P<0.001 vs the solvent control group.
3 讨论
本研究筛选出油酸、杨梅酮、丁苯酞、(Z)-藁本内酯等活性成分48个,潜在药物靶点2432个,共涉及40条通路。网络分析发现川芎可能作用于INS,BDNF、FOS、VEGFA、PTGS2、ERS1、MAPK14等关键靶点,涉及催乳素信号通路、雌激素信号通路、MAPK信号通路等关键通路。分子对接结果表明,杨梅酮、丁苯酞、(Z)-藁本内酯与BDNF、FOS、PTGS2、MAPK14等靶点结合良好。体外细胞验证实验结果显示,川芎处理肺癌细胞PC9 后可降低PI3K 及AKT 蛋白磷酸化水平,下调VEGF蛋白表达水平。
杨梅酮具有显著的抗肿瘤活性,通过使A549细胞阻滞在G0/G1 期而影响其细胞周期的调控,并诱导A549 细胞凋亡[9]。研究表明杨梅树皮具有治疗肺腺癌的应用潜力,其中杨梅酮可能是关键有效物质之一[10]。基于前人的研究,猜想杨梅酮在治疗肺癌脑转移中起到关键作用。本研究结果显示,杨梅酮在“疾病-成分-疾病”网络中度值为19,在核心成分度值表中排名第二,并且杨梅酮与PPI网络中的7个核心成分分别对接,结果显示杨梅酮与INS,BDNF,FOS,PTGS2,ESR1,MAPK14对接的最小自由能均小于-7 kJ·mol-1,证明了杨梅酮与疾病关键基因有较强亲和力,在治疗肺癌脑转移中起到关键作用。
丁苯酞具有改善脑部血液微循环、减轻由脑部血流再灌注造成的损伤、抑制脑部神经元细胞凋亡、促进神经元细胞恢复、改善脑能量代谢的作用,在治疗脑血管疾病方面具有显著的疗效[11]。这与肺癌细胞进入脑循环后,停留在血流缓慢的毛细血管床,和内皮细胞相互作用并以黏附分子作为媒介穿过内皮细胞,进一步与局部细胞外基质、脑实质细胞相互作用,同时脑组织通过血管内皮因子、血管扩张和血管生成模拟机制帮助转移瘤转移增殖[12]相符合。本研究进一步通过“药物-成分-疾病”网络图筛选出丁苯酞度值为12,在核心成分度值表中排名第三,并且丁苯酞与7个核心基因INS,BDNF,FOS,VEGFA,PTGS2,ESR1,MAPK14 进行分子对接后的最小自由能均小-5 kJ·mol-1。这与前人实验讨论的丁苯酞的治疗肺癌的结果相匹配。
(Z)-藁本内酯可抑制人肺癌A549细胞活力,抑制A549细胞培养上清液中VEGF的表达,通过调控NKKB蛋白表达及应激活化蛋白激酶(JNK)蛋白磷酸化水平、降低Bcl-2/Bax比值而诱导A549细胞凋亡,发挥抗肿瘤作用[13]。有研究报道,在使用高分子右旋糖酐构建的急性兔球结膜微循环障碍模型中,发现藁本内酯对改善微循环有积极作用[14]。本研究显示,在川芎治疗肺癌脑转移的核心成分表中(Z)-藁本内酯的度值为9,排名第8,并且在分子对接结果中(Z)-藁本内酯与6个核心基因INS,BDNF,FOS,PTGS2,ESR1,MAPK14最低自由能均小于-5 kJ·mol-1。这证明(Z)-藁本内酯在治疗肺癌脑转移中有重要作用。
脑源性神经营养因子(BDNF)属于神经营养因子家族成员,广泛分布在海马、纹状体、皮层和杏仁核等部位[15]。BDNF的过度表达可赋予癌细胞生存、侵袭和转移的特性,包括细胞迁移、细胞骨架变形、转移瘤形成、异位附着和瘤内血管生成等[16]。研究显示BDNF在肺癌组织中有显著表达,BDNF 的表达与非小细胞肺癌的发生、侵袭和转移有相关性[17]。BDNF可能促进淋巴结转移,配体BDNF 通过与TrkB 结合来激活细胞内的PI3K-AKT 信号通路,PI3K-AKT 信号通路依靠调控Bcl-2 家庭成员的表达及线粒体凋亡途径参与到失巢凋亡调节中,从而赋予细胞失巢凋亡抑制能力,这一作用给予非小细胞肺癌的癌细胞抑制失巢凋亡的能力[17]。此外,由BDNF激活的PI3K-AKT信号通路会减少释放细胞色素C,相应地作为凋亡终末效应器的Caspase-3和Caspase-7 的活性也会降低[18]。由本文网络药理学和分子对接结果可知,川芎中10种核心成分与BDNF的分子对接结果最小自由能均小于-5 kJ·mol-1,其中洋川芎内酯-(E)与BDNF 的分子对接结果最小自由能为-8.3 kJ·mol-1。这表明川芎作用于BDNF 靶点蛋白,可能通过配体激活,细胞凋亡,细胞程序性死亡的调控等生物途径,提高患者自身免疫力发挥治疗肺癌脑转移的作用。
C-fos在哺乳动物的上皮细胞中异常表达可以引起上皮细胞极性丧失、上皮细胞和类成纤维细胞相互转化、以及细胞向胶原中侵入,C-fos缺陷小鼠化学诱导的乳头状瘤向侵袭性生长的演进过程被破坏,这些现象表明C-fos可以调节肿瘤细胞的侵袭性生长[19]。本研究显示,川芎中有9中核心成分与FOS基因的分子对接结果最小自由能为均小于-5 kJ·mol-1,其中FOS基因与杨梅酮分子对接的最小自由能最小为-8.8 kJ·mol-1。川芎作用于FOS靶点蛋白,可能通过调节转录因子活性,细胞程序性死亡等生物途径,调节肺癌细胞的侵袭作用。
环氧化酶-2(COX2)在肺癌[20]、大肠癌[21,22]、肝癌[23]等多种癌症中过度表达。由COX2催化生成PGE2在肿瘤的发生发展中起着很重要的角色,且COX2可以导致DNA氧化,诱发突变[24]。本研究显示,川芎中有9中核心成分与PTGS2基因的分子对接结果最小自由能为均小于-5 kJ·mol-1,其中PTGE2基因与杨梅酮和丁苯酞分子对接的最小自由能最小为-8.4 kJ·mol-1。这表明川芎作用于PTGS2靶点。
多数肿瘤中,MAPK14 与其他信号通路JNK、ERK、AMPK和PI3K共同参与调控细胞存活或细胞死亡[25-27],不同情况下,MAPK14对肿瘤发生发展的作用不尽相同,既可以促进肿瘤细胞存活又可以诱导肿瘤细胞死亡,同时MAPK14对自噬的调控也是双重作用:一方面,MAPK14长期失活激活AMPK信号通路进而激活自噬[28,29];另一方面,MAPK14可以在转录水平上调控自噬相关基因[30,31]。本研究显示,MAPK14与川芎10种核心成分的分子对接最小自由能均小于-5 kJ·mol-1,其中MAPK14与杨梅酮结合的最小自由能为-7.8 kJ·mol-1。这表明川芎作用于MAPK14靶点蛋白可能通过细胞凋亡,细胞自噬等生物过程,治疗肺癌脑转移。
本研究结果表明,VEGF和PI3K/AKT通路与肺癌脑转移作用密切相关。有研究显示,VEGF是目前发现作用最强的促血管内皮细胞增殖与生成因子之一,可较好的诱导血管新生,无论是在体外培养的肺癌细胞中,还是在肿瘤细胞接种无胸腺裸鼠形成荷瘤裸鼠动物模型的肿瘤细胞中,或是在人体肺癌组织中均有VEGF的高表达[32]。PI3K/AKT通路是目前NSCLC最常见的调控途径之一[33]。研究发现其参与调控了NSCLC增殖、迁移和上皮间质转化[34-37],因此阻断PI3K/AKT信号通路有可能抑制NSCLC的生存途径并诱导其凋亡。本研究最后采用肺癌细胞PC9对其PI3K/AKT和VEGF通路进行体外验证实验,结果验证了川芎对肺癌细胞PC9的PI3K/AKT和VEGF通路有抑制作用。
综上所述,川芎通过多成分、多靶点、多通路相互协调、相互影响以治疗肺癌脑转移,充分体现了中药在治疗疾病的整体性和全面性特点,为后续深入讨论川芎治疗肺癌脑转移的作用机制奠定基础,也为中药治疗疾病的多维度、多层次研究提供新思路。鉴于网络药理和分子对接技术受限于数据库的不全面,不能覆盖所有中药、靶点、通路,还需设计严格的动物实验及临床实验进一步讨论其作用机制。
