ELK3在胃癌中的表达特征和功能分析
2021-10-14周立强辛林
周立强,吴 忧,辛林
南昌大学第二附属医院胃肠外科,江西 南昌330006
胃癌发病率在所有恶性肿瘤中排名第5,死亡率在癌症相关死亡中居第4位[1]。中国是胃癌的高发地区,2020 年中国胃癌新发病例和死亡病例分别占全球62.3%和51.4%[1]。胃癌临床表现无显著特异性,与非恶性消化道疾病表现类似,起病隐匿、进展迅速、早诊困难,确诊时多处于中晚期,使多数病例失去了最佳手术时机[2]。目前国内外研究证实胃癌的病因包括幽门螺杆菌感染、不良饮食习惯、非甾体药物等,但胃癌发生发展的分子生物学机制尚未明确[3]。若能在排除个体差异的基础上发掘重要的生物标志物,将有助于胃癌的早期诊断和治疗。
ELK3(又称Net、SAP-2 或ERP)是ETS 转录因子家族成员之一,定位于染色体12q23.1上。ELK3蛋白常与血清反应辅助蛋白1一起形成三元复合转录因子,其能结合富含嘌呤GGA核心序列的特定DNA序列,调节包括原癌基因在内的多种基因的表达[4]。在基础条件下,ELK3是转录阻遏物,但却可被RAS/ERK信号和丝裂原活化蛋白激酶(MAPK)途径激活而转变为转录激活因子[5,6]。ELK3被证实在乳腺癌、肝癌、肺癌等恶性肿瘤的发生发展中发挥重要作用,并被认为是有效的生物标志物[7-11]。在胃癌中,目前尚无实验研究ELK3在肿瘤中发挥的作用。在本研究中,我们利用多种生物信息学的手段探索ELK3在胃癌中的表达特征及其影响胃癌进展的机制,这有助于ELK3 后续研究提供理论依据。
1 材料和方法
1.1 ELK3的表达特征
从ArrayExpress 数据库(www.ebi.ac.uk/arrayexpress/)下载E-MTAB-6693数据集,并收集与之相关的临床病理信息。首先利用非配对t检验分析ELK3在正常胃组织和胃癌组织临床病理特征间的表达差异。再利用受试者工作特征曲线(ROC)分析ELK3预测胃癌的敏感度,计算最大约登指数(Youden index),确定最佳临界点,据此将ELK3分为高、低表达组,用卡方检验分析ELK3的表达水平与临床病理特征之间的关系。
1.2 ELK3的预后能力
绘制Kaplan-Meier曲线分析ELK3高低表达组之间总体生存率和无病生存率之间的差异。通过计算ROC曲线下面积(AUC)分析ELK3预后的准确性。通过单因素和多因素Cox回归分析排除其他临床性状的条件,确定ELK3是否为胃癌的独立预后因素。
1.3 ELK3转录调控网络的构建
为分析ELK3的靶基因,我们利用Chip-Atlas数据库(http://chip-atlas.org/)[12]、ChipBase数据库(http://rna.sysu.edu.cn/chipbase/index.php)[13]、基因转录调控数据库(GTRD,http://gtrd.biouml.org/)[14]在转录起始位点上下游5000bp 内鉴别ELK3 可能调控的基因。此外,在hTFtarget 数据库(http://bioinfo.life.hust.edu.cn/hTFtarget#!/)[15]的Epigenomic evidence、Chip-seq support和Motif support条件下筛选ELK3的调控基因。利用Draw Venn Diagram 工具(http://bioinformatics.psb.ugent.be/webtools/Venn/)取4 个数据库的交集获得ELK3转录调控靶基因,进一步利用Cytoscape 3.8.1绘制最终得到的转录调控网络。
1.4 基因本体论和京都基因与基因组百科全书富集分析ELK3影响胃癌机制
我们利用“org.Hs.eg.db”R 包进行富集分析,将滤过条件设置为P<0.05 和FDR<0.05,获得的条目使用“enrichplot”和“ggplot2”R包进行可视化。
1.5 ELK3和浸润性免疫细胞的关系
使用cibersort工具计算免疫细胞的相对分数[16],将数据上传到cibersort Web网络工具,设置默认特征矩阵为1000个排列,以计算每个样品中22种浸润性免疫细胞(包括B细胞、T细胞、自然杀伤细胞、巨噬细胞、树突细胞、嗜酸性粒细胞和中性粒细胞)的比例,并分析ELK3的表达与它们的关系,P<0.05为差异具有统计学意义。
1.6 公共数据库验证ELK3的表达
通过基因表达谱分析(GEPIA)网络工具(http://gepia.cancer-pku.cn/),分析结合基因型组织表达数据库和癌症基因组图谱数据库中ELK3在胃癌和正常胃组织的表达差异。为验证ELK3蛋白的表达水平,我们通过人类蛋白图谱(HPA)数据库(www.proteinatlas.org/),搜索ELK3 在正常胃和胃癌组织的免疫组化数据,分析其差异。
1.7 荧光定量RCR检测胃癌中ELK3的mRNA表达
收集5组南昌大学第二附属医院胃肠外科手术标本,样本获取均取得患者知情同意并得到南昌大学第二附属医院伦理委员会批准。制备样品匀浆,使用Trizol(Thermo Fisher)法提取总RNA,获得的RNA使用逆转录试剂盒RR047A(Takara)进行逆转录,以ACTB作为内参基因,使用RR820试剂盒(Takara)在7900-HT系统(Thermo Fisher)进行荧光定量PCR,通过计算ELK3的2-ΔCT值评估其mRNA表达,使用配对t检验分析胃癌及癌旁样本ELK3的表达差异。使用的引物均由上海生工公司合成,序列如下:ACTB上游5'-CACCATTGGC AATGAGCGGTTC-3',下游5'-AGGTCTT TGCGGAT GTCCACGT-3';ELK3 上游5'-GAGAGTGCAATCAC GCTGTG-3',下游5'-GTTCGAGGTCCAGCAGATCA A-3'。
1.8 蛋白印记法检测胃癌中ELK3的蛋白表达
将获得样本匀浆后,使用强效RIPA 裂解液(北京索莱宝公司)提取总蛋白,BCA试剂盒(上海碧云天公司)检测蛋白质浓度后进行SDS-PAGE凝胶电泳,然后将蛋白转至PVDF 膜(Millipore)上。使用含5%脱脂奶粉的TBST封闭液在室温下封闭1 h。将内参和目的条带分离后,分别置于到ELK3(Santa Cruz)和GAPDH(Proteintech)一抗中4 ℃孵育过夜,吸净一抗并清洗后,加入HRP 标记的山羊抗兔IgG 和山羊抗鼠IgG 二抗(北京康为世纪公司)稀释比例为1∶10 000,室温孵育1 h,吸净二抗并清洗。用超敏ECL发光试剂盒(苏州宇恒公司)和化学发光成像系统(BioRad)进行曝光分析。
2 结果
2.1 ELK3高表达与胃癌进展相关
E-MTAB-6693数据集包括46例正常胃组织和691例胃癌组织数据。分析显示,ELK3在胃癌中表达显著高于正常胃组织(P<0.01,图1A)。绘制ROC曲线并计算AUC值为0.6322,显示ELK3预测胃癌具有较良好的敏感性(图1B)。根据计算出最大约登指数(0.2328)所对应的ELK3 表达水平(7.1670),将胃癌样本分为ELK3高表达组(n=470)和低表达组(n=221)。ELK3在不同临床病理特征胃癌组织中的表达分析显示,M1 期ELK3 表达高于M0期(P<0.05,图1C),ELK3的表达随AJCCstage分期进展而升高(P<0.05,图1D);在神经侵袭的样本中ELK3表达高于未侵袭样本(P<0.01,图1E)。我们还分析了ELK3表达与不同临床病理特征的关系,结果显示,ELK3的表达水平与N分期、AJCC分期、Lauren分型、分化程度、病理分型、微卫星状态相关(P<0.05,表1)。
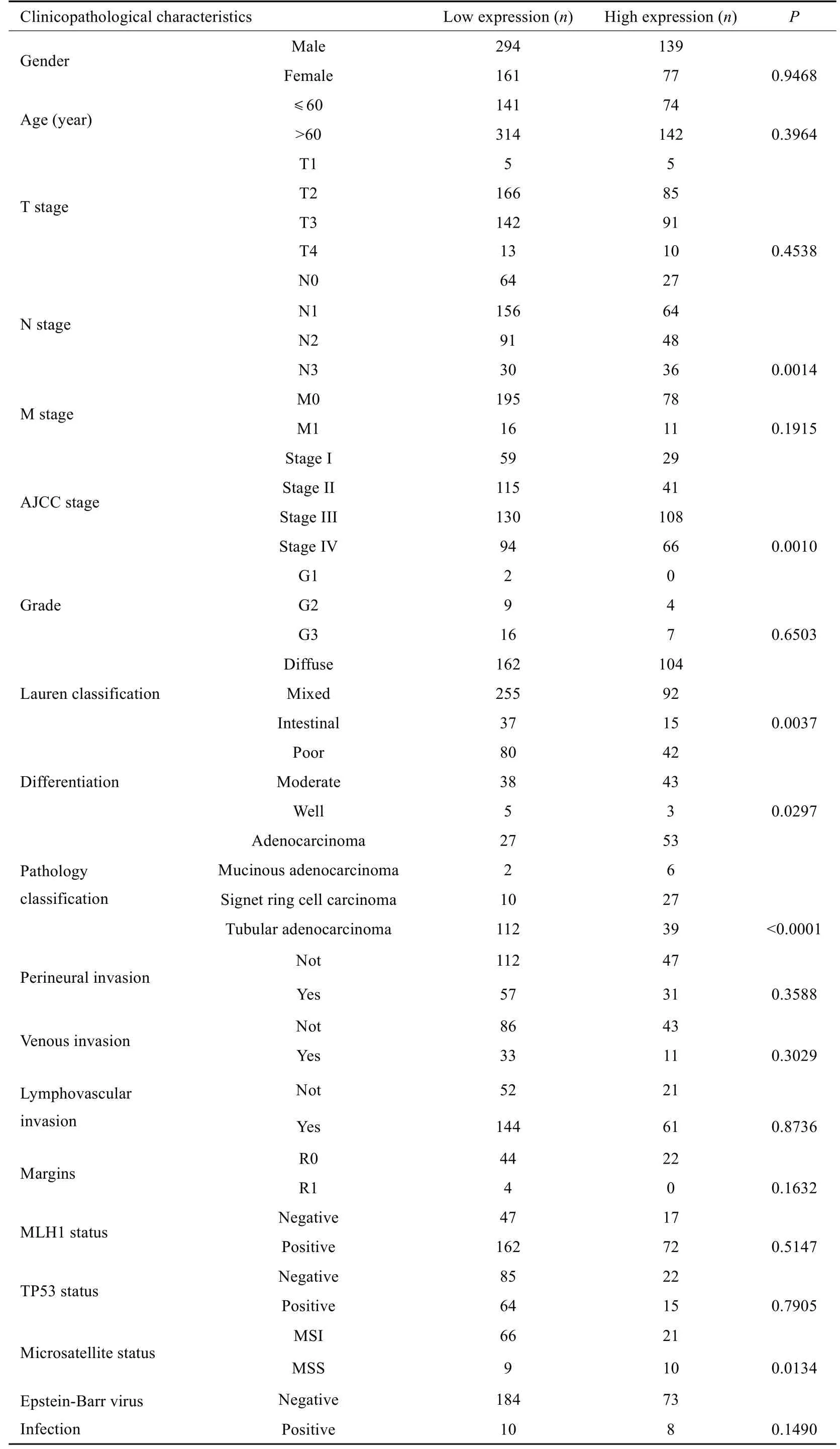
表1 胃癌中ELK3表达与各临床病理特征的关系Tab.1 Relationship between ELK3 expression and clinicopathological characteristics of gastric cancer
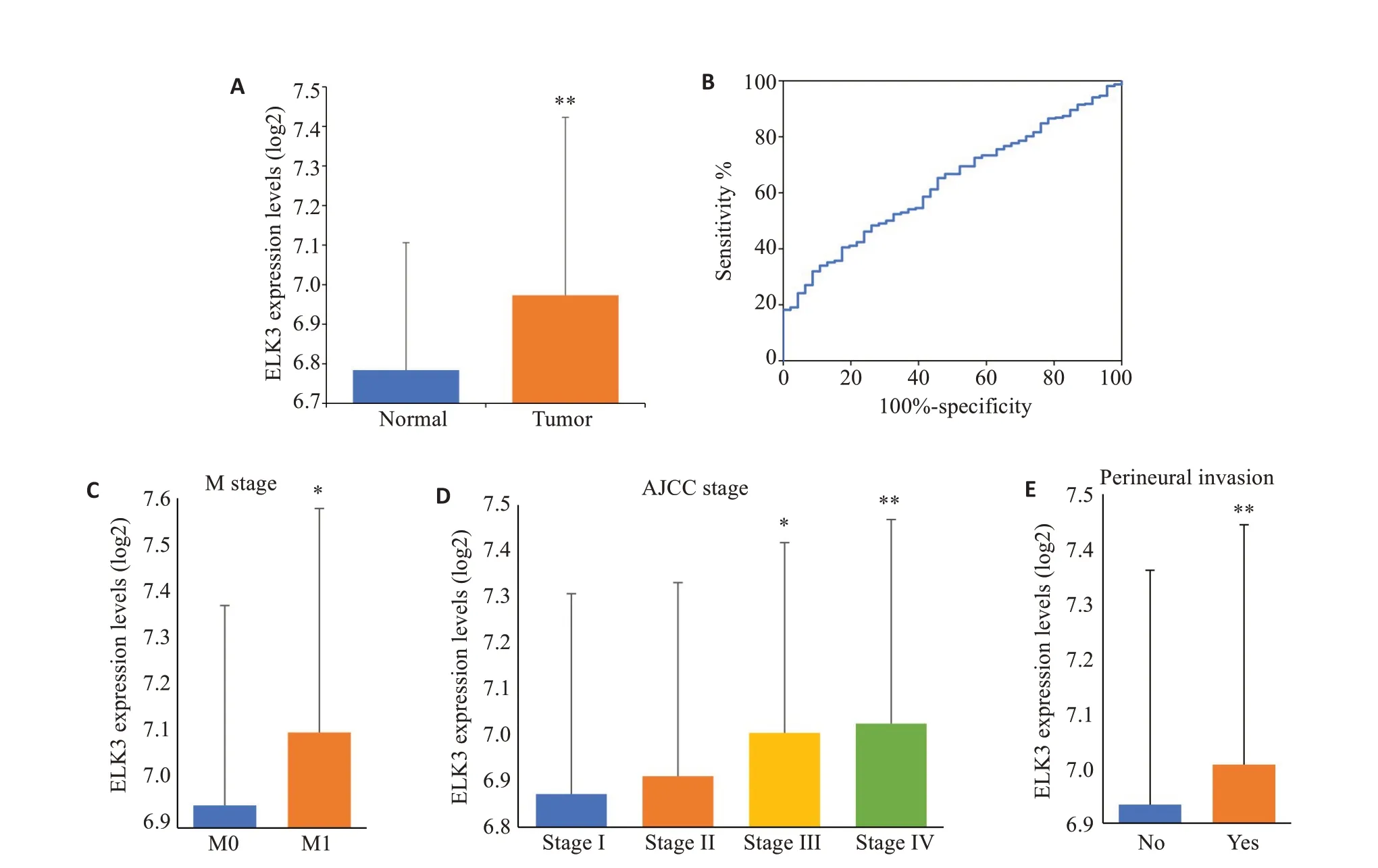
图1 ELK3在胃癌中的表达特征Fig.1 Expression characteristics of ELK3 in gastric cancer.A:ELK3 expression in gastric cancer is higher than normal gastric tissue.B:ROC curve shows that ELK3 can predict the occurrence of gastric cancer.C:The expression of ELK3 in M1 stage was higher than that in M0 stage.Values are presented as Mean±SD(*P<0.05 vs M0).D:The expression of ELK3 increases with pathological stages.Values are presented as Mean±SD(*P<0.05,**P<0.01 vs Stage I).E:Patients with Perineural invasion have higher expression of ELK3.Values are presented as Mean±SD(**P<0.01 vs No).
2.2 ELK3高表达与胃癌患者不良预后相关
Kaplan-Meier曲线显示,ELK3高表达组患者的生存率较低表达组显著降低(P<0.01,图2A),与3年、5年、7 年总生存率对应的AUC 为0.556、0.555、0.571(图2B)。通过单因素和多因素Cox回归分析,最终确定神经侵袭[HR=1.756,95%CI(1.057-2.915),P=0.030]、阳性淋巴结数目[HR=1.059,95%CI(1.023-1.097),P=0.001]、ELK3 表达[HR=1.929,95%CI(1.039-3.580),P=0.037]为独立预测胃癌总体预后的因素(图2C,D)。对于无病生存期,Kaplan-Meier曲线显示(图3A)ELK3高表达组患者的生存率较低表达组显著降低(P<0.05)。ROC曲线显示,与3年、5年、7年总生存率对应的AUC为0.549、0.577、0.619(图3B)。通过单因素和多因素Cox回归分析,静脉侵袭[HR=1.830,95%CI(1.014-3.305),P=0.045]和ELK3 表达[HR=2.555,95%CI(1.332-4.902),P=0.037]为独立预测无病生存期的因素(图3C、D)。

图2 ELK3预测总体预后且为独立预后因素Fig.2 ELK3 predicts overall prognosis and is an independent prognostic factor of gastric cancer.A:Kaplan-Meier curve shows that a high expression of ELK3 is associated with a poor overall prognosis.B:ROC curve analysis of the ability of ELK3 to predict 3-,5-,and 7-year survival.C:Univariate Cox regression analysis.D:Multivariate Cox regression analysis shows that ELK3 is an independent prognostic factor of gastric cancer.
2.3 ELK3转录调控网络及其影响胃癌机制
Chip-Atlas数据库显示,ELK3潜在靶基因有3536个,ChipBase中得到11 166个,GTRD中获得27 740个,hTFtarget中有600个。通过绘制韦恩图提取4个数据库中共有基因(图4A),一共获得176个ELK3潜在的靶基因,并绘制了ELK3转录调控网络(图4B)。进一步利用GO 和KEGG 富集分析ELK3 在胃癌中发挥的功能。我们将GO富集Top10进行了可视化(图5A),其中BP富集在RNA剪接、GTP酶活性调控等条目,CC富集在黏附连接、细胞间黏附等条目,MF集在GTP酶活化、GTP酶结合等条目。KEGG功能富集在胰岛素、雌激素、Ras 相关蛋白1(Rap1)、AMP 依赖的蛋白激酶(AMPK)、松弛素、神经营养因子、趋化因子、血管内皮生长因子(VEGF)、肿瘤坏死因子(TNF)信号相关;值得注意的是,ELK3靶基因还富集在多种病毒感染和肿瘤的细胞程序性死亡配体-1/程序性死亡受体1(PD-L1/PD-1)信号,显示ELK3可能参与肿瘤的免疫应答反应调控(图5B)。
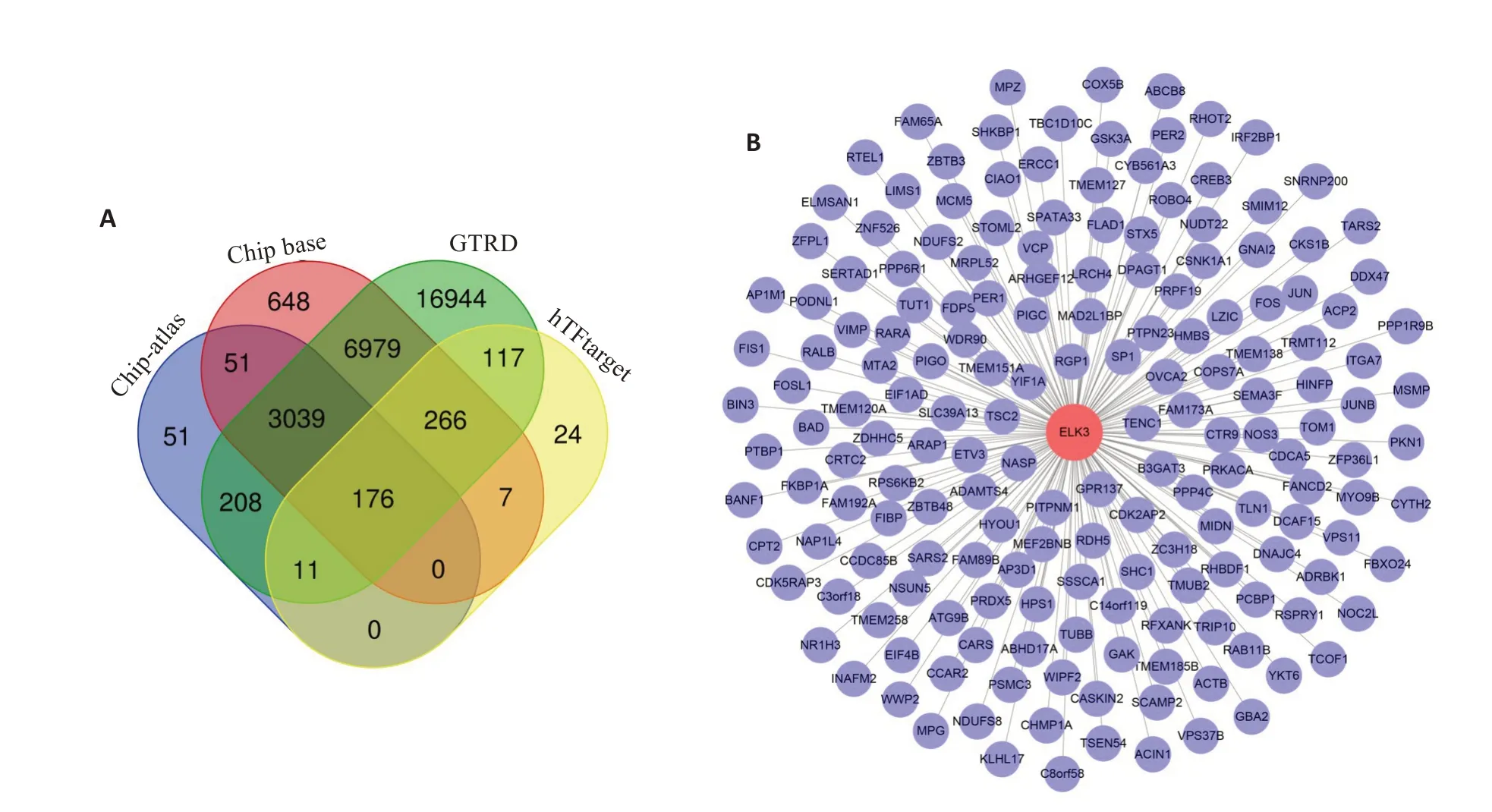
图4 ELK3转录调控网络的构建Fig.4 Construction of ELK3 transcriptional regulation network.A:Venn diagram analysis showing 176 potential target genes of ELK3.B:ELK3 transcriptional regulation network.
2.4 ELK3与浸润性免疫细胞的关系
为了解ELK3在免疫应答反应中的可能作用,我们分析了691例胃癌样本中的浸润性免疫细胞分布,并分析ELK3表达和22种免疫细胞的关系。结果显示,ELK3表达与浆细胞(R=-0.260,P<0.001)、静息NK细胞(R=-0.180,P<0.001)、调节性T 细胞(R=-0.180,P<0.001)、活化树突状细胞(R=-0.110,P<0.01)、滤泡辅助性T 细胞(R=-0.150,P<0.001)和CD8+T细胞(R=-0.085,P<0.05)的数量呈负相关,ELK3 与M2 型巨噬细胞(R=0.100,P<0.01)、幼稚B细胞(R=0.130,P<0.001)、M1型巨噬细胞(R=0.083,P<0.05)、活化CD4+记忆T细胞(R=0.099,P<0.01)、γδT细胞(R=0.260,P<0.001)及幼稚CD4+T细胞(R=0.085,P<0.05)的数量呈正相关(图6)。
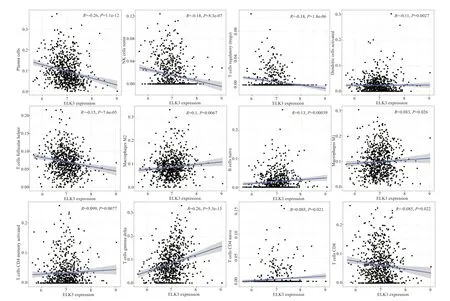
图6 ELK3与浸润性免疫细胞的相关性Fig.6 Correlation between ELK3 and infiltrating immune cells in gastric cancer.
2.5 ELK3的表达验证
在公共数据库中验证ELK3的表达,GEPIA表明,在211个正常胃组织中ELK3的mRNA表达水平显著低于408个胃癌组织(图7A);HPA数据库显示,正常胃组织免疫组化染色显示为未检测到,而胃癌组织种显示低染色(图7B)。随机分析5个配对临床手术样本mRNA表达,结果表明,5对组织中ELK3在胃癌组织的表达均显著高于正常胃黏膜组织(图7C)。免疫蛋白质印记结果也显示,胃癌组织ELK3蛋白表达高于对于正常组织(图7D)。

图7 公共数据库和临床样本中验证ELK3在胃癌中高表达Fig.7 Verification of high ELK3 expression in gastric cancer based on public databases and clinical samples.A:Analysis of GEPIA showing that the RNA level of ELK3 in gastric cancer tissue is increased.B:Analysis of HPA database showing that the protein expression of ELK3 is up-regulated in gastric cancer.C:ELK3 mRNA expression is increased in clinical samples of gastric cancer detected using RT-PCR.D:Western blotting results showing increased ELK3 protein expression in gastric cancer.Values are presented as Mean±SD(*P<0.05,**P<0.01,***P<0.001 vs normal).
3 讨论
ELK3在一些实体肿瘤中过表达,并在肿瘤细胞增殖、凋亡、侵袭、迁移和耐药等生物过程中发挥重要作用[8-10,17,18]。有报道显示ELK3在肿瘤中的低表达可抑制肿瘤细胞的进展[19]。这提示,由于肿瘤的异质性和遗传多样性,ELK3在不同类型的肿瘤和微环境中的表达可能产生不同的功能。为分析ELK3在胃癌中扮演的角色,我们通过对公共数据集的分析和临床样本检测证实了ELK3在胃癌组织中上调。此外,ELK3随着胃癌进展表达升高,其表达水平与N 分期、AJCC 分期、Lauren分型、分化程度、病理分型等密切相关。我们还发现ELK3表达与不良总体预后高度相关。一些对其他实体肿瘤的相关研究也证实了我们的结论,研究显示,ELK3可以促进膀胱癌、黑色素瘤的进展[20,21]。此外,ELK3还可以促进转化生长因子-β1(TGF-β1)诱导的肿瘤转移[22];在三阴性乳腺癌中敲低ELK3,TGF-β信号转导活性下降,肿瘤转移能力和上皮间质转化表型减弱[23]。ELK3与肿瘤化疗耐药存在密切联系,它可以通过磷脂酰肌醇3-激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白信号诱导自噬促进肿瘤化疗耐药[18]。对结直肠癌的相关研究表明,ELK3表达的升高与肿瘤化疗耐药性密切相关,下调其表达可以提高化疗敏感性[24]。根据以上结果我们可以认为,ELK3在胃癌中充当癌基因,是治疗胃癌良好的生物标志物。
为了解ELK3在肿瘤中发挥功能,我们基于多个数据库鉴定ELK3转录调控靶基因,构建ELK3的转录调控网络,并对靶基因进行GO和KEGG功能富集分析。GO主要富集在RNA剪接、GTP酶活性调控、GTP酶结合、细胞间黏附等相关。KEGG则富集在Rap1、AMPK、VEGF、TNF等信号相关通路。Rap1是小型GTPases的Ras家族的成员,在许多细胞类型中均受到多种细胞外刺激的激活。最近,大量证据表明,Rap1激活失调是导致恶性肿瘤发展的原因[25]。AMPK是与能量代谢密切的一种高度保守的丝氨酸/苏氨酸蛋白,在能量调节代谢作用方面起到关键性作用[26]。近年来发现AMPK激活可以磷酸化一些关键的代谢酶或激活转录因子调节下游基因表达,干扰肿瘤的物质和能量代谢,间接影响肿瘤细胞的生物学行为[27]。在肿瘤细胞中VEGF是一类重要的促进血管生成的生长因子,通常响应于通过低氧诱导因子-1α途径增加的肿瘤缺氧[28]。VEGF可以影响肿瘤微环境中免疫细胞的功能,参与肿瘤免疫逃避[29]。TNF是一种促炎性细胞因子,在哺乳动物免疫和细胞体内平衡中具有重要作用,作为一种内源性致热原,它能够引起细胞凋亡,诱导进一步的TNF 表达,促进恶性细胞产生其他细胞因子、趋化因子和C-X-C趋化因子受体4。这些趋化因子可能作用于淋巴细胞,导致局部免疫抑制,增强原发肿瘤生长并促进转移扩散,调节白细胞浸润和血管生成的程度和表型[30]。
我们还发现ELK3与肿瘤PD-1/PD-L1信号相关。PD-1是重要的免疫检查点,通过与其两个配体PD-L1和PD-L2的作用抑制T细胞的活化及细胞因子的产生,在维持机体的外周耐受上发挥至关重要的作用。肿瘤细胞及微环境通过上调PD-L1 表达并与肿瘤特异的CD8+T细胞表面的PD-1结合,限制宿主的免疫反应[31]。我们分析了胃癌中免疫细胞的比例,并发现ELK3的表达与调节T细胞、滤泡辅助性T细胞、CD8+T细胞的数量呈负相关,提示了ELK3可能参与免疫逃避。
本研究利用公共数据验证了ELK3在胃癌中高表达,并使用临床样本进一步验证ELK3高表达与肿瘤进展和不良预后密切相关。通过预测ELK3的靶基因并进行富集分析,结果表明它在肿瘤进展密切相关的机制中发挥作用。目前尚未有报道确定ELK3是否通过以上途径影响胃癌的进展,还需要更深入的研究。
