ELF4通过激活Akt通路促进胰岛素瘤细胞增殖并抑制细胞凋亡
2021-10-14卫国红万学思谭泳谣
卫国红,王 利,万学思,谭泳谣
中山大学附属第一医院1内分泌科,2保健科,广东 广州 510080;3中山大学中山医学院,广东 广州510080
胰腺神经内分泌肿瘤(PNENs)是胰腺上皮样肿瘤中第2常见的肿瘤,其病死率高达60%[1,2]。尽管如此,因其发病率较低,临床症状和体征常不典型,一直在临床上被忽视而对其研究不足,导致近30 年来我国PNENs病例数量呈显著上升,但患者生存期却无明显改善[3,4]。胰岛素瘤是功能性PNENs中最为常见的一种,胰岛素瘤的典型临床表现为Whipple三联征,但该病实际临床表现复杂多样,由于其引起的低血糖症状及神经系统症状往往与其他疾病类似,加之超声、CT的确诊率不高,均需由多科室会诊,临床上无法依据胰岛素瘤细胞的形态学来判断其良恶性质,目前亦无可靠临床指标及分子标记物以用于区分良、恶性胰岛素瘤[4],极易漏诊及误诊[5,6]。特别重要的是,正因为PNENs病程进展非常缓慢,确诊时大多已有远处转移,而转移性PNENs的5年生存率低至27%[7,8],这给胰岛素瘤的临床治疗提出了非常大的挑战。同时,胰岛素瘤中常见癌基因(myc,ras等)与抑癌基因(p53,Rb,p16等)表达均无明显异常变化[5,6,9],因此针对胰岛素瘤为主的PNENs新的诊断生物标志物亟待阐明。
ELF4属于ETS转录因子家族,是近年来新发现的一个在肿瘤发生、发展及肿瘤免疫中至关重要的癌基因[10]。ELF4是肿瘤恶性转化不可或缺的因子,研究发现在Elf4(-/-)p53(-/-)的胚胎成纤维细胞(MEF)中,甚至癌基因H-Ras(V12)或者c-myc均不能使得MEF细胞恶性转化[10]。ELF4与神经胶质母细胞瘤、卵巢癌等肿瘤的发生发展密切相关,发挥着如抑制细胞凋亡、促进肿瘤细胞过度增殖及促进肿瘤血管新生等生物学功能[11,14]。本研究拟探究胰岛素瘤中ELF4表达是否与其肿瘤的发生发展存在相关性。
胰岛素瘤等PNEN疾病临床上少见,导致病例及组织标本的稀缺成为限制其发病机制研究的瓶颈,目前尚无理想模拟其发生发展的动物模型[2,9]。因此,国内外关于胰岛素瘤发生、发展及演进研究尚未明确,目前的研究表明胰岛细胞增殖失控是导致胰岛素瘤发生的主要机制之一,而细胞过度增殖及抗凋亡的分子机制一直尚未明确。胰岛素瘤细胞增殖和抗凋亡过程中的关键因子有待进一步阐明。
本研究以ELF4外源稳定高表达的胰岛素瘤BON细胞为研究对象,发现ELF4高表达可以促进人胰岛素瘤细胞增殖,同时增强人胰岛素瘤细胞抗凋亡能力,并阐明其机制是通过激活Akt通路而促进胰岛素瘤细胞增殖和抗凋亡。本研究为阐明ELF4在胰岛素瘤发生发展中的作用及机理提供新的线索,并为胰岛素瘤的诊断预后标志或治疗提供可能的新靶点。
1 材料和方法
1.1 细胞系及实验试剂
人胰岛素瘤细胞系BON(中国医学科学院细胞库),冻存于本实验室液氮罐。胎牛血清FBS、DMEM培养基、0.25%胰蛋白酶、PBS均(Gibco);表阿霉素(EPI)(Selleck);抗ELF4抗体(Invitrogen),抗caspase-8前体抗体、抗caspase-8切割成熟体抗体、抗caspase-9前体抗体、抗caspase-9切割成熟体抗体、抗PARP前体抗体、抗PARP成熟体抗体、抗磷酸化Akt抗体(Thr308位点)、抗磷酸化Akt抗体(Ser473位点)、抗总Akt体、抗Actin抗体均(Cell Signaling Technology)。MTT(Genview);DMSO(Sigma)。
1.2 外源稳定高表达ELF4蛋白的细胞系的构建
通过逆转录病毒表达载体(pMSCV),构建质粒pMSCV-puro-ELF4-Flag,与包装质粒pIK用磷酸钙法共转HEK-293T细胞,制备病毒液,然后感染人胰岛素瘤细胞系BON。在培养基中添加嘌呤霉素作为细胞筛选标志物,并连续传代细胞,以筛选建立稳定高表达ELF4的细胞株(实验组BON-ELF4)。构建载体对照组细胞BON-Vector。
收集和抽提第5代细胞的总蛋白,采用免疫印迹技术检测证明稳定高表达ELF4的细胞BON-ELF4是否构建成功。
1.3 免疫印迹实验
收集各实验组及对照组细胞,使用细胞裂解液,充分裂解消化细胞获得总蛋白裂解液样品,采用BCA法进行各组蛋白定量后,进行SDS-PAGE电泳;等待电泳完成后,准备6张Whatman 3M专用滤纸和1张PVDF膜,甲醇浸泡PVDF膜5 min,将夹子、海绵和专用滤纸浸泡于转膜缓冲液中;取出SDS-PAGE凝胶,彻底去除浓缩胶部分,并把滤纸和PVDF膜裁成凝胶大小;按电转印装置操作,负极-海绵-3 张滤纸-浓缩凝胶-PVDF膜-3张滤纸-海绵-正极板,将其放入转膜槽中,加入转膜缓冲液中;冰浴,按照300 mA 电流设置转膜2 h;取出PVDF膜,使用含5%脱脂牛奶的TBST封闭液封闭1 h;然后,采用待测蛋白的一抗抗体4 ℃过夜孵育,TBST洗膜,15 min/次,重复3次;采用相应的二抗抗体孵育1 h;TBST洗膜,15 min/次,重复3次;在暗房采用X片发光显影定影而获得数据图。数据图中条带,经扫描后使用Quantity One v4.6.2软件测算出总体灰度值,并计算出相对灰度值:目的条带的总体灰度值/相对应的内参条带总体灰度值。
1.4 MTT比色法
取对数生长期的BON-ELF4和BON-Vector细胞,用胰酶消化制成单细胞悬液,通过细胞计数调整细胞浓度为3×104/mL,取200 μL细胞每孔接种于96孔细胞培养板内,共设置3个复孔,置于37 ℃,5%CO2饱和湿度孵箱内培养。每间隔24 h,在超净工作台内每孔加MTT(5 mg/mL)20 μL,培养箱内继续培养4 h,连续测定6 d。用5 cc的注射器小心的吸去培养基,加入100 μL DMSO 置摇床上低速振荡10 min,使结晶物充分溶解。最后,在酶联免疫检测仪570 nm处测量各孔的吸光值A570nm。
1.5 Annexin V-FITC/PI双染色结合流式细胞术检测细胞凋亡
将各组细胞置于37 ℃、5%CO2孵箱中孵育培养处理24 h后,去除培养基,随后分别用0.25%胰酶对细胞进行消化,采用DMEM完全培养基终止消化,800g离心5 min,弃去上清。采用1×PBS重悬细胞并计数,收集5×105细胞。加入500 μL的凋亡检测试剂盒(江苏凯基生物技术股份有限公司)中提供的缓冲液悬浮细胞后,加入5 μLAnnexin V-FITC 混匀,再加入5 μL碘化丙锭(PI),混匀,室温避光反应10 min。然后用流式细胞仪检测,激发波长Ex=488 nm;发射波长Em=530 nm,Annexin V-FITC 的绿色荧光通过FITC 通道(FL1)检测;PI 红色荧光通过PI 通道(FL3)。荧光补偿调节:使用未经凋亡诱导处理的正常细胞,作为对照进行荧光补偿调节去除光谱重叠和设定十字门的位置。采用FlowJo 7.6软件进行数据分析。
1.6 统计学分析
本研究实验数据均采用软件SPSS25.0进行统计学分析,定量资料采用均数±标准差表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 建立了ELF4高表达的人胰岛素瘤细胞BON-ELF4
应用逆转录病毒载体表达系统,构建ELF4稳定高表达人胰岛素瘤细胞系BON。Western blot显示BONELF4细胞中ELF4蛋白表达量高于对照组细胞BONVector(P=0.013,图1),稳定高表达外源性ELF4蛋白的细胞系BON-ELF4构建成功。

图1 建立ELF4稳定高表达的胰岛素瘤细胞BON细胞模型Fig.1 Establishment of BON-ELF4 cell line that stably overexpresses ectopic ELF4.A:Western blotting for detecting ELF4 in BON cells.B:Quantitative analysis of EFL expression using Quantity One software.*P=0.013 vs BON-Vector group.
2.2 高表达ELF4能促进人胰岛素瘤细胞增殖
实验结果显示,从第3 天开始,相比较于BON 细胞,稳定高表达ELF4的细胞系BON-ELF4生长明显较快(P<0.01,图2)。
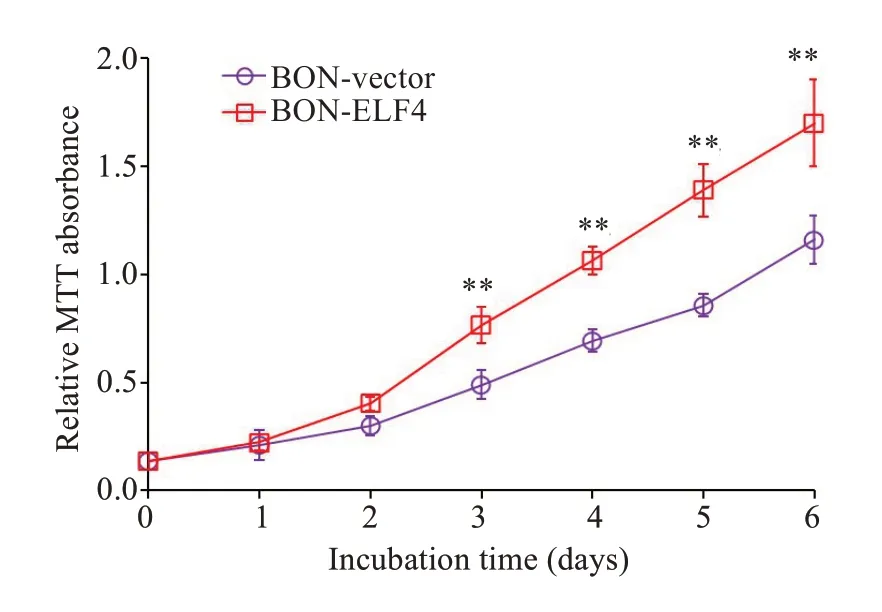
图2 MTT 法检测胰岛素瘤细胞BON-ELF4 和BON-Vector的生长曲线Fig.2 Growth curves of BON-ELF4 cells and BONVector cells generated based on the results of MTT assay(**P<0.01 vs BON-Vector group).
2.3 高表达ELF4能增强人胰岛素瘤细胞抗凋亡能力
采用抗肿瘤化疗药物表阿霉素(EPI)作为凋亡诱导剂,根据EPI的对各种肿瘤细胞的半数抑制浓度IC50,以及我们的预实验参考结果,发现选定0.1 μmol/L 作用24 h后可有效诱发BON-Vector肿瘤细胞的凋亡。而后通过免疫印迹法检测caspase 激活情况,相比较于载体对照组BON-Vector,BON-ELF4 细胞在0.1 μmol/L EPI 处理24 h 后caspase-8、caspase-9 蛋白前体降低,而caspase-8、caspase-9 成熟体切割带增强(P<0.05,图3)。同时,相应的PARP切割带随着ELF4的高表达而降低(P<0.05,图3)。采用Annexin V-FITC/PI染色结合流式细胞术分析,结果显示,在0.1 μmol/L EPI处理各组细胞24 h后,22.90%的载体对照组BON-Vector细胞呈现出Annexin V阳性、PI阴性的早期凋亡结果,6.03%的BON-ELF4细胞组呈现出Annexin V阳性、PI阴性的早期凋亡结果(图4)。

图3 EPI处理的各组肿瘤细胞中caspase-8、caspase-9及PARP的表达水平Fig.3 Expression cleaved caspase-8,caspase-9 and PARP in BON-ELF4 cells and BON-Vector cells following epirubicin treatment.

图4 Annexin V-FITC/PI双染色结合流式细胞术检测各组肿瘤细胞凋亡情况Fig.4 Epirubicin-induced apoptosis of BON-Vector and BON-ELF4 cells analyzed using flow cytometry with annexin V-FITC/PI staining.
2.4 ELF4能够激活胰岛素瘤细胞内Akt信号转导通路
检测BON-ELF4和BON-Vector细胞中Akt的磷酸化水平结果显示,与载体转导对照细胞相比,外源高表达ELF4的肿瘤细胞中Akt的磷酸化升高(P<0.05),而Akt总蛋白的水平基本未受影响(P>0.05,图5)。

图5 胰岛素瘤细胞BON-ELF4和BON-Vector细胞中Akt磷酸化水平Fig.5 Expressions of phosphorylated Akt and total Akt in BON-ELF4 cells and BON-Vector cells.
3 讨论
本研究证明了ELF4可促进胰岛素瘤细胞的增殖以及抵抗凋亡,并阐明其作用机理为激活了肿瘤细胞内Akt信号转导通路,可为胰岛素瘤的诊断预后标志或治疗靶点提供科学依据和理论基础。
ELF4属于ETS转录因子家族成员,能作为转录因子结合在IL-8、perforin、GM-CSF及IL-3等基因的启动子上,而启动基因表达[11]。研究表明,在小鼠的Elf4基因敲除后,并不会使得小鼠在胚胎期死亡。这提示ELF4或许是功能冗余,或许是在生理生化及发育过程中起到一定的作用[11,12]。另外,ELF4还能与细胞内蛋白相互作用,在机体天然免疫中起到调控作用,细胞静息状态下,ELF4以非活性状态游离于细胞质中,当PRRs识别病原体后,诱导位于内质网上的接头蛋白STING与ELF4的C端发生相互作用,并招募TBK1继而磷酸化ELF4,随后激活状态的ELF4转移到核内,进而增强了IRF3,IRF7以及p65与EICE的亲和力,最终促进I型干扰素的产生[13]。目前发现I型和II型干扰素通路的激活均是抗肿瘤免疫的重要环节[14,16],本研究发现ELF4可激活肿瘤细胞内Akt通路,而以往研究报道PI3K/Akt通路也是I型干扰素的产生的关键通路[17,18]。由此提示,ELF4可能可以通过Akt通路激活I型、II型或者III型干扰素的产生,亟待深入研究。因此,ELF4在肿瘤的发生发展以及肿瘤免疫系统中都扮演着非常重要的作用。
目前在肿瘤研究领域,ELF4作为抑癌或者促癌的研究都有报道。ELF4是肿瘤恶性转化不可或缺的因子,研究发现在Elf4(-/-)p53(-/-)的胚胎成纤维细胞(MEF)中,甚至癌基因H-Ras(V12)或者c-myc均不能使得MEF恶性转化[10]。其调控细胞恶性转化的分子机制主要是通过促进Mdm2 的表达,下调P53 依赖的反应,抑制INK4a的激活,从而导致Rb蛋白的磷酸化。研究表明,MDM2的磷酸化是其从细胞质移位进入细胞核的关键,MDM2需要定位到细胞核内才能与p53相互作用,而MDM2的磷酸化主要依赖与Akt激酶[19,20],本研究发现ELF4可激活Akt通路,因此提示ELF4可能是MDM2重要上游调节因子。研究发现ELF4在神经胶质母细胞瘤中异常高表达,其可通过直接激活机体细胞内Sox2的表达从而赋予其干细胞特性,促使神经胶质母细胞瘤的形成[21]。也有研究发现ELF4在卵巢癌中呈上调表达,并且通过体外及体内实验证明ELF4能促进卵巢癌细胞过度增殖,能够在裸鼠体内促进卵巢癌失控性生长[22]。然而在急性髓性白血病中,ELF4则是作为一个抑癌基因起作用[23]。本研究发现ELF4高表达可以促进人胰岛素瘤细胞增殖,同时增强人胰岛素瘤细胞抗凋亡能力,并阐明其机理是通过激活Akt通路而促进胰岛素瘤细胞增殖和抗凋亡。由此说明ELF4的功能具有一定的多样性,在不同类型肿瘤中,由于ELF4定位在细胞质或细胞核中而发挥功能的差异性,可能激活完全不同的信号转导通路,而其原因可能是在细胞内相互结合的关键蛋白因子不同。围绕ELF4的精细调控信号转导通路的主题,本课题组拟将继续深入探究。本研究为阐明ELF4在胰岛素瘤发生发展中的作用及机理提供新的线索,并为胰岛素瘤的诊断预后标志或治疗提供可能的新靶点。
