基质金属蛋白酶11对转化生长因子β1诱导人主动脉平滑肌细胞增殖和胶原合成的影响
2021-10-11白韬田文海唐康岁彭涛缪宜成甘金城
白韬 田文海 唐康岁 彭涛 缪宜成 甘金城
广西壮族自治区南溪山医院1血管外科,2疼痛科,3血管外科,4大血管外科,5科学实验室(广西桂林541002)
胸主动脉瘤是一种威胁生命的疾病,特征是无症状的胸主动脉扩张。患有胸主动脉瘤的患者发生严重主动脉并发症的风险较高,如壁内血肿、主动脉夹层或破裂,甚至致命[1-2]。据估计,全世界每年与主动脉瘤相关的死亡约为200 000 例[3]。由于迄今为止尚未发现任何有效的药物治疗方法,手术修复仍然是主动脉瘤的唯一治疗方法[2]。胸主动脉瘤是一种无声疾病,目前仍需要新颖的靶向诊断工具来识别胸主动脉瘤患者。血管平滑肌细胞(vascular smooth muscle cells,VSMC)作为主动脉介质层中的主要细胞,已被认为在维持主动脉壁稳态方面起着关键作用[4]。在人类和动物模型中,导致主动脉壁变性的因素包括转化生长因子β(transforming growth factor β,TGF⁃β)、基质金属蛋白酶(matrix metalloprotease,MMP)等[5-6]。根据报道,TGF⁃β1 可以促进人主动脉(human aortic,HA)⁃VSMC 的增殖、迁移和表型转换[7],还可诱导肺成纤维细胞增殖、胶原蛋白(collagen,Col)Ⅰ、Col Ⅲ合成与细胞表型分化[8]。TGF⁃β1 能够刺激VSMC胶原生物合成并抑制胶原降解[9]。此外,细胞表型转化发生在胸主动脉瘤的发展过程中,胸主动脉瘤成纤维细胞显示几种MMP(MMP2、MMP11、MMP14)、胶原蛋白基因/弹性蛋白(Col1a1、Col1a2、Col3a1、Ern)和其他基质蛋白的表达升高[10]。然而,目前仍缺乏关于MMP11 对TGF⁃β1 诱导的HA⁃VSMC 的增殖和胶原合成影响的报道。因此,本研究旨在通过测定MMP11 在TGF⁃β1 调控下HA⁃VSMC 的增殖和胶原合成中的功能,分析此过程中的相关机制,为胸主动脉瘤的临床防治提供新的研究方向和干预靶点。
1 材料与方法
1.1 材料人主动脉平滑肌细胞(HA⁃VSMC)购自美国生物标准品收藏中心,TGF⁃β1 购自美国Sigma⁃Aldrich 公司,MMP11 小干扰RNA si⁃MMP11、siRNA阴性对照si⁃NC购自上海吉玛公司,RIPA裂解缓冲液、增强化学发光(enhanced chemilumi⁃nescence,ECL)检测试剂盒购自美国ASPEN 公司,聚偏二氟乙烯(Polyvinylidene fluoride,PVDF)膜(0.45 μm)购自美国Millipore 公司,RevertAid First Strand cDNA 试剂盒购自美国Thermo Fisher Scien⁃tific 公司,SYBR⁃Green Premix Ex Taq 试剂盒购自大连TaKaRa 公司,MTS 细胞活力检测试剂盒购买美国Promega 公司。
1.2 细胞培养与干预将在干冰保存中的HA⁃VSMC 悬液常规解冻、复苏,以1 × 105细胞密度培养于含10%胎牛血清(Fetal calf serum,FBS)的达尔伯克改良伊格尔培养基(Dulbecco′s modified eagle medium,DMEM)中,置于细胞培养箱中,以37 ℃、5% CO2条件下培养,倒置显微镜下观察,当HA⁃VSMC 达到90%融合时,胰蛋白酶消化进行传代。采用对数生长期细胞进行实验。
TGF⁃β1 干预时,将HA⁃VSMC 接种于96 孔板,并使用含10% FBS 的完全培养基培养24 h。然后将HA⁃VSMC 用等体积的PBS 洗涤一次以除去残留的血清。血清饥饿24 h 后,将细胞用PBS 洗涤一次,并将0.1、1、5、10 ng/mL TGF⁃β1[7]加至细胞中,孵育24 h。
1.3 实验分组与干扰MMP11将HA⁃VSMC 分为对照组,0.1、1、5、10 ng/mL 组(0.1、1、5、10 ng/mL TGF⁃β1),5 ng/mL+si⁃NC 组(5 ng/mL TGF⁃β1+转染si⁃NC)和5 ng/mL+si⁃MMP11 组(5 ng/mL TGF⁃β1+转染si⁃MMP11)。干扰MMP11表达时,将HA⁃VSMC以1×105细胞密度接种于6孔板,24 h后,将细胞通过Opti⁃MEM 培养液、Lipo2000脂质体与si⁃MMP11、si⁃NC 充分混匀,置细胞培养箱中培养,6 h 后吸去培养基,加入10% FBS 的DMEM 培养基,继续培养48 h。转染结束后,将5 ng/mL TGF⁃β1加至细胞中,孵育24 h,进行后续检测。
1.4 Western blot每组HA⁃VSMC经1.3中处理后,加入适量RIPA 裂解缓冲液常规提取蛋白,二辛可宁酸(bicinchoninic acid,BCA)法测定蛋白浓度。每组50 μg 体系下行十二烷基硫酸钠⁃聚丙烯酰胺凝胶(SDS⁃PAGE)电泳,PVDF 膜转膜,5%脱脂牛奶室温浸泡封闭2 h。按1∶1 000 比例在封闭缓冲液中稀释细胞周期蛋白D1(CyclinD1)、增殖细胞核抗原(Proliferating cell nuclear antigen,PCNA)、ColⅠ、ColⅢ和MMP11一抗,将PVDF膜浸入一抗溶液中,在4 ℃下孵育过夜。次日用Tris⁃HCl⁃Tween 缓冲盐溶液(Tris buffered saline with Tween,TBST)将PVDF 膜彻底清洗,15 min/次×3 次。用封闭缓冲液将HRP 标记的二抗稀释至1∶5 000 的稀释度。37 ℃下将PVDF 膜浸泡在HRP 标记的二抗中孵育1 h,再用TBST 彻底清洗PVDF 膜。最后将适量的ECL 底物溶液逐滴添加到每个膜上显影,bio⁃rad 凝胶成像仪拍照分析。
1.5 细胞增殖检测取HA⁃VSMC 接种于96 孔板中,每孔约5×103个细胞,根据1.3 分组进行处理,分别在24 h 后加入MTS 试剂20 μL/孔,在37 ℃、5%CO2培养箱中静置1 h,酶标仪在490 nm 的波长下读取OD值,各平行孔取平均值。
1.6 MMP11 mRNA采用Trizol 试剂裂解HA⁃VSMC,提取RNA。按照RevertAid First Strand cDNA试剂盒和SYBR⁃Green Premix Ex Taq 试剂盒内说明书中的方法及步骤进行cDNA 合成与扩增实验,反应体系10 μL。通过ABI 7500 快速仪器定量MMP11 的表达。以GADPH 作为内参基因,用公式2⁃ΔΔCt计算MMP11 mRNA 表达情况。MMP11 序列为正向:5′⁃CCTAAAGGTATGGAGCGATGT⁃3′,反向:5′⁃CGATAGTCCAGGTCTCATCAT⁃3′。GADPH 引物序列正向:5′⁃GAAGGTGAAGGTCGGAGTC⁃3′,反向:5′⁃ATCCAGTGCAGGGTCCGAGG⁃3′。
1.7 统计学方法将SPSS 22.0 软件应用于统计分析,数据以()表示。组间差异比较通过t检验、SNK⁃q检测或单因素方差分析进行,当P<0.05时,差异有统计学意义。
2 结果
2.1 不同浓度TGF⁃β1对HA⁃VSMC增殖的影响见图1 和表1,0.1、1、5 和10 ng/mL 浓度TGF⁃β1 处理HA⁃VSMC后,0.1、1、5和10 ng/mL组HA⁃VSMC中CyclinD1、PCNA 蛋白水平和HA⁃VSMC 增殖活性均高于对照组,以5 ng/mL 组CyclinD1、PCNA 蛋白水平和增殖活性最高,差异有统计学意义(P<0.05)。
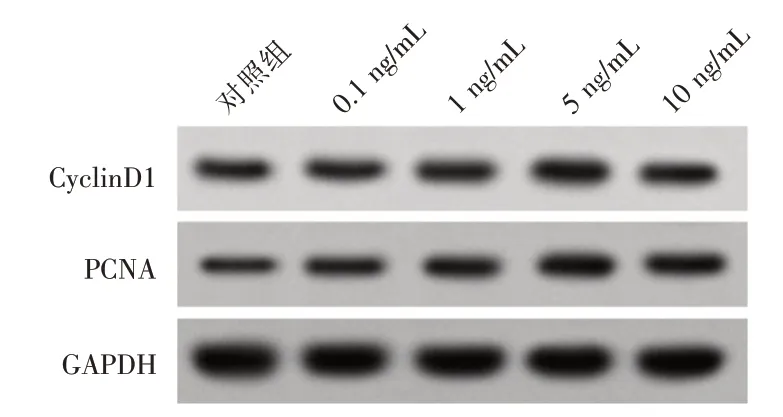
图1 不同浓度TGF⁃β1 对HA⁃VSMC 增殖相关蛋白的影响Fig.1 Effects of different concentrations of TGF⁃β1 on proliferation related proteins of HA⁃VSMC
表1 不同浓度TGF⁃β1 对HA⁃VSMC 增殖的影响Tab.1 Effects of different concentrations of TGF⁃β1 on proliferation of HA⁃VSMC ±s

表1 不同浓度TGF⁃β1 对HA⁃VSMC 增殖的影响Tab.1 Effects of different concentrations of TGF⁃β1 on proliferation of HA⁃VSMC ±s
注:与对照组比较,*P<0.05
分组对照组0.1 ng/mL 1 ng/mL 5 ng/mL 10 ng/mL F 值P 值OD490 0.29±0.02 0.47±0.03*0.79±0.04*1.05±0.07*0.85±0.05*49.676<0.001 CyclinD1 0.37±0.02 0.49±0.03*0.69±0.04*0.83±0.05*0.62±0.03*25.915<0.001 PCNA 0.23±0.01 0.36±0.03*0.49±0.04*0.68±0.04*0.51±0.03*30.888<0.001
2.2 不同浓度TGF⁃β1 对HA⁃VSMC 胶原合成的影响见图2 和表2,0.1、1、5 和10 ng/mL 浓度TGF⁃β1 处理HA⁃VSMC 后,0.1、1、5 和10 ng/mL 组HA⁃VSMC 中ColⅠ和ColⅢ蛋白水平均高于对照组,以5 ng/mL 组ColⅠ和ColⅢ蛋白水平最高,差异有统计学意义(P<0.05)。

图2 不同浓度TGF⁃β1 对HA⁃VSMC 胶原合成相关蛋白的影响Fig.2 Effects of different concentrations of TGF⁃β1 on collagen synthesis related proteins of HA⁃VSMC
表2 不同浓度TGF⁃β1 对HA⁃VSMC 胶原合成的影响Tab.2 Effects of different concentrations of TGF⁃β1 on collagen synthesis of HA⁃VSMC ±s
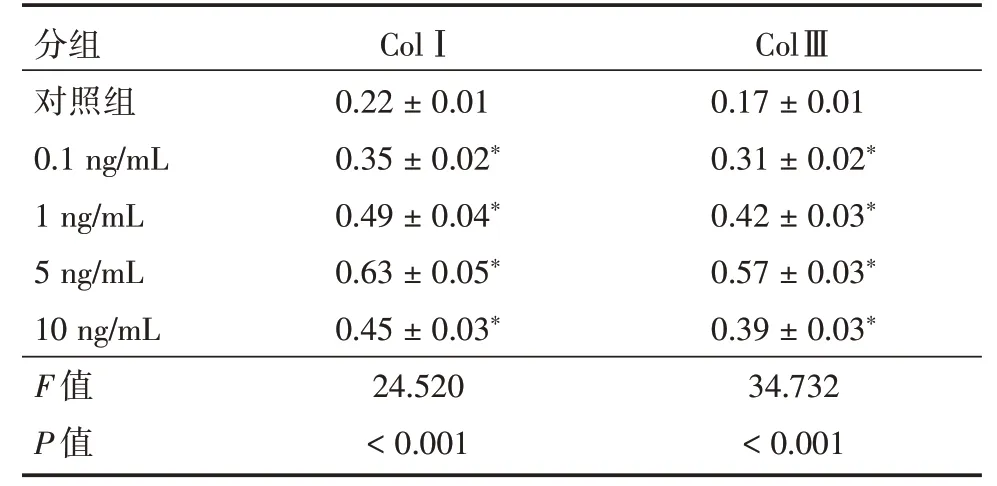
表2 不同浓度TGF⁃β1 对HA⁃VSMC 胶原合成的影响Tab.2 Effects of different concentrations of TGF⁃β1 on collagen synthesis of HA⁃VSMC ±s
注:与对照组比较,*P<0.05
分组对照组0.1 ng/mL 1 ng/mL 5 ng/mL 10 ng/mL F 值P 值ColⅠ0.22±0.01 0.35±0.02*0.49±0.04*0.63±0.05*0.45±0.03*24.520<0.001 ColⅢ0.17±0.01 0.31±0.02*0.42±0.03*0.57±0.03*0.39±0.03*34.732<0.001
2.3 不同浓度TGF⁃β1 对HA⁃VSMC 中MMP11表达的影响见图3 和表3,0.1、1、5 和10 ng/mL组HA⁃VSMC 中MMP11 蛋白和MMP11 mRNA 水平均高于对照组;差异有统计学意义(P<0.05)。

图3 不同浓度TGF⁃β1对HA⁃VSMC中MMP11表达的影响Fig.3 Effects of different concentrations of TGF⁃β1 on the expression of MMP11 of HA⁃VSMC
表3 不同浓度TGF⁃β1 对HA⁃VSMC 中MMP11 表达的影响Tab.3 Effects of different concentrations of TGF⁃β1 on the expression of MMP11 of HA⁃VSMC ±s

表3 不同浓度TGF⁃β1 对HA⁃VSMC 中MMP11 表达的影响Tab.3 Effects of different concentrations of TGF⁃β1 on the expression of MMP11 of HA⁃VSMC ±s
注:与对照组比较,*P<0.05
分组MMP11 mRNAMMP11对照组1.01±0.050.25±0.02 0.1 ng/mL 1.37±0.08*0.38±0.03*1 ng/mL 5 ng/mL 10 ng/mL F 值P 值1.86±0.10*2.57±0.13*2.12±0.11*39.699<0.001 0.51±0.03*0.75±0.05*0.42±0.03*34.432<0.001
2.4 干扰MMP11 表达能逆转TGF⁃β1(5 ng/mL)对HA⁃VSMC增殖的影响见图4和表4,5 ng/mL+si⁃MMP11 组HA⁃VSMC 的MMP11、CyclinD1、PCNA蛋白水平和增殖活性均低于5 ng/mL+si⁃NC 组,差异有统计学意义(P<0.05)。

图4 干扰MMP11 表达能逆转TGF⁃β1(5 ng/mL)对HA⁃VSMC 增殖相关蛋白的影响Fig.4 Interfering with MMP11 expression reversed the effects of TGF⁃β1(5 ng/mL)on HA⁃VSMC proliferation related proteins
表4 干扰MMP11 表达能逆转TGF⁃β1(5 ng/mL)对HA⁃VSMC 增殖的影响Tab.4 Interfering with MMP11 expression reversed the effects of TGF⁃β1(5 ng/mL)on HA⁃VSMC proliferation ±s

表4 干扰MMP11 表达能逆转TGF⁃β1(5 ng/mL)对HA⁃VSMC 增殖的影响Tab.4 Interfering with MMP11 expression reversed the effects of TGF⁃β1(5 ng/mL)on HA⁃VSMC proliferation ±s
注:与5 ng/mL+si⁃NC 组比较,*P<0.05
分组5 ng/mL+si⁃NC 5 ng/mL+si⁃MMP11 t 值P 值MMP11 0.78±0.04 0.36±0.02*9.773 0.001 OD 值(490 nm)0.98±0.04 0.51±0.03*10.720<0.001 CyclinD1 0.79±0.04 0.45±0.02*8.193 0.001 PCNA 0.66±0.03 0.34±0.01*11.392<0.001
2.5 干扰MMP11表达能逆转TGF⁃β1(5 ng/mL)对HA⁃VSMC胶原合成的影响见图5和表5,5 ng/mL+si⁃MMP11组HA⁃VSMC的ColⅠ和ColⅢ蛋白水平均低于5 ng/mL+si⁃NC组,差异有统计学意义(P<0.05)。

图5 干扰MMP11 表达能逆转TGF⁃β1(5 ng/mL)对HA⁃VSMC 胶原合成相关蛋白的影响Fig.5 Interfering with MMP11 expression reversed the effects of TGF⁃β1(5 ng/mL)on HA⁃VSMC collagen synthesis related proteins
表5 干扰MMP11 表达能逆转TGF⁃β1(5 ng/mL)对HA⁃VSMC 胶原合成的影响Tab.5 Interfering with MMP11 expression reversed the effects of TGF⁃β1(5 ng/mL)on HA⁃VSMC collagen synthesis ±s

表5 干扰MMP11 表达能逆转TGF⁃β1(5 ng/mL)对HA⁃VSMC 胶原合成的影响Tab.5 Interfering with MMP11 expression reversed the effects of TGF⁃β1(5 ng/mL)on HA⁃VSMC collagen synthesis ±s
注:与5 ng/mL+si⁃NC 组比较,*P<0.05
分组5 ng/mL+si⁃NC 5 ng/mL+si⁃MMP11 t 值P 值ColⅠ0.59±0.04 0.31±0.02*6.718 0.003 ColⅢ0.52±0.03 0.26±0.02*7.797 0.002
3 讨论
TGF⁃β是分子量为25 kDa 普遍存在的蛋白质,在组织修复中起重要作用。资料显示,TGF⁃β途径与胸主动脉瘤和VSMC 表型转换有关[11]。TGF⁃β1已被报道可以诱导VSMC 增殖[12],还可促进人主动脉内皮细胞、HA⁃VSMC 共培养后的ColⅠ、Col Ⅲ蛋白表达[13],这与本研究中观察到的0.1、1、5 和10 ng/mL 浓度TGF⁃β1 提高增殖活性、上调增殖蛋白CyclinD1、PCNA 水平和ColⅠ、Col Ⅲ蛋白水平相吻合,提示TGF⁃β1 能够促进HA⁃VSMC 的增殖和胶原合成。
MMP 在调节多种不同类型细胞的增殖、分化、凋亡等生理过程中发挥重要作用[14-15]。在胸主动脉瘤中,弹性蛋白、胶原蛋白和糖胺聚糖的含量减少,活性MMP及其抑制剂的数量失衡是造成这些变化的主要原因[16]。MMP⁃11 最早发现于乳腺癌[17],通过增加增殖和减少凋亡来促进乳腺肿瘤早期生长[18]。根据报道,MMP11 是胰腺导管腺癌的肿瘤启动子[19],MMP11 耗竭严重损害肺腺癌细胞的增殖、迁移和侵袭[20]。在SELVEY 等[21]测试的成纤维细胞培养物中,白介素1β、TGF⁃β、纤连蛋白和胶原V 处理48 h,使MMP⁃11 表达增加。本研究检测到了相同的情况,即0.1、1、5 和10 ng/mL 浓度TGF⁃β1 处理HA⁃VSMC 后,MMP11 蛋白、MMP11 mRNA 水平升高,提示TGF⁃β1 可诱导MMP11 表达。但MMP11 对TGF⁃β1 诱导的HA⁃VSMC 增殖与胶原合成的影响尚未可知。本研究利用siRNA 干扰MMP11 表达,结果表明,干扰MMP11 表达后,TGF⁃β1 促进HA⁃VSMC 增殖与胶原合成的作用被部分逆转,这表明MMP11 可能有助于TGF⁃β1 诱导HA⁃VSMC 的增殖与胶原合成,为胸主动脉瘤诊治的潜在靶点提供了新的见解,至于MMP11 发挥作用的机制有待于进一步研究。
