PRKAA2基因在肿瘤细胞与血细胞中表达差异研究
2021-10-11孙春霞陈书坤郑磊
孙春霞 陈书坤 郑磊
南方医科大学南方医院检验科(广州510515)
癌症已经成为全球最严重的致死性疾病之一。据全球癌症统计数据估计,2020年全球癌症发病人数和死亡人数分别达到1 930 万和1 000 万[1]。研究[2]表明转移和复发是癌症患者死亡的主要原因,血行播散则是癌症转移和复发的主要途径,因此检测循环肿瘤细胞(circulating tumor cells,CTCs)对癌症患者的转移和复发的预测及疗效监测具有重要的临床意义。CTCs 是由实体瘤脱落进入血液循环的肿瘤细胞,作为“液体活检”的主要标本之一,具有无创、便捷和可实时监测的特点,有助于实体瘤的早期检测与预后评估,在个体化治疗及疗效监测中具有重要临床意义[3]。然而,CTCs 数量十分稀少,从数以万计的血细胞中准确识别CTCs 成为了一项主要技术难题,极大阻碍其临床应用[4]。目前,联合多种上皮标志物及间质标志物检测已经成为提高CTCs 检出率的一个有效策略[5-6],但该策略存在特异性不足的问题。因此,迫切需要开发特异性高的标志物,方便实体瘤外周血的CTCs 的鉴定。
本研究利用肿瘤细胞与血细胞脂质代谢水平差异的特点,使用原位锁式探针杂交技术原位检测肿瘤细胞和白细胞(WBC)的脂代谢相关基因PRKAA2 的差异表达,为PRKAA2 用于CTCs 的鉴定提供可靠的理论基础。
1 材料与方法
1.1 材料
1.1.1 细胞系人肝癌细胞HepG2,宫颈癌细胞Hela,胶质瘤细胞U87 和前列腺癌细胞PC⁃3 均购自上海中科院细胞研究所细胞资源中心。
1.1.2 主要试剂与仪器LightCycler 480 实时荧光定量PCR 仪(瑞士Roche 公司)、倒置共聚焦荧光显微镜(日本尼康公司)、细胞涂片离心机(中国上海卢湘仪离心机仪器有限公司)、FastKing gDNA Dispelling RT SuperMix(中国Tiangen 公司)、Fast⁃Fire qPCR PreMix(中国Tiangen 公司)、Ampligase®DNA Ligase(美国Lucigen 公司)、Rnase H,Rever⁃taid H Minus Rt Ea,Ribolock Rnase Inhibitor Ea,Phi29 DNA Polymerase Ea(美国Thermo Fisher Scien⁃tific 公司)、LymphoprepTM(加拿大Stemcell 公司)、qRT⁃PCR 引物(中国BGI 公司)、原位杂交引物和探针(中国BGI 公司)、CellTrace CFSE Cell Prolifer⁃ation,CFSE,Slowfade gold antifade reagent,2⁃(4⁃Amidinophenyl)⁃6⁃indolecarbamidine dihydrochlori⁃de,DAPI(美国Thermo Fisher Scientific 公司)。
1.1.3 引物和探针原位锁式探针实验的荧光检测探针来源于文献[7],引物和检测探针使用Inte⁃grated DNA technology 网 站(https://sg.idtdna.com/pages)进行设计,并在Blastn(https://blast.ncbi.nlm.nih. gov/Blast.cgi)网站的refseq_rna 数据库中行序列比对以获取特异性的引物(引物,锁式探针和检测探针序列见表1-2)。
1.2 实验方法
1.2.1 细胞培养使用含有10%胎牛血清的DMEM高糖培养基培养细胞,并将细胞置于37 ℃、5% CO2孵箱中,待细胞汇合度为80%~90%时采用0.25%胰蛋白酶消化收获细胞。
1.2.2 提取WBC按照说明书使用Lymphoprep试剂提取健康体检者外周血WBC,具体操作如下:在15 mL离心管中加入Lymphoprep分离液2 mL,取2 mL 3%FBA⁃PBS 稀释等量全血,稀释后血液叠加在Lymphoprep分离液上,1 200 g离心10 min后弃上清,3%FBS⁃PBS 离心洗涤后收集WBC 沉淀。
1.2.3 肿瘤细胞和WBC 的PRKAA2 mRNA 定量检测按照TRIZOLTM 试剂说明书步骤分别抽提肿瘤细胞和WBC 的总RNA。使用FastKing cDNA第一链合成试剂盒逆转录RNA,取1 μg RNA 合成cDNA。采用FastFire qPCR PreMix试剂盒用于qRT⁃PCR 反应,反应体系为20 μL。引物序列见表1,GAPDH 作为内参基因。反应程序如下:95 ℃预变性1 min;95 ℃变性5 s,60 ℃退火/延伸15 s,共40个循环。使用LightCycler 480实时荧光定量PCR仪检测样本荧光信号。使用2⁃ΔΔCT法计算基因相对表达量。

表1 荧光定量PCR 引物序列Tab.1 Primer sequences of fluorescence quantitative PCR
1.2.4 原位锁式探针杂交实验(1)制片:掺入实验中,将对数生长期的肿瘤细胞消化成单个细胞,加入终浓度为5 μmol/L 的细胞追踪染料CFSE(溶于1 mL PBS 中)后37 ℃水浴20 min,加5 mL 完全培养基37 ℃水浴30 min,PBS 清洗3 次,获取细胞沉淀。肿瘤细胞、WBC和WBC混合CFSE标记肿瘤细胞置于细胞甩片离心机,1 600 r/min 离心3 min,制成细胞玻片样本,3.7%多聚甲醛固定10 min,-20 ℃冰箱保存。(2)杂交实验:详细过程参照文献[9],主要程序包括以下步骤:(1)加入Revertaid H minus RT 酶逆转录体系,45 ℃孵育3 h;(2)加入Rnase H,Ampligase®DNA Ligase 酶体系37 ℃孵育30 min,45 ℃孵育45 min;(3)加入Phi29 DNA polymerase 酶体系室温滚环扩增过夜;(4)加荧光标记检测探针置于37 ℃孵箱杂交30 min;(5)最后用1∶5 000 DAPI 复染细胞核,再滴加Slowfade gold antifade reagent 抗淬灭封片剂封片,4 ℃保存;(6)共聚焦荧光显微镜成像和分析。
1.3 统计学方法使用SPSS 25.0 软件进行统计分析,数据采用均数±标准差表示,正态分布两组均数比较采用t检验,方差不齐时则采用校正t检验。P<0.05 表示差异有统计学意义。

表2 原位锁式杂交实验的引物和探针序列Tab.2 Primer and probe sequences for in situ padlock hybridization experiments
2 结果
2.1 PRKAA2 在WBC 与多种肿瘤细胞中的表达水平THPA 数据库(https://www.proteinatlas.org/)的RNA 测序数据[8]显示PRKAA2 基因在WBC 中几乎不表达(图1A)。应用qRT⁃PCR 实验,验证该基因在HepG2、U87、Hela、PC⁃3 细胞系和WBC 中的表达差异,结果见图1B、表3,HepG2、U87、Hela和PC⁃3 细胞系中的PRKAA2 mRNA 水平显著高于WBC,差异具有统计意义(均P<0.05)。

图1 PRKAA2 在WBC 与多种肿瘤细胞系中的表达水平Fig.1 The mRNA level of PRKAA2 in WBC and multiple tumor cell lines
表3 PRKAA2 mRNA 在Hela、U87、PC⁃3、HepG2 和WBC细胞中相对表达量(2⁃ΔΔCT)Tab.3 PRKAA2 mRNA levels in Hela,U87,PC⁃3,HepG2 cancer cells and WBC(2⁃ΔΔCT)±s

表3 PRKAA2 mRNA 在Hela、U87、PC⁃3、HepG2 和WBC细胞中相对表达量(2⁃ΔΔCT)Tab.3 PRKAA2 mRNA levels in Hela,U87,PC⁃3,HepG2 cancer cells and WBC(2⁃ΔΔCT)±s
注:P 值均为与WBC 比较所得
⁃ΔΔCT 样本WBC Hela U87 PC⁃3 HepG2 PRKAA2(2)1.12±0.73 429.40±109.6 206.18±15.5 57.11±7.67 778.70±156.9 P 值0.002 0.002<0.001 0.013
2.2 PRKAA2 基因在HepG2、U87、Hela、PC⁃3 细胞中特异性高表达使用ACTB基因作为阳性对照,原位锁式探针技术检测HepG2、U87、Hela、PC⁃3 细胞系和WBC的PRKAA2 mRNA,结果见图2,HepG2、U87、Hela 和PC⁃3 细胞显示为DAPI+/PRKAA2+/ACTB+,而WBC 显示为DAPI+/PRKAA2-/ACTB+,表明PRKAA2 基因在HepG2、U87、Hela 和PC⁃3 细胞中特异性高表达。

图2 肿瘤细胞HepG2、Hela、U87、PC⁃3 与WBC 的PRKAA2 mRNA 信号荧光图 标尺:10 μM(放大倍数400×:目镜10×,物镜40×)Fig.2 Fluorescent images of PRKAA2 mRNA in cancer cells(HepG2,Hela,U87,PC⁃3)and WBC(magnification power:400×:eyepiece 10×,objective 40×)
2.3 检测PRKAA2mRNA 荧光信号可准确鉴定肿瘤细胞实验采用原位锁式探针杂交技术检测PRKAA2 以识别CTCs。HepG2、U87、Hela 和PC⁃3肿瘤细胞被预先标记CFSE 荧光染料并掺入1 mL健康体检者外周血中以模拟临床样本,内参基因ACTB 作为阳性对照。结果见图3,WBC(DAPI+/CFSE-)未检测到PRKAA2 信号,而几乎所有肿瘤细胞(DAPI+/CFSE+)均检测到PRKAA2 信号。CFSE 和PRKAA2 在共聚焦荧光显微镜下实现良好的荧光信号共定位,表明检测PRKAA2 mRNA 荧光信号可准确鉴定肿瘤细胞。
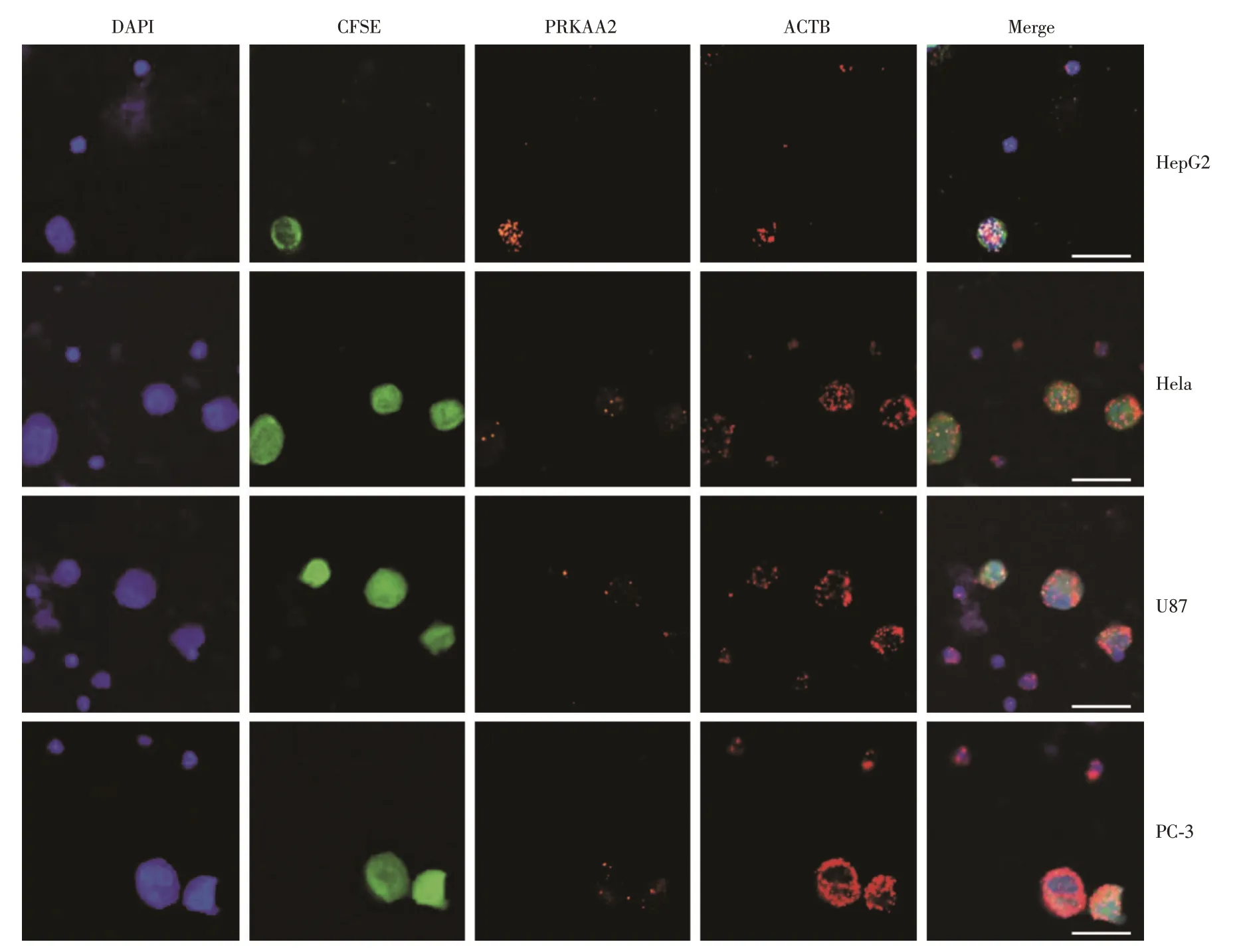
图3 PRKAA2 mRNA 与CFSE 共定位荧光图(放大倍数400×:目镜10×,物镜40×)Fig.3 Fluorescent images show co-localization of PRKAA2 mRNA and CFSE(magnification power:400×:eyepiece 10×,objective 40×)
3 讨论
脂肪由磷脂、脂肪酸、甘油三酯、鞘脂、胆固醇和胆固醇酯等分子组成,是所有细胞膜的重要组成部分,也是特定条件下细胞的重要能量来源[9-10]。脂质代谢异常是众多代谢性疾病,如心血管疾病、非酒精性脂肪肝、糖尿病、胰腺炎发生发展的关键因素[11-14]。越来越多的证据[15-17]表明,脂肪代谢异常即脂代谢重编程有利于癌细胞的存活、增殖、侵袭和转移,在肿瘤恶性生物学行为中起着关键的作用。因此,靶向脂质代谢调节相关通路已成为一种新的抗癌策略[18-19]。
本实验室长期致力于CTCs 的富集和鉴定的研究,经脂代谢基因芯片筛选发现PRKAA2 在肝癌细胞中的表达水平显著高于WBC。本研究发现,除了肝癌细胞,在前列腺癌、宫颈癌、胶质瘤等细胞中其表达量均和WBC 有统计学差异,这和PRKAA2 的功能密切相关:PRKAA2 基因编码腺苷酸活化蛋白激酶(AMP⁃activated protein kinase,AMPK)的α2 催化亚基蛋白,该蛋白通过磷酸化乙酰辅酶A 羧化酶1(ACC1)、磷酸化线粒体相关亚型ACC2 和介导转运蛋白CD36 转位到质膜,达到抑制脂肪酸合成、上调脂肪酸氧化水平、激活脂肪酸摄取的效果,从而在应激条件下维持肿瘤细胞的代谢稳态[20]。由于肿瘤细胞与正常细胞的脂代谢差异,PRKAA2 作为一个潜在的“通用型”肿瘤细胞标志物的优势如下:(1)可从细胞代谢功能上直接辨别癌与非癌,特异性高;(2)不局限于某种特定肿瘤细胞,有望提高CTCs 检测通量,并且省时、经济。因此,PRKAA2 有望成为极具潜力的CTCs 鉴定标志物。
本研究使用的原位锁式探针杂交技术整合了滚环扩增法,可在细胞原位检测单个PRKAA2 mRNA 信号,具有灵敏度高、特异性强和信噪比高的特点[7],为得到准确可靠的实验结果提供坚实的技术保障。我们将肿瘤细胞掺入外周血模拟CTCs,采用原位锁式杂交技术可视化检测PRKAA2荧光信号,结果表明对PRKAA2 的荧光信号检测可从大量背景WBC 中准确识别肿瘤细胞,为PRKAA2 用于CTCs 的鉴定提供理论基础和技术保障。
总之,本研究初步证实,检测标志物PRKAA2可特异鉴定多种类型的肿瘤细胞,并有望准确定量多种癌症起源CTCs,对肿瘤的辅助诊断、治疗检测和预后评估等提供重要的临床价值。然而,本课题局限于体外实验,尚未进行体内实验,后续的研究中会纳入多肿瘤类型及扩大样本量,来进一步验证PRKAA2 作为泛癌CTCs 鉴定标志物的临床应用价值。
