青蒿琥酯调节BCL⁃2家族蛋白平衡诱发肌成纤维细胞凋亡
2021-10-11曾高淳吴苗曾令基王雅文罗琼赖沛龙杜欣翁建宇
曾高淳 吴苗 曾令基 王雅文 罗琼 赖沛龙 杜欣 翁建宇
1华南理工大学医学院(广州510006);2广东省人民医院(广东省医学科学院)血液内科(广州510080)
闭塞性细支气管炎(bronchiolitis obliterans,BO)是异基因造血干细胞移植后的严重晚期并发症,以小气道纤维化为主要病理机制,现有治疗方法效果不佳,患者5年病死率达50%,仍需探索新的治疗策略[1-3]。
肌成纤维细胞(myofibroblasts,MFB)是纤维化的核心效应细胞,MFB 凋亡逃逸是纤维化发生发展的重要机制,与BCL⁃2 家族失衡密切相关[4],近年来研究[5]表明靶向BCL⁃2 失衡表达诱导MFB 凋亡,可逆转已形成的皮肤纤维化,因此靶向MFB 凋亡可能是改善BO 的新治疗策略。
青蒿琥酯(artesunate,ART)抑制多种器官纤维化[6]。王昌明等[7-11]证实:ART 可通过诱导人肺成纤维细胞(fibroblasts,FB)凋亡、抑制FB 分泌功能、抑制FB 向MFB 转化,发挥抗肺纤维化作用。FB 是MFB 众多来源之一,调控纤维化核心细胞——MFB 凋亡可能是遏制和逆转纤维化的更高效靶点。ART 通过调控BCL⁃2 家族平衡诱导FB 及多种肿瘤细胞凋亡[7,12-14],笔者前期发现ART 可以减轻小鼠BO 病理损伤[15],但其对MFB 的作用及机制鲜有报道。本研究就ART 能否直接诱导MFB 细胞凋亡及其可能的相关机制展开研究和探索,以期为ART 治疗BO 提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 细胞来源正常人胚肺成纤维细胞系MRC⁃5(ATCC 公司)。
1.1.2 主要试剂α⁃MEM 培养基、胰酶、胎牛血清(美国Gibco 公司),TGF⁃β1(美国PeproTech 公司),青蒿琥酯(美国Sigma 公司),细胞增殖及毒性检测(CCK⁃8)、AnnexinV⁃AF647/PI(上海奕杉生物公司),JC⁃1 线粒体膜电位荧光探针(上海翊圣生物公司),逆转录及RT⁃qPCR 试剂盒(湖南艾科瑞生物公司),兔抗人α⁃SMA、兔抗人GAPDH 和HRP 标记的羊抗兔IgG(英国Abcam 公司)。
1.2 实验方法
1.2.1 构建MFB 模型取10~12 代FB 细胞,以2× 104/孔接种于六孔板各孔中,分别加入0、2.5、5、10、20、40 ng/mL TGF⁃β诱导48 h,根据α⁃SMA 的表达水平选择最佳浓度进行MFB 模型构建。
1.2.2 ART浓度探索CCK⁃8法检测细胞活性:将FB细胞以5×103/孔接种于96孔板中,加入TGF⁃β诱导48 h,然后于各孔分别加入0、50、100、200 μmol/L ART 处理24 h,更换含10% CCK⁃8 的培养基,同时加设空白组,于培养箱中孵育1 h,测定450 nm 吸光度,根据半数抑制浓度(IC50)选择ART 浓度进行后续实验。
1.2.3 实验分组及流程(1)MFB 组:不加ART 的对照组;(2)MFB⁃ART组:加入100 μmol/L ART处理24 h,见图1。每组设计3 个复孔,后续各检测指标均复测3 次。

图1 实验流程Fig.1 Experimental procedure
1.3 检测指标
1.3.1 RT⁃qPCR检测α⁃SMA及BCL⁃2家族基因用TRIzol 法提取MFB 组和MFB⁃ART 组细胞的总RNA,按照说明书合成cDNA 并构建20 μL RT⁃qP⁃CR 反应体系和实验。引物序列见表1,以2⁃ΔΔCt计算各基因的相对表达水平。
1.3.2 Western blot检测α⁃SMA的蛋白表达情况提取细胞蛋白,进行定量和变性,取20 μg 上样,电泳90 min,电转2 h,室温封闭1 h,TBST 洗膜三次,以GAPDH 抗体作为对照,加入α⁃SMA 抗体于4 ℃孵育过夜,TBST 洗膜三次,加入二抗于室温下孵育1 h,TBST 洗膜三次,加入显色液进行曝光,使用Image J 软件对条带进行灰度值分析,计算α⁃SMA/GAPDH 比值。
1.3.3 JC⁃1检测细胞线粒体膜电位变化情况(1)荧光显微镜观察:细胞JC⁃1 染液孵育20 min,PBS清洗后,镜下观察。(2)酶标仪检测:将FB 细胞以5 × 103/孔接种于96 孔板中,加入TGF⁃β诱导48 h形成MFB 细胞,按照1.2.3 进行分组,分别于0、24、36、48、60、72、84、96 h 进行JC⁃1 染液孵育,同时设置相应阴性及阳性对照组,酶标仪检测绿色(波长510/529 nm)和红色荧光(波长577/595 nm)数值,并计算最终荧光数值。
1.3.4 流式细胞术检测细胞凋亡情况将FB 细胞以1×104/孔接种于24孔板中,加入TGF⁃β诱导48 h形成MFB 细胞,按照1.2.3 实验分组及流程进行分组,消化、离心、PBS 清洗后重悬细胞,进行Annexin V和PI双染色,室温避光孵育5 min,立即流式检测。
1.4 统计学方法应用SPSS 25.0 统计软件分析数据,计量资料用均数±标准差表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。统计结果均采用GraphPad Prism 8 作图。
2 结果
2.1 MFB细胞模型构建FB细胞加入TGF⁃β培养48 h 后:细胞形态与FB 组无明显差异,细胞生长更为密集。见图2A;α⁃SMA mRNA和蛋白水平均呈浓度相关性递增,α⁃SMA mRNA 在TGF⁃β 20 ng/mL 达峰,但TGF⁃β 10、20、40 ng/mL 组之间差异无统计学意义;α⁃SMA 蛋白在TGF⁃β 10 ng/mL 达峰,但TGF⁃β 10、20 ng/mL 组之间差异无统计学意义,见图2B、C。故此,本研究确定10 ng/mL TGF⁃β刺激FB 细胞48 h 为MFB 细胞模型的构建体系。
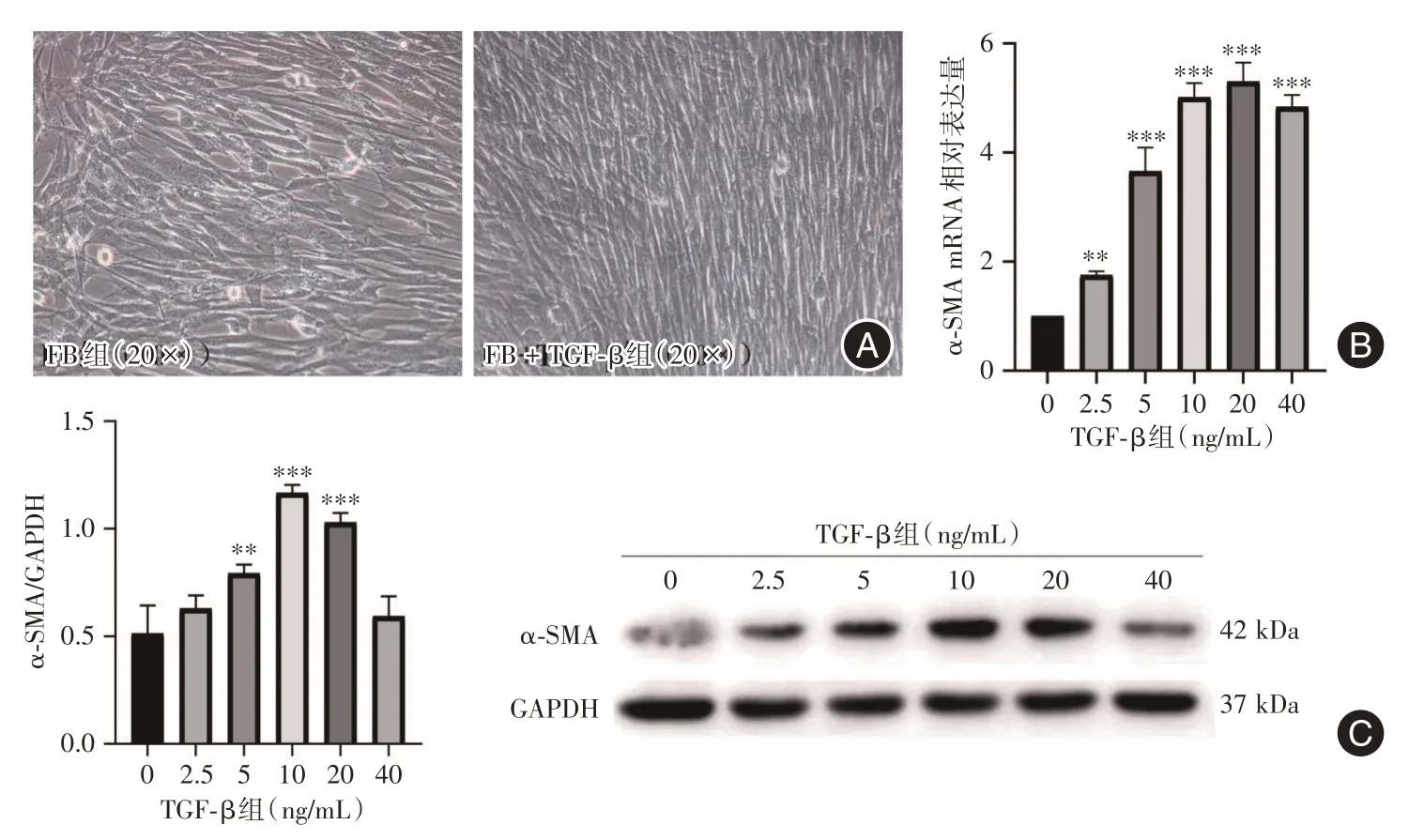
图2 MFB 模型的构建Fig.2 Construction of the model of MFB
2.2 ART抑制MFB活性实验CCK⁃8实验结果表明:ART 浓度为50、100、200 μmol/L 时,细胞活性呈浓度依赖性降低,分别为(68.33±2.31)%、(48.00 ±3.61)%、(19.33±8.02)%,且较基线和对照组明显降低(P< 0.001),见图3。在ART 浓度100 μmol/L 时最接近IC50,因此选择该浓度进行后续实验。
2.3 流式检测ART 对MFB 细胞凋亡情况的影响流式结果表明:MFB 组细胞早期凋亡(Annexin V+PI-)比例为(2.94 ± 0.28)%,晚期凋亡(Annexin V+PI+)比例为(0.51 ± 0.10)%;而MFB⁃ART 组分别为(13.40 ± 0.87)%和(2.12 ± 0.39)%;MFB⁃ART组细胞总体凋亡率(15.52 ± 1.23)%高于MFB 组(3.45±0.34)%,见图4。实验结果证实:ART 可促进MFB 细胞发生凋亡。
2.4 JC⁃1 检测ART 处理后细胞线粒体膜电位变化情况
2.4.1 荧光显微镜镜下可见MFB 组细胞胞质红绿荧光共存,而MFB⁃ART 组细胞数量减少,且大部分细胞红色荧光减弱,胞质中仅有绿色荧光(白色箭头所示),见图5A。

图3 CCK⁃8 检测不同浓度ART 对MFB 细胞活性的影响Fig.3 Effects of different concentrations of ART on cell viability of MFB cells by cell counting kit⁃8 assay
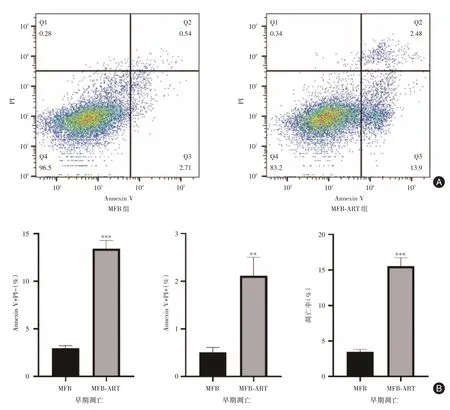
图4 ART 对MFB 细胞凋亡的影响Fig.4 Effects of ART on the apoptosis of MFB cells
2.4.2 酶标仪(1)MFB 组:细胞红色和绿色荧光强度在8 个时间点存在一定波动,但组间无显著变化,见图5B、C。(2)MFB⁃ART 组:0 ~ 96 h 红色荧光强度明显下降[从(17.58 ± 1.08)降至最低峰(1.28±0.35)],36、48、60、72 h(P<0.01)和84、96 h(P<0.05)比基线明显下降,虽然60~96 h 的红色荧光强度稍有回升,但组间变化无差异。各时间点绿色荧光的强度变化无差异。见图5B、C。以上结果表明:ART 可降低MFB 细胞线粒体膜电位,其作用高峰出现于ART 处理后24~36 h。
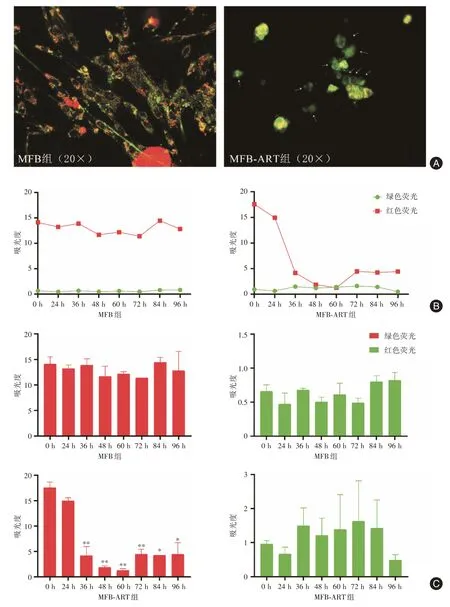
图5 ART 对MFB 细胞线粒体膜电位的影响Fig.5 Effects of ART on the mitochondrial membrane potential of MFB cells
2.5 RT⁃qPCR 检测ART 处理后MFB 线粒体凋亡相关基因的表达情况RT⁃qPCR 结果表明:相较于MFB 组,MFB⁃ART 组抗凋亡的BCL⁃2 表达明显降低(P< 0.001),而BCL⁃W、BCL⁃XL、MCL⁃1 表达变化差异无统计学意义;具凋亡激活功能的BIM(P< 0.01)表达升高,而BID 表达变化差异无统计学意义;增敏功能的PUMA、BMF、HRK(P<0.05)表达升高,而BAD、NOXA 表达变化差异无统计学意义;效应功能的BAX 和BAK 表达变化差异均无统计学意义,见图6。

图6 ART 对MFB 细胞线粒体凋亡相关基因表达的影响Fig.6 Effects of ART on mitochondrial apoptosis related gene expression in MFB cells
3 讨论
BO 是异基因造血干细胞移植后肺部慢性移植物抗宿主病(chronic graft versus host disease,cGVHD)严重并发症,小气道纤维化是关键病理改变[1,16]:气道上皮损伤引起炎症、免疫紊乱,进而引起MFB 的活化、增殖、凋亡逃逸,进一步引发细胞外基质(extracellular matrix,ECM)沉积,最终导致不可逆性瘢痕形成。cGVHD⁃BO 目前治疗以抗炎、免疫调节为主,但效果不尽人意。贝伐珠单抗[17]、糖皮质激素[18]等可改善肺纤维化及炎症,但无法克服移植患者排斥、免疫重建不稳定导致的气道反复损伤和慢性炎症的体质因素。靶向纤维化细胞因子通路的新药如“尼达尼布”和“吡非尼酮”在特发性肺纤维化的临床试验中疗效未达预期,且无法逆转已形成病理纤维化损伤,探索BO治疗新策略极为迫切。
MFB 是纤维化过程中的关键效应细胞,高表达α⁃SMA,正常组织中没有或极少MFB,但损伤和炎症刺激可使局部的FB、上皮细胞、内皮细胞、间充质细胞等转化为MFB,驱使MFB 激活、增殖、分泌、收缩,致使局部组织机械压力增大、ECM 沉积及促纤维化细胞因子的释放,加剧纤维化的进程。病理纤维化中MFB 通过凋亡逃逸在组织中持续存活,造成靶器官不可逆损伤[19-21]。靶向MFB凋亡,比靶向复杂的炎症通路或某一细胞向MFB转化途径更具高效性。LAGARES 等[4-5]发现在硬皮病小鼠模型中,MFB 促凋亡激活蛋白BIM 表达升高,伴随抗凋亡蛋白BCL⁃XL更高水平表达的现象,导致BCL⁃2 家族蛋白天平最终向抗凋亡方向倾斜,MFB 发生了凋亡逃逸;利用BCL⁃2 蛋白家族(BCL⁃XL、BCL⁃2、BCL⁃W)抑制剂ABT⁃263 可纠正BCL⁃2 家族蛋白的表达失衡,成功诱导MFB 细胞发生线粒体凋亡,并逆转皮肤的病理纤维化。另外,二甲双胍可经AMPK途径促MFB的凋亡和失活,从而逆转肺纤维化[22];异羟肟酸可经下调BCL⁃XL和上调BAK 诱导特发性肺纤维化患者的MFB 凋亡,并可改善博来霉素诱导的小鼠肺纤维化[23];过表达基质细胞蛋白CCN5 可激活线粒体凋亡途径诱导MFB 凋亡并部分逆转已形成的心脏纤维化[24]等发现,提示启动MFB 线粒体凋亡的分子基础取决于BCL⁃2 家族蛋白中促凋亡/抗凋亡力量组合的天平倾向,因此,靶向MFB 凋亡逃逸——调节MFB的BCL⁃2 家族蛋白失衡,可能是延缓甚至逆转纤维化的一种有效策略。
ART 是经典的抗疟疾药物,其安全性在众多临床研究中已被验证。近来研究[6]发现:ART 在肺、肾脏、肝脏、皮肤等许多器官中皆可发挥抗纤维化作用,可诱导局部组织细胞凋亡、抑制局部组织细胞向MFB 转化及其抗炎、免疫调节等。本研究团队既往工作基础显示[15]:ART 可延长cGVHD小鼠的生存时间,改善肺脏、肝脏、皮肤病理损伤,减轻BO 小鼠小气道损伤和α⁃SMA+MFB 细胞浸润,提示ART 可能通过抑制MFB 改善cGVHD⁃BO病理进程。
本研究通过TGF⁃β诱导FB 构建MFB 体外模型,证实ART 可调节MFB 的BCL⁃2 家族抗凋亡(BCL⁃2↓)/促凋亡(BIM↑、PUMA↑、BMF↑、HRK↑)平衡向促凋亡方向倾斜,触发MFB 发生线粒体膜去极化,并直接诱导MFB 细胞凋亡。ART 作用于MFB 的线粒体凋亡机制与FB 不同,ART 诱导FB 凋亡(BAX↑、BCL⁃2↓)[7],而不能促进MFB 的BAX 表达,说明对于不同细胞,ART 靶向BCL⁃2 家族中抗凋亡/促凋亡分子的作用机制不同及组合存在差异[25]。
本研究首次证实ART 可直接诱导MFB 凋亡,并且ART 通过调控MFB 的BCL⁃2 家族平衡倾向,诱导MFB 发生线粒体凋亡,这些结果为ART 治疗cGVHD⁃BO 提供了实验证据。本研究也存在一些局限性:体外实验与体内环境存在差异,需进一步完善体内研究;有关ART 调节MFB 线粒体BCL⁃2家族蛋白失衡的分子机制还有待进一步的研究。笔者将继续探索ART 调控MFB 的BCL⁃2 家族蛋白表达分子机制,并通过对cGVHD⁃BO 小鼠模型和临床病例的深入研究,确定cGVHD⁃BO 特异性BCL⁃2 家族蛋白失衡组合。总的来说,ART 调控MFB 凋亡逃逸可能是其抗纤维化的重要机制之一,对于血液系统肿瘤合并cGVHD 的移植患者,ART 可能是一个具有抗纤维化,又能兼顾抗肿瘤、抗感染作用的潜在候选药物,有望成为cGVHD⁃BO 治疗的新方法。
