心脏瓣膜钙化和颈动脉粥样硬化对维持性腹膜透析患者预后的影响
2021-10-11张悦华佳刘晓斌张希燃薛婧王凉
张悦 华佳 刘晓斌 张希燃 薛婧 王凉
南京医科大学附属无锡人民医院(江苏无锡214023)
终末期肾脏病(end⁃stage renal disease,ESRD)患者心脏瓣膜钙化(cardiac valve calcification,CVC)和动脉粥样硬化(atherosclerosis,AS)常常伴发,其心血管疾病的病死率高于普通人群。既往研究多为CVC 或颈动脉粥样硬化(carotid atherosclerosis,CAS)单个因素提示腹膜透析患者预后不良,联合2 个指标一起预测腹膜透析患者预后的研究不多。本文回顾性分析CVC 和CAS 对腹膜透析(peritoneal dialysis,PD)患者预后影响,并探讨联合2 个指标预测PD 患者全因死亡和心血管死亡的价值,为ESRD 患者更好地进行全因死亡和心血管死亡危险分层提供理论依据,对于更好地诊治ESRD 患者以及改善预后具有重要的临床意义。
1 对象与方法
1.1 研究对象纳入2015年7-12月在南京医科大学附属无锡人民医院腹膜透析中心行持续性非卧床腹膜透析(CAPD)或日间非卧床腹膜透析(DAPD)治疗≥3月的ESRD 患者为研究对象,所有患者均使用百特PD4腹膜透析液(钙1.25 mmol/L)。排除标准:年龄< 18 周岁、先天性心脏病、心脏瓣膜病变、恶性肿瘤、妊娠、活动性狼疮、接受激素或免疫抑制治疗。排除无法配合检查及无法提供完整数据的患者。此项研究经南京医科大学附属无锡人民医伦理委员会批准。
1.2 研究方法
1.2.1 临床及实验室、器械指标采集患者年龄、性别、原发病、腹膜透析时间、吸烟病史,同时记录其收缩压(SBP)及舒张压(DBP)、尿素清除指数(KT/V),收集血红蛋白(Hb)、血清白蛋白(Alb)、血钙(Ca)、血磷(P)、甲状旁腺激素(iPTH)、快速C 反应蛋白(hs⁃CRP)、白介素⁃6(IL⁃6)、总胆固醇(TC)、甘油三脂(TG)、低密度脂蛋白胆固醇(LDC⁃C)、高密度脂蛋白胆固醇(HDL⁃C)、25 羟维生素D(25(OH)D)等指标,收集心脏超声及颈动脉B 超检查结果。
1.2.2 检测方法血常规用sysmex 仪检测,血生化用Beckman coulter 的UniCel DXC800仪检测,25(OH)D、IL⁃6 采用酶联免疫吸附试验(ELISA)方法检测,iPTH 用放射免疫法测定。颈动脉B 超检查采用Philips iU22 彩色多普勒超声诊断仪。心脏超声检查采用Philips iE33心脏多普勒超声诊断仪。
1.2.3 诊断标准CVC:心脏彩超检查在1 个或多个心脏瓣膜或瓣环上发现>1 mm 的强回声[1]。同时记录左心室射血分数(left ventrical ejection fraction,LVEF)。CAS:彩色多普勒超声诊断仪查颈动脉的内膜中层厚度(carotid intima⁃media thickness,CIMT)>1.1 mm[2]。
1.3 患者分组和随访将存在颈动脉粥样硬化、心脏瓣膜钙化作为危险标记,据此患者分为3 组:0、1、2 个危险标记组。随访所有患者至死亡、退出PD 或至研究终止(2020年6月30日)。临床终点事件包括全因死亡和心血管死亡。
1.4 统计学方法正态分布的计量资料用()表示,非正态分布的的计量资料用M(P25,P75)表示;计数资料用例(%)表示;正态分布的计量资料比较采用方差分析,非正态分布比较采用非参数检验,计数资料采用χ2检验;通过Kaplan⁃Meier 法生成生存曲线,采用Log⁃rank检验比较组间生存率。Cox比例风险模型分析0、1、2 个危险标记患者全因死亡和心血管死亡的HR(95%CI),通过受试者工作特征(ROC)曲线分析不同的变量相对于全因死亡和心血管死亡的预测价值。统计分析用SSPS 20.0 软件进行数据处理,P<0.05为差异有统计学意义。
2 结果
2.1 CVC、CAS发生率及分组基线资料比较共有166例患者入选本研究,平均年龄(54.85±15.64)岁。有46 例患者存在CVC,CVC 发生率为27.7%,有88例患者存在CAS,CAS 发生率为53.0%。有70 例(42.2%)患者不存在危险标记,58 例(34.9%)患者存在1个危险标记(CVC或CAS),38例(22.9%)患者存在2 个危险标记(CVC 和CAS),3 组基线特征见表1。3 组患者相比较,年龄、PD 时间、25(OH)D、SBP、LDL⁃C、Alb、hs⁃CRP、IL⁃6、iPTH 差异有统计学意义(P<0.05)。见表1。

表1 入选患者的基本特征Tab.1 Baseline characteristics of included patients M(P25,P75)
2.2 生存分析至研究终止,随访时间9.2~60 个月,中位随访期为52.3 个月,34 例PD 患者死亡,其中21 例死于心血管疾病(表2)。患者全因生存和心血管的事件生存的Kaplan⁃Meier 曲线(图1),危险标记越多的患者,其全因生存率和心血管事件生存率越低。2 个危险标记的患者的全因生存率明显低于1 个危险标记的患者和无危险标记的患者(χ2=37.690,P< 0.001),2 个危险标记的患者的心血管生存率明显也低于1 个危险标记的患者和无危险标记的患者(χ2=25.322,P<0.001)。
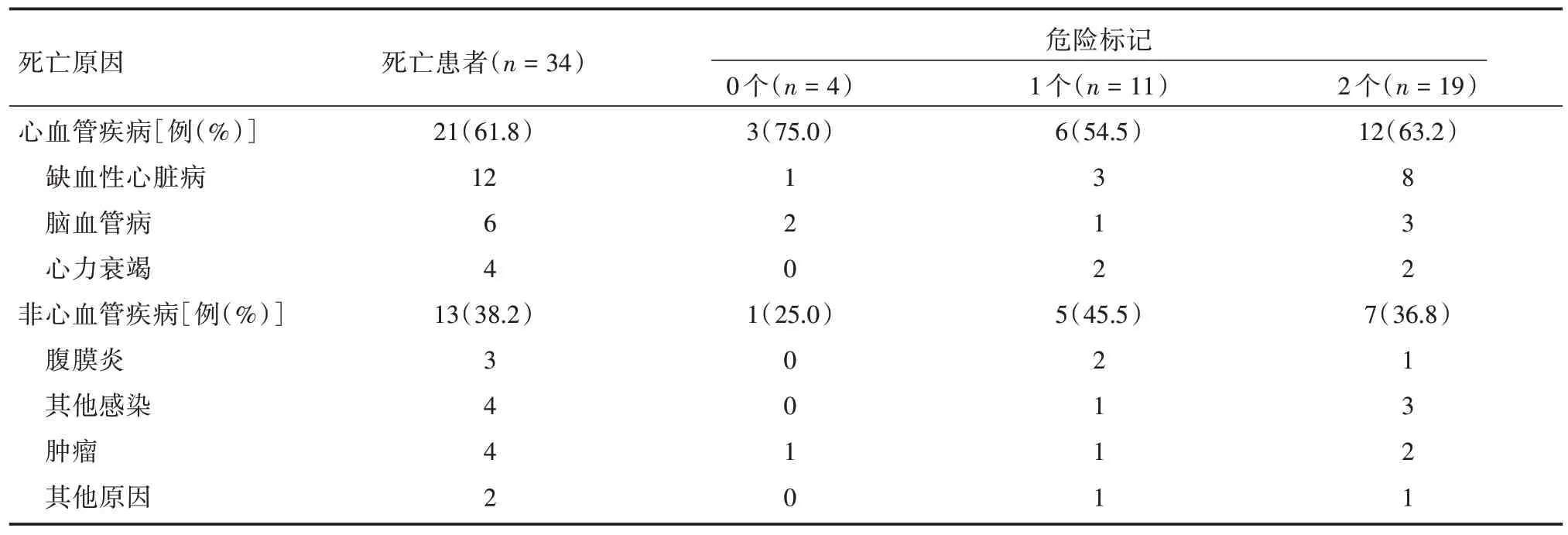
表2 患者的死亡原因Tab.2 Causes of death of included patients 例
采用多变量Cox 回归对混杂协变量包括透析时间、糖尿病、高血压、血磷、LVEF、CRP、低密度脂蛋白、白蛋白、CAS 及CVC 复合标记进行校正后,与无危险标记的患者相比,2 个危险标记的患者的全因死亡HR为8.011(95%CI:2.493~25.741,P= 0.001),心血管死亡的HR为6.734(95%CI:1.643~27.610,P=0.008)。见表3。
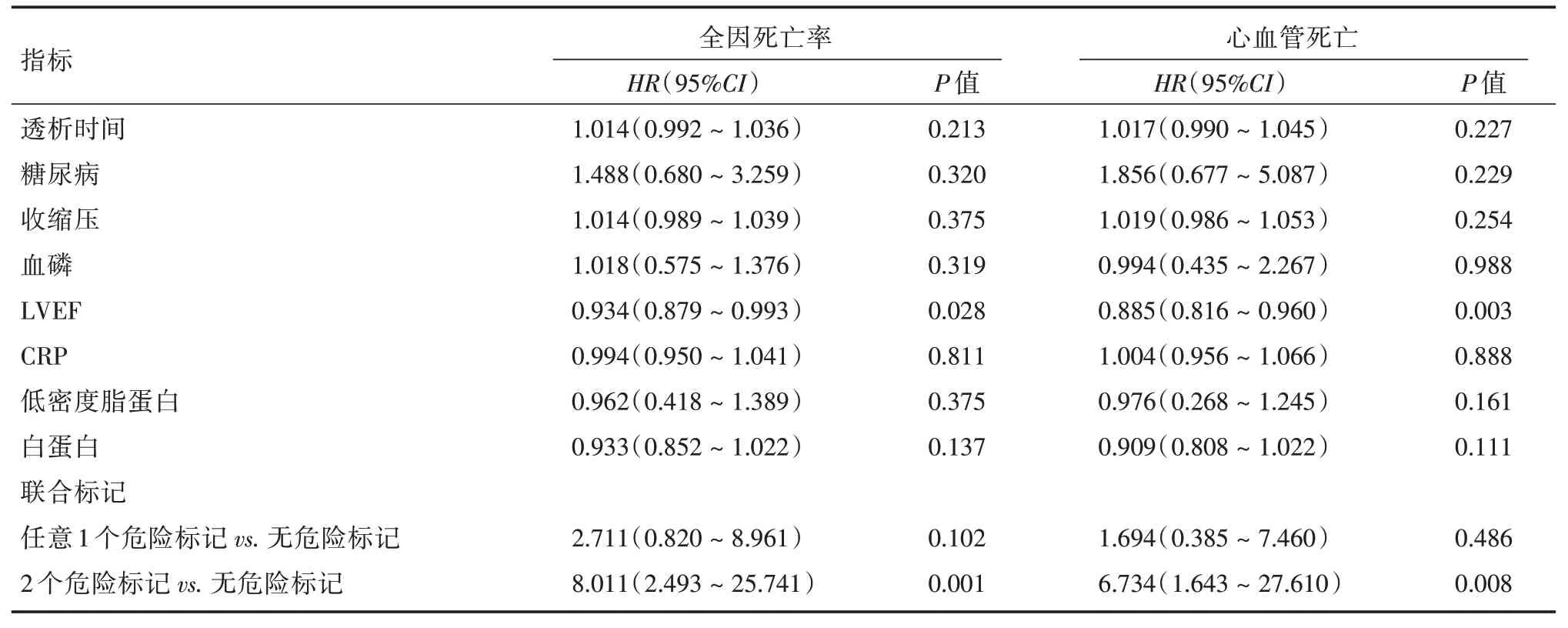
表3 全因死亡和心血管死亡的多因素Cox 回归模型Tab.3 Multivariable Cox regression models for all⁃cause mortality and cardiovascular mortality
进一步采用ROC 曲线评估联合使用上述危险标记对患者预后的预测价值(图2),结果显示与任何1 个单一的危险标记(模型1 和2)比较,联合使用2 个危险标记(模型3)对于全因死亡和心血管死亡的预测能力均有提高。在包含人口统计学、临床基本资料、2 个危险标记后(模型4),预测全因死亡和心血管死亡的预测价值有提高(表4)。

表4 联合CVC、CAS 危险标记的预测价值(ROC 曲线)Tab.4 Predictive value of CVC、CAS risk markers curve analysis(ROC curve)

图2 患者全因生存(A)和心血管事件生存(B)的ROC 曲线Fig.2 ROC curve of overall survival rates(A)and cardiovascular event survival rates(B)
3 讨论
超声心动图对CVC 评估以及彩色多普勒超声对CAS 的评估,在临床上具有操作简单、重复性好、安全无放射性、非侵入性、经济等优点。本研究中采用CVC 及CAS 作为危险标记,经过5年的随访,本研究发现危险标记越多的PD 患者,全因死亡率及心血管死亡率越高。2 个危险标记物联合预测全因死亡和心血管死亡的ROC 曲线下面积(AUC)大于单个危险标记预测结果,在包含人口统计学、临床基本情况、CVC 和CAS 的模型中,相应预测全因死亡和心血管死亡的AUC 增加,提示联合2 个危险标记可以更好地预测PD 患者的全因死亡及心血管死亡风险,能对PD 患者更好地进行全因死亡和心血管死亡危险分层。
CVC 可引发瓣膜关闭不全或狭窄,出现心律失常、心肌缺血或梗死、充血性心力衰竭等并发症,是CKD 患者发生心血管疾病危险因素,也是CKD 患者心血管疾病及全因死亡率的有效预测因子[3],CKD 患者CVC 发病率明显高于普通人群[4]。中国透析钙化研究显示,门诊透析患者CVC 发病率为29.0%,其中血液透析(hemodialysis,HD)患者31.3%,PD 患者为20.9%[5]。本研究中PD 患者CVC 发病率为27.7%,与国内外报道相近。
CKD 患者CVC 的发病机制涉及机械刺激、脂质浸润、氧化应激、炎症、矿物质紊乱及矿化等多方面[6]。既往研究[7-8]显示,年龄、炎症、营养不良、高磷血症、透析龄、血脂异常等是CKD 患者CVC的常见影响因素。存在CVC 的透析患者,往往提示预后不良,有1 个或2 个心脏瓣膜钙化(主要是主动脉瓣和二尖瓣)的患者的全因死亡率的风险增加[9]。本研究发现CVC 为PD 患者全因死亡和心血管死亡的危险因素。
AS 是一种多因素的病理状况,影响中大动脉,是脂质斑块沉积和钙化的结果,颈动脉易于检查,故CAS 可以反映全身动脉动脉粥样硬化的早期病变,而动脉僵硬度增加是预测冠脉事件发生率及心血管死亡率的独立危险因素[10]。CAS 在CKD 患者的发病率比普通人群高,有研究报道在透析患者中发病率为66.3%,其中PD 患者发病率56.4%,HD 患病率73.6%[11]。本研究PD 患者CAS发病率为53.0%,与报道相近。
在ESRD患者中CAS和CVC常常伴发[12]。本研究有38 例(22.9%)PD 患者同时存在CAS 及CVC。目前瓣膜钙化被认为是血管钙化的一种形式,瓣膜钙化和动脉粥样硬化有一些共同的病理生理过程,包括炎性细胞参与、脂蛋白浸润和钙沉积[13]。在动脉粥样硬化病变中,钙化以微钙化(< 5 μm)的形式发生,这是由于细胞凋亡或坏死细胞死亡而引起的钙沉积。当斑块破裂时,这种钙化可发展为大钙化。微钙化在血管疾病的发生和发展中起病理作用[14]。有研究[15]认为CVC 的存在是炎症和弥漫性AS 的表现,瓣膜钙化的严重程度与粥样硬化斑块不稳定程度有显著相关性。CVC 可以帮助识别病灶患者冠状动脉的复杂性和斑块不稳定性。PERROT 等[16]指出脂蛋白a 是一种致AS 的脂蛋白颗粒,类似于低密度脂蛋白的富胆固醇颗粒组成,该颗粒携带大量促炎症和钙化的氧化磷脂,与主动脉瓣钙化有关。DE OLIVEIRA 等[17]指出脂蛋白a、脂蛋白相关磷脂酶A2、氧化磷脂、自噬素以及LPA 基因和NOTCH 基因突变等基因驱动因素在主动脉瓣钙化狭窄中发挥重要作用。ESRD患者除了传统的年龄、炎症、营养不良、高脂血症、高血压、糖尿病、吸烟等危险因素外,还有特殊的危险因素参与,如钙磷代谢紊乱、继发性甲状旁腺功能亢进或低下、氧化应激、尿毒症毒素等。也有研究[13]表明,在CKD 患者中瓣膜或血管中膜钙化的发病机制不同于动脉粥样硬化,ESRD 患者血管钙化组织中存在BMP(bone morphogenetic proteins)沉积,认为血管和瓣膜钙化不仅是一个简单的被动的矿物沉积过程,也是一个活跃的细胞活化过程,而动脉粥样硬化斑块多出现在血管内膜表面斑片状沉积。CKD 进展导致CVC 和AS 的分子和细胞过程尚未完全确定。因此,需要进一步的基础研究来探索其具体机制。
本研究为单中心的回顾性研究,存在一定局限性,且本研究纳入的患者均为住院患者,可能存在选择偏倚。在随访过程中,未考虑患者服药的种类、剂量及使用时长等影响。
综上所述,本研究PD 患者CVC 及CAS 患病率高,CVC 联合CAS 可以更好地预测PD 患者的长期预后,鉴于这些指标在临床易于获取,采用以上2 个危险标记可以更好地对PD 患者进行全因死亡和心血管死亡的危险分层,有助于平衡风险与干预治疗所用的成本,能使高风险患者得到更多临床受益。
