桂枝茯苓丸逆转lncRNA H19介导的miR-195-5p/SGK1通路治疗子宫内膜癌机制研究
2021-09-27张晓芳张宜群
张晓芳 张宜群 王 珩
子宫内膜癌以异常子宫出血为主要临床症状,通常高发于绝经后女性[1]。目前子宫内膜癌的一线疗法包括卵巢、输卵管、子宫和子宫颈切除术或盆腔淋巴结清扫术[2]。但手术切除术不适用于育龄期患者[3]。化学疗法已发展为一种治疗高危和晚期子宫内膜癌患者的重要手段[4]。但化疗药物毒性大、副作用强、易产生耐药性,严重影响患者身心健康[5]。桂枝茯苓丸出自《金匮要略》,由桂枝、茯苓、丹皮、芍药、桃仁组成,具有活血化瘀、破癥散结、理气镇痛等功效。桂枝茯苓丸联合培美曲塞和奈达铂治疗晚期子宫内膜癌的疗效较好且不良反应较轻[6],但其作用机制尚待进一步阐明。本研究观察桂枝茯苓丸对子宫内膜癌细胞病理学功能的影响及其作用机制,报道如下。
1 实验材料
1.1 细胞株 从美国模式培养物集存库购得人子宫内膜癌细胞系HEC-1A(批号)、HEC-1B(批号)和人正常子宫内膜细胞系hESC(批号),Ishikawa细胞(批号CL-0283)则购买于武汉普诺赛生命科技有限公司。
1.2 药物 桂枝茯苓丸由桂枝、茯苓、丹皮、赤芍、桃仁各9g 组成,中药饮片购自浙江省中医院。将药材加10 倍水浸泡30min 后煎2 次,每次大火煎开后小火煎2h,合并2 次煎液并浓缩至2000mL,加入等量95%乙醇使药渣沉淀,弃掉药渣,浓缩至黏稠状后真空干燥,取干燥药物用培养基配置成2700μg/mL的桂枝茯苓丸含药培养液,用0.22μM 无菌滤器过滤后4℃保存,详细流程参考文献[7]的方法。
1.3 试剂 RPMI 1640 培养基(批号11875)、胎牛血清(批号s9030)、BCA 蛋白质测定试剂盒(批号PC0020-500)、TRIzol(批号15596026)、电泳缓冲液(批号T1070)和TBST 缓冲液(批号T1085)均购于北京索莱宝科技有限公司;青霉素链霉素(批号15140148)和M-MLV 逆转录酶(批号C28025-014)购自美国invitrogen;ECL 化学发光试剂盒(批号P0018M)和增强型CCK8 试剂盒(批号C0042)购自上海碧云天生物技术有限公司;Annexin V-FITC/PI荧光双染细胞凋亡检测试剂盒(批号P-CA-202)购买于武汉普诺赛生命科技有限公司;双荧光素酶报告基因检测系统购自Promega(批号fa231654);兔多克隆SGK1 抗体(批号ab32374),兔单克隆抗体P62(批号ab109012)、Beclin1(批号ab210498)、LC3II(批号ab192890)和山羊抗兔IgG H&L(批号ab205718)购自艾博抗(上海)贸易有限公司。lncRNA H19 的段发夹RNA(sh-H19)和其阴性对照(sh-NC),H19 的过表达载体(oe-H19)和oe-NC 均购买于海吉玛制药技术有限公司。
1.4 仪器 Eppendorf CellXpert C170 CO2培养箱,德国Eppendorf 公司;751 型分光光度计,美国伯腾仪器有限公司;超净工作台BSC-1004IIA2,苏州安泰空气技术有限公司;Applied Biosystems ABI 7500,美国赛默飞世尔科技公司;Gel Doc EZ 凝胶成像分析仪,美国Bio-Rad 公司;-80℃超低温冰箱DW-86L100J,青岛海尔生物医疗股份有限公司。
2 实验方法
2.1 细胞培养 HEC-1A、HEC-1B、Ishikawa和人正常子宫内膜细胞系hESC 用含有10%胎牛血清、100U/mL 青霉素和100g/mL 链霉素的RPMI 1640 培养基培养,而HEK-293T细胞则用DMEM 培养基培养,所有细胞置于5%CO2、37℃的潮湿培养箱中培养,待细胞融合至90%进行传代。
2.2 qRT-PCR 测定RNA 水平 取对数生长期的Ishikawa细胞,加入TRIzol 室温放置5~8min 使细胞裂解。加入氯仿,静置后离心取上清。收集上面的水样层后,加入异丙醇沉淀RNA。使用M-MLV 逆转录酶将RNA 逆转录为cDNA。使用SYBR Premix Ex Taq 在Applied Biosystems ABI 7500 实时PCR 操作系统上进行qRT-PCR。其中miR-195-5p 以U6 为内参归一化处理,lncRNA H19和SGK1 以GAPDH 为内参。合成的寡聚体DNA 以OD260 为单位来表示。通过2-ΔΔCt方法来比较对照组和实验组的目的基因相对表达量的差异。引物由北京擎科生物科技有限公司合成。引物序列如下:lncRNA H19 上游引物:5'-ATCGGTGCCTCAGCGTTCGG-3',下游引物:5'-TCCAGAATGCCAAATCGGCT-3';SGK1 上游引物:5'-AGGATGGGTCTGAACGACTTT-3',下游引物:5'-GCCCTTTCCGATCACTTTCAAG-3';GAPDH 上游引物:5'-GGAGCGAGATCCCTCCAAA-AT-3';下游引物:5' -GGCTGTTGTCATACTTCTCATGG -3';miR -195-5p 上游引物:5′-GGGGTAGCAGCACAGAAAT-3′;下游引物:5′-TCCAGTGCGTGTCGTGGA-3′;U6上游引物:5'-TGCGGGTGCTCGCTTCGGCAGC-3';下游引物:5'-GTGCAGGGTCCGAGGT-3'。
2.3 免疫印迹法(Western blot)检测SGK1 蛋白表达水平 用PBS 洗涤细胞,使用含有蛋白酶抑制剂的蛋白裂解液提取细胞总蛋白,BCA 蛋白定量试剂盒检测蛋白质浓度并制作Western blot 上样样本。取20μg 蛋白样本利用SDS 聚丙烯酰胺凝胶分离,并转膜至PVDF 膜上。使用以下抗体进行Western blot:一抗兔多克隆抗体SGK1、GAPDH、P62、Beclin1和LC3II。二抗山羊抗兔IgG H&L。最后使用ECL 试剂盒进行显影,并用凝胶成像仪分析蛋白条带。
2.4 CCK8 法测定细胞增殖活性 在96 孔板中接种100μL 浓度为4×103个/mL 的Ishikawa细胞悬液。培养24h 后,按实验分组要求将孔内培养液更换为含药培养液,再分别培养72h 后,将10μL CCK8 溶液添加到每个孔中。使用酶标仪在450nm 处测量吸光度。
2.5 双荧光素酶报告基因检测lncRNA H19与miR-195-5p 及miR-195-5p与SGK1 的结合 用H19-WT/SGK1-WT 或H19-MUT/SGK1-MUT的荧光素酶报告质粒与miR-195-5p mimic 或NC mimic共转染HEK-293T细胞,同时加药组用终浓度为200μg/mL 的桂枝茯苓丸溶液处理。转染后48h 裂解细胞,并使用双荧光素酶报告试剂盒检测相对荧光素酶活性。
2.6 流式细胞仪检测细胞凋亡 取待检测细胞,胰酶消化为单细胞悬液,按照Annexin V-FITC/PI 凋亡细胞试剂盒说明书对细胞染色,并使用流式细胞仪在60min 内检测,cellquest 软件分析细胞凋亡百分比。
2.7 统计学方法 应用SPSS 11.0 统计软件分析所有数据,计量资料以均数±标准差(±s)表示,每项实验重复3 次。多组比较采用单因素方差分析,两组间比较采用非配对双尾t 检验,P<0.05 认为差异有统计学意义。
3 实验结果
3.1 lncRNA H19 对子宫内膜癌细胞增殖、凋亡和自噬的影响 我们进行qRT-PCR 实验检测lncRNA H19 在子宫内膜癌细胞和人正常子宫内膜细胞的表达,观察到子宫内膜癌细胞HEC-1A、HEC-1B、Ishikawa 中lncRNA H19 的RNA 水平显著高于人正常子宫内膜细胞EMC(P<0.05 或P<0.01)(见表1)。为了确定H19 在子宫内膜癌细胞增殖中的作用,在Ishikawa细胞敲低H19 的表达,通过CCK8 实验评估细胞的增殖活性,结果显示,敲低lncRNA H19 后细胞的增殖能力显著降低(P<0.05)(见表2)。通过流式细胞术检测细胞的凋亡情况,结果如表3和图1所示,sh-H19 组的细胞凋亡率较对照组明显增加(P<0.05)。通过Western blot 对自噬标志蛋白P62、Beclin1和LC3II表达进行检测发现,与对照组比较,敲低H19 的Ishikawa细胞P62表达降低,Beclin1和LC3II表达增强,见图2。

图2 Western blot 检测敲低lncRNA H19 对自噬相关蛋白P62、Beclin1和LC3II表达的影响
表1 lncRNA H19 在人正常子宫内膜细胞和子宫内膜癌细胞表达(±s)

表1 lncRNA H19 在人正常子宫内膜细胞和子宫内膜癌细胞表达(±s)
注:与EMC细胞比较,aP<0.05,aaP<0.01
表2 敲低lncRNA H19 后Ishikawa细胞增殖活性变化(%,±s)

表2 敲低lncRNA H19 后Ishikawa细胞增殖活性变化(%,±s)
注:对照组为转染sh-NC 的Ishikawa细胞;sh-H19 组为敲低lncRNA H19表达组;与对照组比较,aP<0.05
表3 敲低lncRNA H19 后Ishikawa细胞凋亡率变化(%,±s)
注:对照组为转染sh-NC 的Ishikawa细胞;sh-H19 组为敲低lncRNA H19表达组;与对照组比较,aP<0.05
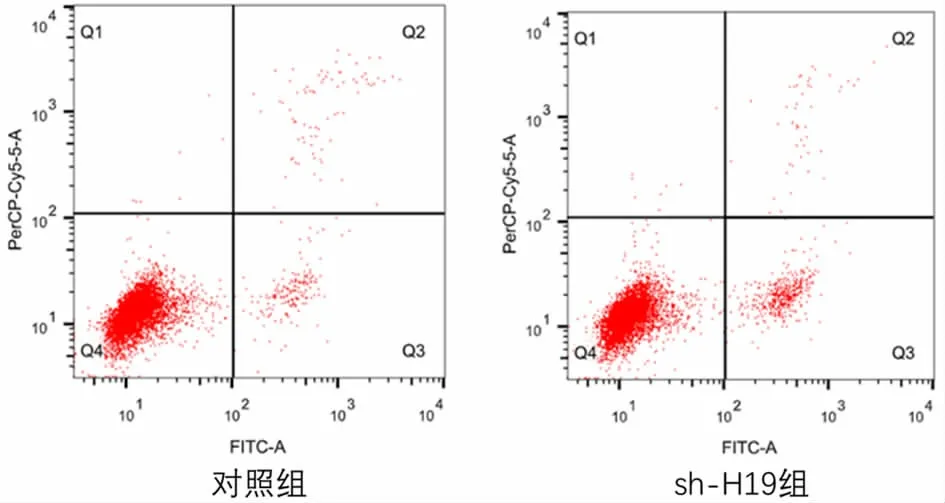
图1 敲低H19 对Ishikawa细胞凋亡的影响
3.2 lncRNA H19 作为分子海绵吸附并调控miR-195-5p表达 由于lncRNA 可作为分子海绵吸附miRNA[8]。因此我们对lncRNA 的靶miRNA 进行预测,miR-195-5p和H19 3'UTR 之间有7nt 的结合位点(见图3)。双荧光素酶报告基因检测miR-195-5p和lncRNA H19 的结合关系,与NC mimic+H19-WT组比较,miR-195-5p mimic+H19-WT 组的荧光素酶活性显著降低(P<0.05),表明lncRNA H19 海绵吸附miR-195-5p(见表4)。此外,在敲低lncRNA H19 后检测Ishikawa细胞miR-195-5p 水平,与对照组比较,敲低lncRNA H19 后miR-195-5p表达上调(P<0.05),见表5。
表5 qRT-PCR 检测敲低lncRNA H19 对miR-195-5p表达的影响(±s)
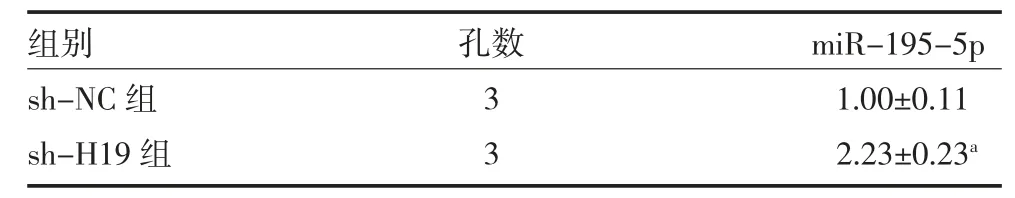
表5 qRT-PCR 检测敲低lncRNA H19 对miR-195-5p表达的影响(±s)
注:sh-NC 为敲低对照组;sh-H19 组为敲低lncRNA H19表达组;与sh-NC 组比较,aP<0.05

图3 miR-195-5p与H19 3'UTR 的结合位点
表4 双荧光素酶报告基因验证lncRNA H19与miR-195-5p 的靶向结合(±s)

表4 双荧光素酶报告基因验证lncRNA H19与miR-195-5p 的靶向结合(±s)
注:NC mimic+H19-WT 组为共转染NC mimic和野生型lncRNA H19的293T细胞;miR-195-5p mimic+H19-WT 组为共转染miR-195-5p mimic和野生型lncRNA H19 的293T细胞;NC mimic+H19-MUT 组为NC mimic和突变型lncRNA H19 共转染的293T细胞;miR-195-5p mimic+H19-MUT 组为miR-195-5p mimic和突变型lncRNA H19共转染的293T细胞;与NC mimic+H19-WT 组比较,aP<0.05
3.3 miR-195-5p 靶向调节SGK1表达 为进一步探究lncRNA H19 调控机制,通过starBase 对miRNA的靶基因进行预测,发现miR-195-5p 能够与SGK1的3'UTR 结合(见图4)。通过双荧光素酶报告基因检测系统对该预测结果进行验证,结果显示,miR-195-5p mimic 能够显著降低SGK1-WT 报告基因的荧光素酶活性(P<0.05),但不影响SGK1-MUT 报告基因的活性(见表6)。为验证并揭示miR-195-5p和SGK1 的靶向调控关系,首先我们在转染miR-195-5p mimic 的Ishikawa细胞以及转染NC mimic 的Ishikawa细胞检测SGK1 mRNA和蛋白表达水平,从表7和图5 可以看出miR-195-5p mimic 组Ishikawa细胞SGK1 mRNA和蛋白水平下调(P 均<0.05)。
表6 双荧光素酶报告基因检测miR-195-5p与lncRNA H19 的靶向结合关系(±s)

表6 双荧光素酶报告基因检测miR-195-5p与lncRNA H19 的靶向结合关系(±s)
注:NC mimic+SGK1-WT 组为NC mimic和野生型SGK1 共转染的293T细胞;miR-195-5p mimic+SGK1-WT 组为miR-195-5p mimic和野生型共转染的293T细胞;NC mimic+SGK1-MUT 组为NC mimic和突变型SGK1 共转染的293T细胞;miR-195-5p mimic+SGK1-MUT 组为miR-195-5p mimic和突变型SGK1 共转染的293T细胞;与NC mimic+SGK1-WT 组比较,aP<0.05
表7 过表达miR-195-5p 对SGK1 mRNA表达的影响(±s)

表7 过表达miR-195-5p 对SGK1 mRNA表达的影响(±s)
注:NC mimic 组为转染NC mimic 的Ishikawa细胞;miR-195-5p mimic 组为转染miR-195-5p mimic 的Ishikawa细胞;与NC mimic组比较,aP<0.05
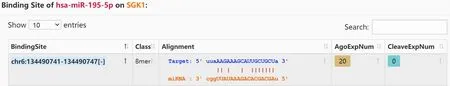
图4 starBase 预测SGK1与miR-195-5p 的结合位点
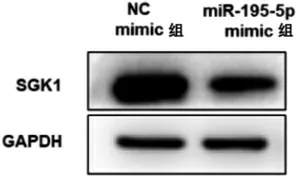
图5 过表达miR-195-5p 对SGK1 蛋白表达的影响
3.4 桂枝茯苓丸逆转lncRNA H19 对子宫内膜癌细胞增殖和自噬的影响 为了明确桂枝茯苓丸在lncRNA H19介导的子宫内膜癌中的作用,设置oe-NC 组、oe-H19 组、oe-H19+桂枝茯苓丸组。qRT-PCR检测结果显示,与oe-NC 组比较,oe-H19 组Ishikawa细胞lncRNA H19 的含量显著增高(P<0.01),而桂枝茯苓丸能够逆转oe-H19 转染引起的lncRNA H19 水平上升(P<0.05)(见表8)。采用CCK8 法检测细胞的增殖活力,oe-H19 组细胞存活率较oe-NC 组显著增高(P<0.05)(见表9)。将转染oe-H19 的Ishikawa细胞在桂枝茯苓丸含药培养液中培养后,发现与oe-H19 组比较,经桂枝茯苓丸含药培养液处理的Ishikawa细胞的增殖活性显著降低(P<0.05)。细胞凋亡测定结果显示,过表达lncRNA H19 降低细胞的凋亡率,桂枝茯苓丸可以缓解oe-H19 对细胞凋亡率的下调(见图6、表10)。Western blot 结果显示,与oe-NC 组比较,oe-H19 组Ishikawa细胞P62表达显著增加,Beclin1和LC3II表达显著下调,表明细胞自噬被抑制,而经桂枝茯苓丸含药培养液处理则能逆转oe-H19 对自噬的抑制作用,见图7。

图6 流式细胞术检测桂枝茯苓丸对细胞凋亡的影响

图7 Western blot 检测桂枝茯苓丸对lncRNA H19 调控的细胞自噬标志蛋白表达的影响
表8 qRT-PCR 检测桂枝茯苓丸对Ishikawa细胞lncRNA H19表达的影响(±s)

表8 qRT-PCR 检测桂枝茯苓丸对Ishikawa细胞lncRNA H19表达的影响(±s)
注:oe-H19 为在Ishikawa细胞过表达lncRNA H19;oe-H19+桂枝茯苓丸组为在Ishikawa细胞过表达lncRNA H19 并用桂枝茯苓丸含药培养液培养;与oe-NC 组比较,aP<0.01;与oe-H19 组比较,bP<0.05
表9 CCK8 检测桂枝茯苓丸对lncRNA H19 诱导的细胞增殖作用的影响(%,±s)

表9 CCK8 检测桂枝茯苓丸对lncRNA H19 诱导的细胞增殖作用的影响(%,±s)
注:oe-H19 组为在Ishikawa细胞过表达lncRNA H19;oe-H19+桂枝茯苓丸组为在Ishikawa细胞过表达lncRNA H19 并用桂枝茯苓丸含药培养液培养;与oe-NC 组比较,aP<0.05;与oe-H19 组比较,bP<0.05
表10 流式细胞术检测桂枝茯苓丸对细胞凋亡的影响(%,±s)

表10 流式细胞术检测桂枝茯苓丸对细胞凋亡的影响(%,±s)
注:oe-H19 组为在Ishikawa细胞过表达H19;oe-H19+桂枝茯苓丸组为在Ishikawa细胞过表达lncRNA H19 并用桂枝茯苓丸含药培养液培养;与oe-NC 组比较,aP<0.05;与oe-H19 组比较,bP<0.05
4 讨论
多项研究表明,lncRNA 是肿瘤起始和发展的重要调控因子[9]。然而,大多数lncRNA 由于保守性差、丰度差异等原因难以表征,只有高度保守、稳定且丰富的lncRNA 才有可能成为潜在的肿瘤生物标志物和治疗靶点[10]。本研究主要对高度保守的lncRNA H19 在子宫内膜癌细胞表达和功能进行探索,通过qRT-PCR 发现lncRNA H19 在子宫内膜癌细胞高表达,较其在正常子宫内膜细胞的表达差异较为显著。这也与lncRNA H19 在其他21种癌症类型中的表达趋势一致[11]。CCK8 实验结果显示,敲低lncRNA H19 有效降低Ishikawa细胞的增殖能力(P<0.05)。流式细胞术结果显示,敲低lncRNA H19 可促进细胞凋亡(P<0.05)。在自噬过程中,细胞质LC3I 转化为LC3II。因此,LC3II/LC3I 比率通常用作自噬的定量指标[12]。Beclin-1和P62 在自噬调节中具有重要作用,是自噬检测的常用标记物[13]。本研究通过qRT-PCR和Western blot 发现,敲低lncRNA H19 的Ishikawa细胞P62 异常低表达,Beclin1和LC3II 异常高表达。提示敲低lncRNA H19 可抑制Ishikawa细胞增殖,促进细胞凋亡和自噬。
lncRNA 最常见的调节机制是通过与miRNA 相互作用调控miRNA 下游靶基因的表达[14]。lncRNA H19 在不同癌症中也通过调节不同的miRNA/mRNA轴来参与癌症进展。本研究通过靶向预测发现,miR-195-5p与lncRNA H19 具有结合位点,且双荧光素报告基因检测和Western blot 结果也证明了lncRNA H19 靶向负调控miR-195-5p 的表达。通过starBase预测到miR-195-5p 能够与SGK1 的3'UTR 结合,同时双荧光素酶报告基因检测和Western blot 验证了miR-195-5p 对SGK1 的靶向负调控作用。上述结果表明,lncRNA H19 对子宫内膜癌细胞增殖和自噬的作用可能是通过调控miR-195-5p/SGK1 轴实现的,对该通路进行抑制可能会有效抑制子宫内膜癌的发展。
综上所述,桂枝茯苓丸能够有效抑制lncRNA H19 对子宫内膜癌细胞增殖的促进和对凋亡及自噬的抑制作用。这种作用可能是通过调控lncRNA H19/miR-195-5p/SGK1 轴实现的。
