Rb荧光素酶报告基因检测系统构建及检测能力评估
2021-05-15杨泽健田碧霞宋少苒高小倩刘培军
王 博,杨泽健,张 妙,田碧霞,宋少苒,孙 伟,高小倩,周 灿,刘培军
(1. 西安交通大学第一附属医院转化医学中心,陕西西安 710061;2. 陕西省肿瘤精准医学重点实验室,陕西西安 710061;3.西安交通大学第一附属医院乳腺外科,陕西西安 710061)
Rb基因即视网膜母细胞瘤基因(retinoblastoma gene),是发现最早、并被鉴定出的抑癌基因。Rb基因的突变可导致眼部恶性视网膜母细胞瘤,在随后的研究中不断地发现在其他肿瘤组织中常处于突变状态,包括常见的小细胞肺癌、乳腺癌以及视网膜母细胞瘤等[1-2]。Rb蛋白主要通过参与细胞周期的调控从而发挥其抑癌作用[3],但其功能的失活将影响细胞周期的调控,从而参与肿瘤的发生发展过程。尽管如此,但Rb在癌症中持续性丢失的分子和细胞基础仍不十分清楚[4]。因此,构建一种易于检测的报告基因系统对于研究Rb基因与肿瘤发生的关系和筛选靶向治疗药物具有重要意义。
报告基因(reporter gene)是一类可以编码荧光蛋白或酶,从而将看不见的底物转化为发光或彩色产物的一类基因,是生物医学领域基础研究的一个重要工具,广泛应用于检测细胞的信号转导和基因表达。通过在报告基因上附加元件来调节报告基因的活性,利用光学成像技术实时报告其表达的位置或水平,使了解疾病的分子基础和体外药物研发成为可能[5]。本实验选择以荧光素酶作为报告基因构建Rb检测系统,为深入研究肿瘤的发生机制,促进肿瘤的靶向治疗研究提供有效工具。
本研究通过经典的分子克隆技术,构建出含有特异性Rb反应元件的Rb报告基因载体,使其转染HEK293细胞并筛选稳定表达Rb的单克隆细胞株,最终在该报告基因检测系统中通过监测Rb的激活和抑制作用评估该系统的检验效能,为Rb基因表达产物的活性检测提供可靠的依据,也为Rb基因异常的靶向治疗研究和疗效评估提供实验基础。
1 材料与方法
1.1 主要试剂与材料基因序列合成Rb反应元件(擎科生物科技有限公司);高速高保真PCR酶(TaKaRa公司);XhoⅠ、HindⅢ内切酶(NEB公司);DNA凝胶回收试剂盒、质粒提取试剂盒、无内毒素质粒提取试剂盒和E.coliDH5α宿主菌(天根生化科技有限公司);pGL6-TA报告基因载体(碧云天生物技术有限公司);DMEM高糖培养基(康宁公司);胎牛血清(Hyclone公司);X-tremeGENE HP转染试剂(Roche公司);T4连接酶、Dual-Luciferase Reporter Assay System(Promega公司);CDK4/6抑制剂Palbociclib(Selleck公司)。人肾上皮细胞系HEK293由西安交通大学第一附属医院转化医学中心进行保种。
1.2 报告基因pGL6-Rb-Luc载体的构建按照经典的分子克隆方法,将Rb反应元件克隆到报告基因载体中,形成Rb荧光素酶报告基因载体,该载体具体结构见图1。将Rb反应元件序列通过PCR仪缓慢降温,最终退火形成具有黏性末端的双链DNA序列(表1)。PCR仪退火程序的反应体系:Rb反应元件上游序列和下游序列各2 μL,5 ×Annealing Buffer 10 μL,ddH2O 36 μL;PCR仪中缓慢降温进行退火程序。从菌液中提取报告基因pGL6-TA质粒,再通过XhoⅠ和HindⅢ 37 ℃双酶切2 h,凝胶电泳后胶回收纯化载体pGL6-TA的双酶切产物。使用T4连接酶将双酶切产物和退火产物进行DNA连接,再运用热激法将上述连接产物转化E.coliDH5α感受态,37 ℃培养1 h后涂布LB平板(氨苄青霉素Amp抗性),37 ℃倒置培养过夜,其中需要分别设置ddH2O为阴性对照组以及对照质粒pUC19为阳性对照组。次日观察单克隆菌落生长情况,挑单克隆并进行液体培养扩增。对液体培养起来的菌液再进行菌液PCR鉴定,鉴定上游引物5′-CTAGCAAAATAGGCTGTCCC-3′,下游引物5′-CCCGCGCGCCACCCCTC-TGGCGCCACCGTG-3′。对菌液PCR鉴定阳性克隆,送其质粒至测序公司进行鉴定,测序结果进行比对后命名比对序列完全正确的载体为pGL6-Rb-Luc。

表1 Rb反应元件和TA启动子序列
1.3 质粒pGL6-Rb-Luc转染HEK293细胞将pGT6-TA和pGL6-Rb-Luc菌液进行扩大培养,分别提取无内毒素的对照载体pGT6-TA和Rb报告基因载体pGL6-Rb-Luc。将人肾上皮HEK293细胞按照合适的密度接种于细胞培养6孔板中,并使用完全培养基进行培养。接种细胞24 h后,将X-tremeGENE HP转染试剂分别与质粒pGT6-TA和pGL6-Rb-Luc进行混合,静置后分别转染HEK293细胞。
1.4 Rb报告基因稳定表达单克隆细胞株的筛选细胞转染48 h后,加入终质量浓度为1 mg/mL的遗传霉素对细胞进行抗性筛选,要求每2 d换1次新鲜的抗性培养基,并持续筛选2周以上以便得到稳定表达的单克隆细胞。将该部分混合克隆进行细胞消化,通过分选型流式细胞仪分选单细胞并正常抗性培养,对生长起来的单克隆细胞随后进行正常传代、扩大培养,并命名稳定表达对照质粒pGT6-TA的单克隆细胞株为HEK293-Luc,稳定表达Rb报告基因质粒pGL6-Rb-Luc的单克隆细胞株为HEK293-Rb-Luc。
1.5 报告基因细胞株HEK293-Rb-Luc激活作用的检测将上述构建好的对照细胞株HEK293-Luc和报告基因细胞株HEK293-Rb-Luc细胞消化后,分别细胞计数并按相同细胞密度接种96孔板。待孔板中细胞贴壁后,更换无血清培养基饥饿培养24 h。随后添加胎牛血清进行血清刺激培养,分别在0、6、12、24 h不同时间点,检测相对应的荧光素酶发光值,并设置5个复孔/组。
1.6 报告基因细胞株HEK293-Rb-Luc抑制作用的检测按照上述同样的条件和方法接种细胞,接种24 h后撤除血清饥饿培养24 h。随后同时加入血清和浓度分别为0、25、50、75和100 nmol/L的CDK4/6抑制剂Palbociclib[6]共同刺激细胞12 h,按照上述相同的方法检测发光值,并设置5个复孔/组。
1.7 统计学分析使用SPSS 23.0统计学分析软件对数据进行分析,数据表示为均值±标准差,各组间比较采用单因素方差分析(One-Way ANOVA),组内两两比较采用LSD(t)检验,P<0.05为差异有统计学意义。
2 结 果
2.1 构建Rb报告基因载体pGL6-Rb-Luc将退火反应后双链具有黏性末端的Rb反应元件连接至双酶切报告基因pGL6 -TA载体多克隆位点区,转化感受态细胞后挑取单克隆进行培养,对挑取的每个菌液进行菌液PCR鉴定。PCR反应后产物通过15 g/L的琼脂糖凝胶电泳鉴定,PCR产物大小为153 bp,与理论插入Rb反应元件序列大小相同(图2)。将菌液PCR鉴定阳性的菌液送公司进行测序分析,再将测序结果通过在线的BLAST(NCBI)进行比对,比对结果表明阳性克隆插入序列与Rb反应元件序列相一致,故已成功构建Rb报告基因载体pGL6-Rb-Luc。

图2 报告基因载体pGL6-Rb-Luc的菌液PCR鉴定结果
2.2 构建Rb报告基因稳定表达单克隆细胞株HEK293-Rb-Luc将报告基因对照载体pGL6-TA和Rb报告基因载体pGL6-Rb-Luc分别转染HEK293细胞,再通过G418抗性筛选以及流式细胞仪分选单细胞培养,故已获得稳定表达报告基因的对照单克隆细胞株HEK293-Luc以及稳定表达Rb报告基因的单克隆细胞株HEK293-Rb-Luc。先将这两株单克隆细胞株撤除血清饥饿处理,再回补血清进行刺激,在不同时间点分别检测荧光素酶的活性。结果显示,恢复血清培养6、12、24 h后HEK293-Rb-Luc细胞中荧光素酶的活性显著升高,相比于0 h的HEK293-Rb-Luc组荧光素酶活性分别升高了5.2、18.9和9.8倍,且差异有统计学意义(P<0.001,图3)。
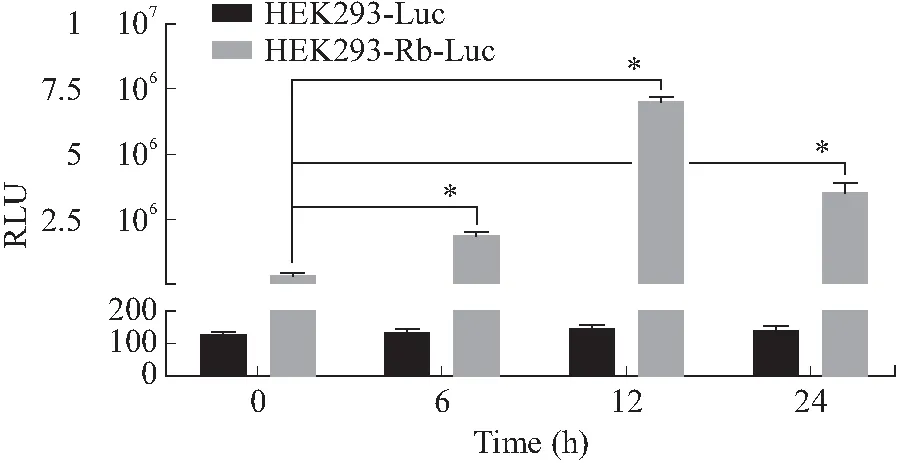
图3 血清刺激不同时间点对HEK293-Rb-Luc单克隆细胞的作用
而对照细胞HEK293-Luc在血清刺激后的6、12、24 h,荧光素酶活性与0 h相比无显著性变化,即组间无统计学差异。该结果说明构建的HEK293-Rb-Luc可以有效的检测Rb活化,故已成功筛选出检测Rb活化的荧光素酶报告基因系统。
2.3 验证Rb荧光素酶报告基因系统的检测能力使用CDK4/6抑制剂Palbociclib检验Rb荧光素酶报告基因系统的检测能力,将HEK293-Rb-Luc细胞株撤除血清处理24 h后,再加入血清和0、25、50、75、100 nmol/L的CDK4/6抑制剂Palbociclib后共同培养12 h检测相应的荧光素酶活性。结果显示,与未加血清组相比,恢复血清培养后各组的荧光素酶活性显著升高,其中加入0 nmol/L CDK4/6抑制剂Palbociclib组的荧光素酶活性升高20.1倍;在同时添加血清和CDK4/6抑制剂Palbociclib的几组中,相比于0 nmol/L Palbociclib组,其余各组荧光素酶的活性均显著降低,Rb活性的抑制率在25 nmol/L Palbociclib组为6.90%,在50 nmol/L Palbociclib组为40.23%,在75 nmol/LPalbociclib组为50.57%,在100 nmol/L Palbociclib组为62.07%,差异具有统计学意义(P<0.05,P<0.001,图4)。通过检测恢复血清对HEK293-Rb-Luc细胞株Rb基因的激活作用和CDK4/6抑制剂Palbociclib对Rb基因的抑制作用,结果说明已构建的Rb荧光素酶报告基因系统HEK293-Rb-Luc细胞株可以精准、有效地检测Rb活性从而反映Rb活化程度。
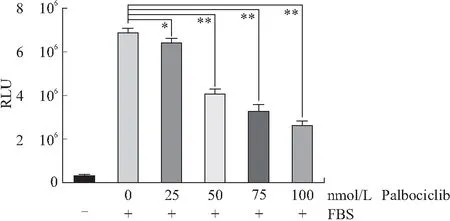
图4 CDK4/6抑制剂Palbociclib对HEK293-Rb-Luc单克隆细胞株的抑制作用
3 讨 论
细胞周期蛋白依赖激酶(cyclin-dependent kinases, CDK)是磷酸化Rb蛋白的主要激酶,在细胞G1末期细胞周期蛋白介导CDK与Rb蛋白三者相互作用形成复合物,进而让CDK磷酸化Rb蛋白,使得Rb蛋白释放转录因子E2F;E2F进入细胞核后,可以转录激活一系列周期相关蛋白的表达,包括二氢叶酸还原酶(dihydrofolate reductase, DHFR)、胸苷激酶(thymidine kinase, TK)、胸苷酸合成酶(thymidylate synthase, TS)、DNA聚合酶α(DNA polymerase, POL)、CDC2、cyclin E、cyclin A和E2F1等,这些周期相关蛋白的表达使得细胞从G1期移型至S期[4,7]。Rb蛋白的磷酸化状态一直维持到细胞完成分裂并进入到下一个细胞周期时,Rb再次去磷酸化并结合到E2F上[8]。同时,Rb蛋白还可以通过参与p16/Rb信号通路诱导细胞老化现象,是因为P16INK4A通过抑制CDK4/6对Rb蛋白的磷酸化,使得E2F和Rb蛋白结合无法入核发挥其功能,最终阻止细胞进入S期,进而导致细胞的老化[9]。但目前关于Rb的活性形式仍然存在一些争议。DOWDY等[10]发现,Rb在G1早期被cyclin D和CDK4/6单磷酸化,表现出优先的E2F结合模式,但在G1晚期,cyclin E和CDK2通过磷酸化使Rb失活,发生DNA损伤反应的细胞激活cyclin D和Cdk4/6,产生单磷酸化Rb,调控全局转录,而分化的细胞则利用未磷酸化的Rb。
特异性分子靶向药物具有治疗靶点明确,治疗效果明确以及对正常组织损伤较小等特点,故近年来被广泛应用到肿瘤临床治疗中[11]。Rb通路与癌症发展之间的密切联系表明,Rb活性状态的调控可能被用于开发靶向治疗[12]。较多的研究发现在几乎所有恶性肿瘤中CDK-Rb-E2F通路都发现了显著的变化,目前最新的CDK4/6抑制剂可使细胞周期恢复正常,并在治疗雌激素受体阳性乳腺癌中得到了很好地应用[4,13]。然而,导致临床上部分患者对CDK4/6抑制剂耐药的因素尚不清楚。CONDORELLI等[14]研究中发现,转移性乳腺癌患者暴露于帕博西林或瑞博西林后反而出现了Rb基因的突变,但这些突变是如何在CDK4/6抑制剂的选择压力下出现的仍有待进一步研究。肿瘤对靶向药物的耐药性也可能与非典型的Rb通路有关[12,15]。也有研究发现,Rb重新激活让晚期肿瘤经重编程后转向转移能力较弱的细胞状态,但是由于MAPK通路信号转导的适应性重新连接而不能够阻止癌细胞增殖和肿瘤生长[3]。生物体内的信号转导是一个复杂的联动过程,分子靶向治疗在关注某一生物分子的靶向作用时,容易因忽视整个机体对药物的反应而产生更多的不良反应[16]。
肿瘤发生发展过程中Rb及其相关通路尚不完全明晰、分子靶向治疗依然存在的缺陷,都使得探明肿瘤的发生机制、寻找更精准有效的治疗方法显得尤为重要。而报告基因作为生物医学领域基础研究的常用工具,也是有效靶点前期筛选的重要步骤。目前常见的荧光素酶、各种不同颜色的荧光蛋白以及β半乳糖苷酶等报告基因应用最为广泛,而其中荧光素酶报告基因相比其他报告基因具有灵敏度高、检测效率高、操作方便等优势[17]。
本研究通过构建带有Rb反应元件序列的报告基因载体pGL6-Rb-Luc,转染HEK293细胞后,通过G418抗性筛选出稳定表达Rb报告基因的单克隆细胞株HEK293-Rb-Luc,并使用血清刺激和CDK4/6抑制剂Palbociclib检验HEK293-Rb-Luc的激活和抑制作用。相比于0 h,恢复血清培养6、12、24 h后HEK293-Rb-Luc细胞中荧光素酶的活性分别升高了5.2、18.9和9.8倍。相比于0 nmol/L Palbociclib组,25、50、75和100 nmol/L的CDK4/6抑制剂Palbociclib使Rb活性的抑制率分别达到6.90%、40.23%、50.57%和52.07%。因此,本研究已成功构建并筛选出Rb荧光素酶报告基因检测系统HEK293-Rb-Luc,且能够高效特异地检测Rb的活化水平。
