巴戟天醇提物通过MAPK/ERK信号通路对脑缺血再灌注模型大鼠的保护作用
2021-09-27龚鸣
龚 鸣
脑卒中是威胁中国居民身体健康和生命安全的重大疾病之一,其中约70%脑卒中患者为脑缺血再灌注损伤(cerebral ischemia reperfusiorc injury,CIRI),死亡率约10%,致残率高达50%以上[1]。CIRI 指脑缺血一定时间恢复血液供应后,脑功能并未好转,反而出现更严重功能障碍的现象[2]。CIRI 是缺血性脑血管病的主要病理过程,可通过炎症反应、凋亡激活、细胞氧化、线粒体损伤等引起神经细胞死亡[3]。巴戟天醇提物(radix Morindae officinalis-ethanolic extract,RMOEE)来源于双子叶植物茜草科植物巴戟天,已有研究表明,其对心脏、肾脏的缺血再灌注损伤具有一定的保护作用[4-5]。本研究通过构建脑缺血再灌注大鼠模型,探究RMOEE 对CIRI 的保护机制。
1 实验材料
1.1 动物 健康清洁级雄性SD 大鼠40 只,体质量200~240g,购自上海斯莱克实验动物有限责任公司,动物生产许可证号为SCXK(沪)2013-0018,动物使用许可证号为SYXK(浙)2018-0012。饲养于浙江中医药大学实验动物研究中心,室温(25±2)℃,相对湿度60%~70%。
1.2 药物 中药巴戟天购自安徽亳州中药材市场。参考文献[6]的方法进行提取,巴戟天干燥后反复粉碎,得到的粉状物过100 目筛,与70%乙醇按体积比1∶10 混合,采用热回流法将上清液过滤,旋蒸去除乙醇得到浸膏状物。分别加入蒸馏水和正丁醇萃取3次后,得到醇提物正丁醇萃取部分和醇提物水溶部分,再次旋蒸得到各部分浓缩物,将RMOEE 水溶部分配成浓度为2g/mL 的母液备用。
1.3 试剂和仪器 水合氯醛购自美国Sigma 公司(批号为A5462),大鼠炎症因子[肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)、细胞间黏附分子-1(ICAM-1)、血管细胞黏附分子-1(VCAM-1)]检测试剂盒购自上海信帆生物科技有限公司(批号分别为201604、201803、201612、201701、201608),2,3,5-氯化三苯基四氮唑(TTC)、苏木素-伊红(HE)染色试剂盒购自北京索莱宝科技有限公司(批号分别为10110034、0321A23),原位末端转移酶标记(TUNEL)染色试剂盒购自上海碧云天生物技术有限公司(批号为P0173),抗体[丝裂原活化蛋白激酶1/2(MEK1/2)、激活型MEK1/2(p-MEK1/2)、细胞外调节蛋白激酶1/2(ERK1/2)、激活型ERK1/2(p-ERK1/2)、B 淋巴细胞瘤-2(Bcl-2)、Bcl-2 关联X 蛋白(Bax)、半胱氨酸蛋白酶-3(Caspase-3)、半胱氨酸蛋白酶-9(Caspase-9)、甘油醛-3-磷酸脱氢酶(GAPDH)]为兔抗,均购自美国CST 公司(批号分别为4694、2338、4695、9101、3498、14796、9662、9502、2858),Infinite M200 PRO 型多功能酶标仪购自奥地利TECAN 公司,转移脱色摇床购自姜堰市普康医疗机械厂,PowerPac Basic 电泳仪购自美国BIO-RAD 公司,3300 Mini 化学发光成像系统购自中国CLinX 公司。
2 实验方法
2.1 分组、造模及给药 40 只SD 大鼠按照随机数字表法分为假手术组、模型组及RMOEE 低、中、高(3、6、12g/kg)剂量组,每组8 只。参考文献[7]线栓法制备脑缺血再灌注大鼠模型。由尾部将大鼠提起,保持悬空,左前肢屈曲内收,活动时呈典型追尾征为造模成功。假手术组除不插线外,其余步骤同模型组和RMOEE 低、中、高剂量组。另外,RMOEE 低、中、高剂量组按照3、6、12g/kg 的药物剂量,于每天上午8:30进行灌胃给药,持续21 天,假手术组与模型组给予等体积5g/L 羧甲基纤维素钠溶液。
2.2 神经功能缺失评分 给药结束后,采用Zea Longa 评分标准[8]对大鼠神经功能进行评分。无神经功能缺损症状计0 分;瘫痪侧屈曲、内收,不能自主伸展计1 分;行走时向瘫痪侧转圈计2 分;行走时向瘫痪侧倾倒计3 分;严重神经功能缺损,如行走障碍等计4 分。得分越高表明神经功能缺失越严重。
2.3 脑含水量检测 采用脑组织干湿重法检测各组大鼠脑含水量,将各组大鼠麻醉后断头、取脑,去除小脑和低位脑干后称重大脑组织重量,即为脑湿重;110℃恒温烘烤48h 后称重为脑干重,计算脑含水量:脑含水量(%)=(脑湿重-脑干重)/脑湿重×100%。
2.4 脑梗死体积百分比测定 采用TTC 染色法检测脑梗死体积,取脑后于-20℃放置30min,除去小脑和嗅球,冠状切片,从大脑的额叶至枕叶连续切5片。随后将脑片放入1%的TTC 磷酸缓冲液中,37℃避光孵育5min,待颜色分明后取出(梗死区呈白色),用10%甲醛固定。采用Image Pro-Plus 测量梗死面积和整个大脑面积,体积=面积×厚度。脑梗死体积百分比=(梗死体积/整个大脑体积)×100%。
2.5 炎症因子表达情况检测 各组大鼠断头后,取缺血侧脑组织,研磨匀浆,4℃下离心(3500r/min)5min,取上清液,按照ELISA 试剂盒说明书进行操作,通过酶标仪测定大鼠缺血侧脑组织中TNF-α、IL-1β、ICAM-1 及VCAM-1 的含量。
2.6 HE 染色及TUNEL 染色 于冰上取脑后部分组织,利用10%多聚甲醛固定,经过脱水浸蜡包埋后制备石蜡切片,连续切片后进行脱蜡水化处理,切片厚度为4μm。然后进行脱蜡、二甲苯浸泡,降梯度乙醇溶液脱水处理,随后按照HE 染色试剂盒说明书进行操作,采用中性树胶封片后通过显微镜观察脑组织海马CA1 区神经元病变;切片后采用4%多聚甲醛,PBS 清洗,Triton X-100通透,按照TUNEL 试剂盒说明书步骤进行染色,检测凋亡情况,胞浆中呈现有棕黄色底物的细胞视作阳性凋亡细胞,利用Image Pro-Plus 分析软件统计其中TUNEL 阳性细胞个数,取其平均值作为该样本的阳性细胞数,凋亡细胞百分率(%)=阳性凋亡细胞数/(阳性凋亡细胞数+阴性凋亡细胞数)×100%。
2.7 Western blot 检测相关蛋白表达 取大鼠患侧脑皮质组织,加入适量液氮,用研钵研磨后加入Lysis Buffer,组织匀浆机中进行匀浆,使组织尽量碾碎,冰上静置裂解15~30min。将匀浆液放入离心管中离心5min,取上清转移至新的预冷的离心管中,采用BCA试剂盒测定蛋白浓度,处理蛋白随后上样。用SDSPAGE 分离总蛋白,随后用湿转法转移至PVDF 膜上,一抗4℃过夜,二抗室温孵育2h 后采用ECL 显色液显影,化学发光成像系统上进行曝光拍照后,采用Image J 软件进行灰度值分析。
2.8 统计学方法 应用SPSS 22.0 统计软件进行数据分析,数据以均数±标准差(±s)表示,不同组间两两比较采用单因素方差分析;组间两两比较,方差齐性者采用两独立样本t 检验,方差不齐者采用Kruskal-Wallis H 检验,以P<0.05 为差异有统计学意义。
3 实验结果
3.1 各组大鼠神经功能缺失评分及脑含水量比较与假手术组比较,模型组大鼠神经功能评分显著升高(P<0.01);与模型组比较,RMOEE 低、中、高剂量组均有不同程度地降低(P<0.05 或P<0.01)。与假手术组比较,模型组大鼠脑含水量显著增加(P<0.01);与模型组比较,RMOEE 中、高剂量组脑含水量显著降低(P<0.05)。见表1。
表1 各组大鼠神经功能缺失评分及脑含水量比较(±s)
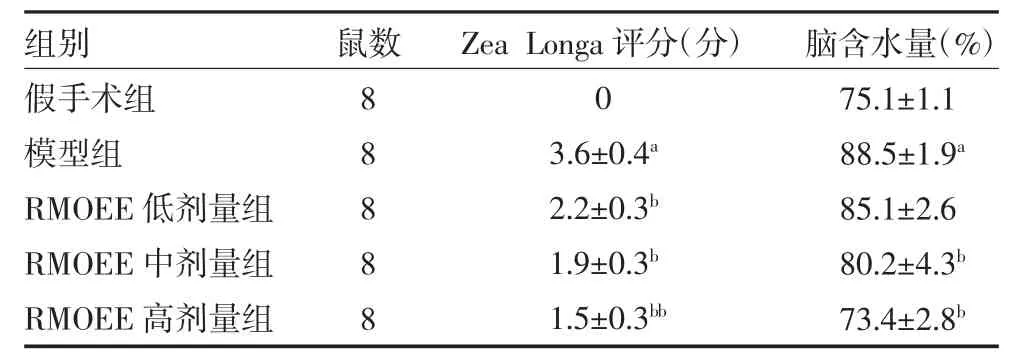
表1 各组大鼠神经功能缺失评分及脑含水量比较(±s)
注:假手术组和模型组予5g/L 羧甲基纤维素钠溶液灌胃;RMOEE 低、中、高剂量组分别按照3、6、12g/kg 的剂量予RMOEE 溶液灌胃;Zea Longa 为神经功能缺失评分;RMOEE 为巴戟天醇提物;与假手术组比较,aP<0.01;与模型组比较,bP<0.05,bbP<0.01
3.2 各组大鼠脑梗死体积百分比比较 假手术组无明显白色梗死灶出现,模型组可见明显的白色梗死灶,各RMOEE 加药组中白色梗死灶大小均有不同程度的减小(见图1)。与假手术组比较,模型组大鼠脑梗死体积百分比显著增加(P<0.01);与模型组比较,RMOEE 中、高剂量组脑梗死体积百分比显著降低(P<0.05 或P<0.01)。见表2。
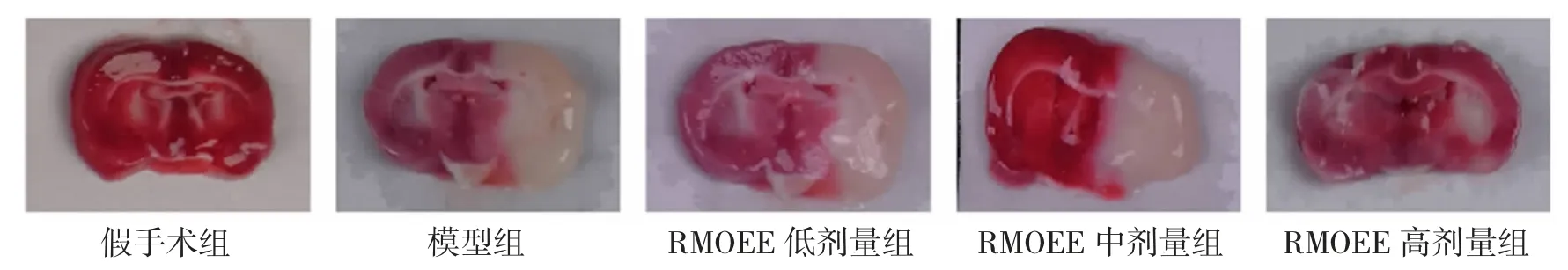
图1 各组大鼠脑组织TTC 染色情况
表2 各组大鼠大脑梗死体积百分比比较(%,±s)
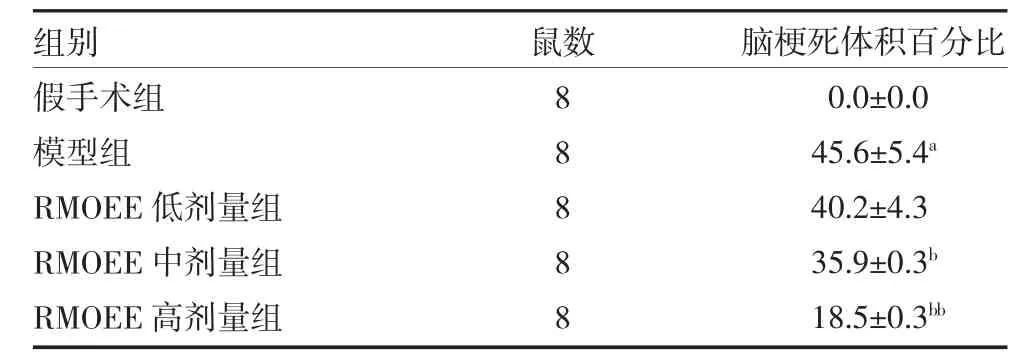
表2 各组大鼠大脑梗死体积百分比比较(%,±s)
注:假手术组和模型组予5g/L 羧甲基纤维素钠溶液灌胃;RMOEE 低、中、高剂量组分别按照3、6、12g/kg 的剂量予RMOEE 溶液灌胃;RMOEE 为巴戟天醇提物;与假手术组比较,aP<0.01;与模型组比较,bP<0.05,bbP<0.01
3.3 各组大鼠脑组织炎症因子表达比较与假手术组比较,模型组大鼠脑组织TNF-α、IL-1β、ICAM-1及VCAM-1 的表达量显著升高(P<0.01);与模型组比较,RMOEE 中、高剂量组能够显著降低大鼠脑组织TNF-α、IL-1β、ICAM-1 及VCAM-1表达(P<0.05)。见表3。
表3 各组大鼠脑组织炎症因子表达比较(±s)
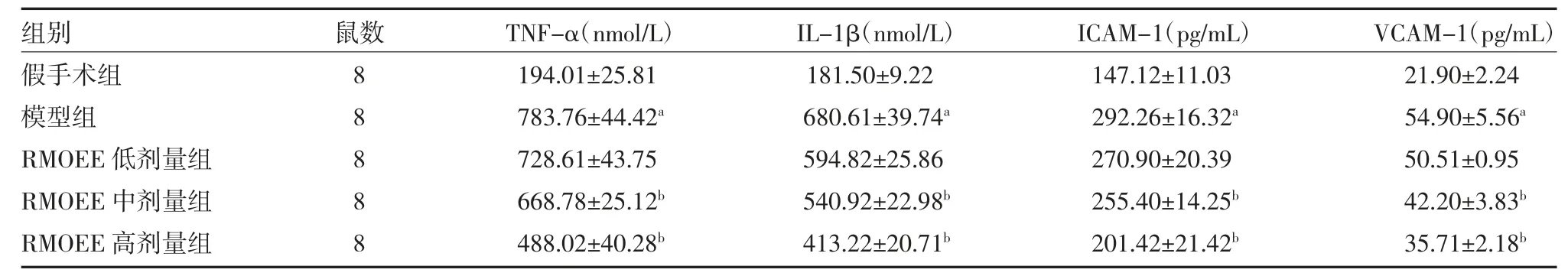
表3 各组大鼠脑组织炎症因子表达比较(±s)
注:假手术组和模型组予5g/L 羧甲基纤维素钠溶液灌胃;RMOEE 低、中、高剂量组分别按照3、6、12g/kg 的剂量予RMOEE 溶液灌胃;RMOEE为巴戟天醇提物;TNF-α 为肿瘤坏死因子-α;IL-1β 为白细胞介素-1β;ICAM-1 为细胞间黏附分子-1;VCAM-1 为血管细胞黏附分子-1;与假手术组比较,aP<0.01;与模型组比较,bP<0.05
3.4 各组大鼠海马CA1 区神经元病理学形态变化HE 染色结果显示,假手术组大鼠脑组织海马CA1区神经元结构层次清晰,排列整齐,结构完整,胞质染色均匀,无异常现象。而模型组神经元结构明显异常,排列紊乱,神经元数量减少,间隙增大,胞体肿胀变形,核仁变浅或消失。相比于模型组,RMOEE 各剂量组能够有效改善海马CA1 区神经元的病理学改变,且随着剂量的增大,改善效果逐渐明显。见图2。
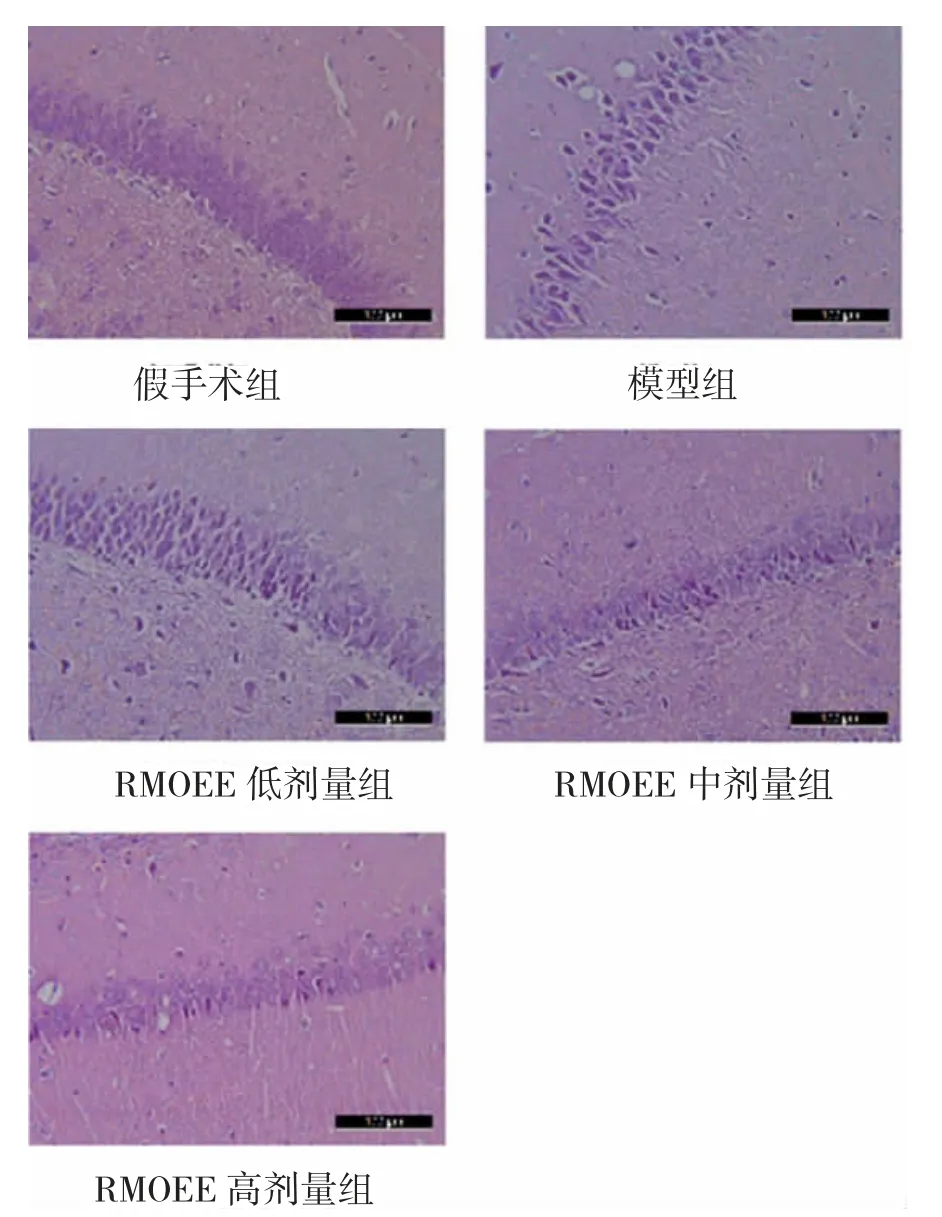
图2 各组大鼠海马CA1 区神经元病理学形态变化(HE 染色×200)
3.5 各组大鼠脑组织细胞凋亡率比较与假手术组比较,模型组大鼠脑组织细胞凋亡率显著增高(P<0.01);相对于模型组,RMOEE 低、中、高剂量组细胞凋亡率均显著降低(P<0.05)。见表4,图3。
表4 各组大鼠脑组织细胞凋亡率比较(%,±s)
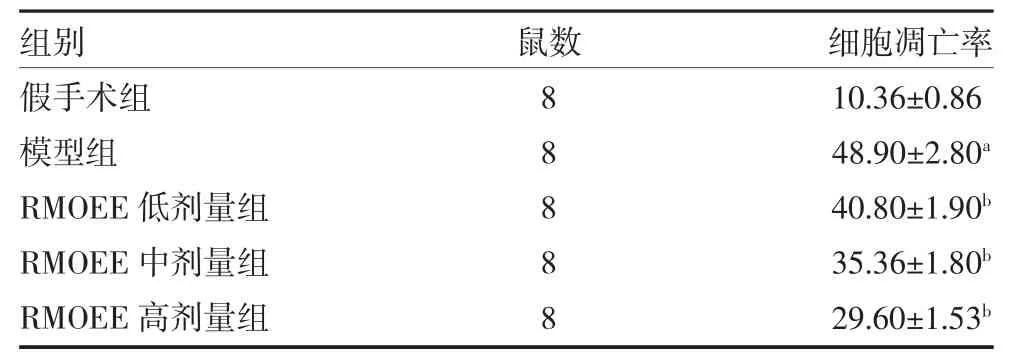
表4 各组大鼠脑组织细胞凋亡率比较(%,±s)
注:假手术组和模型组予5g/L 羧甲基纤维素钠溶液灌胃;RMOEE 低、中、高剂量组分别按照3、6、12g/kg 的剂量予RMOEE 溶液灌胃;RMOEE 为巴戟天醇提物;与假手术组比较,aP<0.01;与模型组比较,bP<0.05

图3 各组大鼠脑组织细胞凋亡情况(TUNEL 染色×400)
3.6 各组大鼠脑组织相关蛋白表达比较 Western blot 检测结果显示,与假手术组比较,模型组大鼠p-MEK1/2、p-ERK1/2、Bax、Caspase-3 以及Caspase-9蛋白表达量显著增加(P<0.05 或P<0.01),Bcl-2 蛋白含量显著降低(P<0.05);与模型组比较,RMOEE 中、高剂量组p-MEK1/2、p-ERK1/2、Bax、Caspase-3 以及Caspase-9 蛋白含量显著下降(P<0.05 或P<0.01),Bcl-2 蛋白含量显著增高(P<0.05 或P<0.01)。见图4,表5。
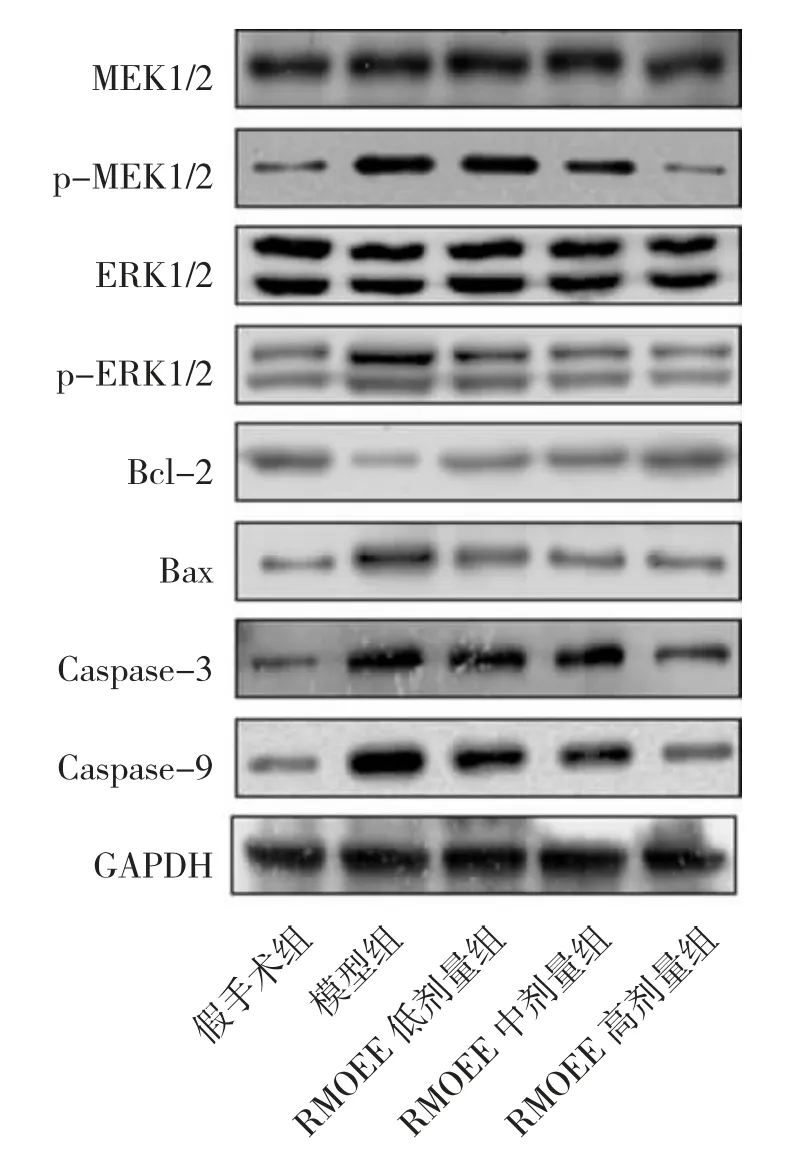
图4 各组大鼠脑组织中相关蛋白表达情况
表5 各组大鼠脑组织相关蛋白相对表达量比较(±s)
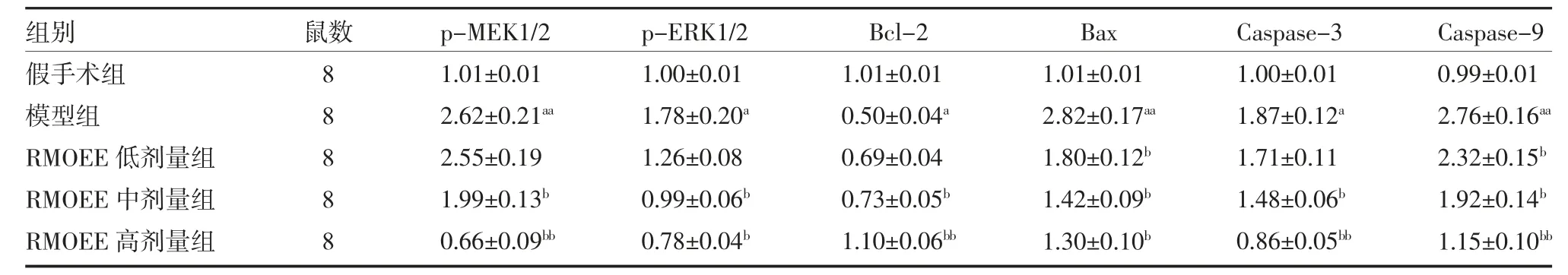
表5 各组大鼠脑组织相关蛋白相对表达量比较(±s)
注:假手术组和模型组予5g/L 羧甲基纤维素钠溶液灌胃;RMOEE 低、中、高剂量组分别按照3、6、12g/kg 的剂量予RMOEE 溶液灌胃;RMOEE为巴戟天醇提物;MEK1/2 为丝裂原活化蛋白激酶1/2;p-MEK1/2 为激活型丝裂原活化蛋白激酶1/2;ERK1/2 为细胞外调节蛋白激酶1/2;p-ERK1/2 为激活型细胞外调节蛋白激酶1/2;Bcl-2 为B 淋巴细胞瘤-2;Bax 为Bcl-2 关联X 蛋白;Caspase-3 为半胱氨酸蛋白酶-3;Caspase-9为半胱氨酸蛋白酶-9;GAPDH 为甘油醛-3-磷酸脱氢酶;与假手术组比较,aP<0.05,aaP<0.01;与模型组比较,bP<0.05,bbP<0.01
4 讨论
中医药在治疗脑缺血再灌注方面有着独特的作用和优势[9-11],中药巴戟天是茜草科巴戟天属植物巴戟天的干燥根,味甘、辛,微温,具有补肾阳、强筋骨、祛风湿等功效[12],其醇提物已被证实对大鼠CIRI 具有一定的保护作用[13],然而其具体的作用机制未被阐明。本研究结果表明,RMOEE 能够显著降低脑缺血再灌注大鼠的Zea Longa 评分,明显减少脑含水量以及脑梗死体积百分比,提示RMOEE 能够在一定程度上减轻脑缺血再灌注所造成的神经功能损伤,改善脑水肿以及脑梗死情况。HE 染色结果表明,RMOEE 干预能够改善脑缺血再灌注模型大鼠脑组织海马CA1 区神经元的病理学改变。
炎症因子的释放加剧了血脑屏障的通透性,进而加重脑组织水肿,促使炎症因子透过血脑屏障,加重炎症反应和细胞凋亡[14]。细胞凋亡是CIRI 引起神经细胞死亡的重要原因[15]。因此,炎症反应和细胞凋亡与CIRI 密切相关。本研究检测大鼠脑组织炎症因子(TNF-α、IL-1β、ICAM-1 及VCAM-1)的表达变化,结果表明,模型组大鼠炎症因子表达明显增高,而RMOEE 干预后能够有效降低上述炎症因子的表达,证实RMOEE 能够显著抑制模型大鼠脑缺血再灌注所造成的炎症反应。此外,TUNEL 染色结果表明RMOEE 能够有效降低脑缺血再灌注模型大鼠的细胞凋亡率,并通过Western blot 实验从蛋白层面验证了RMOEE 干预能够抑制脑缺血再灌注模型大鼠细胞凋亡。
MAPK/ERK信号通路是由激酶级联反应介导的信号传导通路,能够通过一系列的级联反应,激活靶基因转录,参与细胞增殖、转移、凋亡等过程[16]。目前已有研究证实,MAPK/ERK信号通路的异常激活与CIRI 密切相关[15]。MEK1/2和ERK1/2 是MAPK/ERK信号通路的标志性蛋白。本研究结果表明,相对于假手术组,模型组大鼠MEK1/2和ERK1/2 的磷酸化水平显著增强,表明MAPK/ERK通路在脑缺血再灌注模型大鼠中呈异常激活状态,而RMOEE 能够明显降低p-MEK1/2和p-ERK1/2 的表达,证明RMOEE能够有效抑制MAPK/ERK通路活性。
综上所述,RMOEE 可能通过调控MAPK/ERK信号通路,降低炎症因子表达以及抑制凋亡,进而对大鼠CIRI 起到一定的保护作用。
