柚皮素对自身免疫性肝炎模型小鼠保护作用及TRAF6/JNK信号通路的影响
2021-09-27张露露余真君何宝泽
张露露 余真君 何宝泽
自身免疫性肝炎(AIH)是一种以肝细胞破坏为特征的自身免疫性炎症疾病,近年来其发病率在全球范围内呈上升趋势[1]。免疫抑制剂(泼尼松和硫唑嘌呤)是临床治疗AIH 的有效药物,但这些药物的骨髓抑制和库欣综合征等不良反应严重[2]。柚皮素是一种生物类黄酮,具有抗癌、抗诱变、抗炎和抗氧化等多种功能[3]。研究发现,柚皮素通过减少肿瘤坏死因子-α(TNF-α)的积累和抑制细胞凋亡,对心肌缺血/再灌注损伤具有保护作用[4]。此外,柚皮素可以抑制四氯化碳诱导的小鼠肝脏脂质过氧化产物的损伤[5]。刀豆球蛋白A(ConA)是一种植物凝集素,可促进T细胞有丝分裂并诱导AIH[6]。当用ConA 处理小鼠时,肝脏释放白细胞介素-6(IL-6)、TNF-α和干扰素-γ(IFN-γ)等多种炎性细胞因子,从而导致肝组织发生凋亡和自噬[7]。因此,本研究探讨柚皮素在ConA 诱导的AIH 中的保护作用及肿瘤坏死因子受体相关因子6(TRAF6)/c-Jun 氨基末端激酶(JNK)信号通路的潜在作用,为柚皮素治疗AIH 提供实验依据。
1 材料与方法
1.1 实验动物 72 只SPF 级雄性C57BL/6 小鼠,体质量25~30g,购自中国医药研究开发中心有限公司,动物生产许可证号:SCXK(京)2019-0034,动物使用许可证号:SYXK(京)2019-0051,动物质量合格证号:HG50131702,在温度22~24℃、相对湿度50%~70%的环境中自由进食和饮水,控制饲养环境昼夜循环(12h/12h),适应性喂养1 周。本研究经台州恩泽医疗中心(集团)恩泽医院伦理委员会审核通过,批件编号:LS-2020(字)0037 号。
1.2 主要药物、试剂与仪器 柚皮素(原料药,纯度98%,湖南华腾制药有限公司,批号93602-28-9);硫唑嘌呤(上海信谊药厂有限公司,规格:50mg/片,批号20200109);ConA(美国Sigma 公司,批号11028-70);丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)检测试剂盒(上海仁捷生物科技有限公司,批号080120、080122);苏木精-伊红(HE)染色液(上海碧云天生物技术研究所,批号C0107);IL-6和TNF-α 酶联免疫吸附(ELISA)试剂盒(北京方程生物科技有限公司,批号MM-0670R22、MM-0670R84);RIPA 裂解液(上海生工生物工程有限公司,批号175056);ECL 化学发光试剂盒(美国GE 公司,批号KL5179-23);TRAF6、JNK、磷酸化JNK(p-JNK)、B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2 相关X 蛋白(Bax)和β-肌动蛋白(β-actin)抗体、山羊抗鼠二抗(美国Santa Cruz 公司,批号SC-5218、SC-5328、SC-5329、SC-4176、SC-5249、SC-6175、SC-0119);全自动生化分析仪(日本Olympus 公司,型号AU2700);组织脱水机、包埋机、全自动轮转切片机等病理配套设备(德国Leica 公司,型号ASP200S、EG1160、RM2265);光学显微镜(日本Nikon 公司,型号MM-800);台式冷冻离心机(德国Heraeus 公司,型号Sorvall STR ATOS);酶标分析仪、垂直电泳仪(美国BIO-RAD 公司,型号xMark、1658000);凝胶成像仪(美国UVP 公司,型号Gelstudio touch)。
1.3 分组、造模及给药 按照随机数字表法将72 只小鼠分为阴性对照组,模型组,柚皮素低(30mg/kg)、中(60mg/kg)、高(120mg/kg)剂量组[8]和阳性对照组(2mg/kg)[9],每组12 只。模型组,柚皮素低、中、高剂量组和阳性对照组一次性尾静脉注射ConA(12mg/kg)制备AIH 模型[10],阴性对照组尾静脉注射等量生理盐水。注射完毕之后,柚皮素低、中、高剂量组分别给予柚皮素(剂量依次为30、60、120mg/kg,将柚皮素和生理盐水配制成浓度分别为3、6、12mg/mL 的溶液,灌胃体积10mL/kg)灌胃;阳性对照组给予硫唑嘌呤(2mg/kg,将硫唑嘌呤和生理盐水配制成浓度为0.2mg/mL 的溶液,灌胃体积10mL/kg)灌胃;阴性对照组和模型组给予等量生理盐水灌胃,每天1 次,持续给予5 天。
1.4 血清ALT和AST 水平测定 末次灌胃24h 后眼静脉取血,离心(转速4500r/min,离心半径10cm)10min,分离血清,采用全自动生化分析仪酶法检测血清ALT和AST 水平。
1.5 HE 染色观察小鼠肝脏病理改变 末次灌胃24h 后,颈脱臼处死小鼠分离肝组织,将肝左叶用甲醛固定,其余肝组织液氮保存。肝左叶经甲醛固定24h 后,进行脱水、包埋,切片厚度1μm,常规HE 染色,观察肝组织病理学改变。
1.6 ELISA 法检测肝组织IL-6和TNF-α 水平 取冻存肝组织,制成匀浆,将相应一抗稀释至10μg/mL,加入到96 孔板中(0.1mL/孔),4℃过夜,洗涤3 次,加肝匀浆(0.1mL)于上述反应孔中,37℃孵育1h;加入新配置的相对应二抗0.1mL,孵育1h;加入新配置的3,3',5,5'-四甲基联苯胺(TMB)底物溶液(0.1mL),显色(20min);加入2mol/L 硫酸(0.05mL)终止反应,于450nm 处测各孔吸光度(A)值。
1.7 蛋白免疫印迹法检测肝组织TRAF6、JNK、p-JNK、Bcl-2和Bax 水平 取冻存肝组织,制成匀浆,按1∶9 的比例加入RIPA 裂解液,冰浴2h,离心(转速4500r/min,离心半径10cm)10min 后取上清,每管加入1/5 体积的5×Buffer,100℃煮10min 进行变性,进行电泳(20μg/孔),将印迹转移到聚偏氟乙烯膜上,然后用5%脱脂牛奶在室温下封膜1h,加入TRAF6、JNK、p-JNK、Bcl-2、Bax和β-actin 一抗(均为1∶500稀释)4℃孵育过夜,用山羊抗鼠二抗(1∶5000)在室温下孵育30min,进行显色,采集图像,通过Image LabTM 软件获取信号并估计强度,以β-actin 作为内对照。
1.8 统计学方法 应用统计软件SPSS 23.0 进行数据处理,实验数据采用均数±标准差(±s)表示,多组间比较采用单因素方差分析,进一步组间两两比较用SNK-q 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠血清ALT和AST 水平比较与阴性对照组比较,模型组小鼠血清ALT和AST 水平升高(P<0.05);与模型组比较,柚皮素低、中、高剂量组和阳性对照组小鼠血清ALT和AST 水平降低,柚皮素各剂量组之间呈剂量效应关系(P<0.05);柚皮素高剂量组与阳性对照组作用相似(P>0.05)。见表1。
表1 各组小鼠血清ALT和AST 水平比较(U/L,±s)
注:阴性对照组灌胃生理盐水;模型组灌胃生理盐水;柚皮素低剂量组灌胃30mg/kg 柚皮素;柚皮素中剂量组灌胃60mg/kg 柚皮素;柚皮素高剂量组灌胃120mg/kg 柚皮素;阳性对照组灌胃2mg/kg 硫唑嘌呤;ALT 为丙氨酸氨基转移酶;AST 为天冬氨酸氨基转移酶;与阴性对照组比较,aP<0.05;与模型组比较,bP<0.05;与柚皮素低剂量组比较,cP<0.05;与柚皮素中剂量组比较,dP<0.05
2.2 各组小鼠肝脏病理改变比较 阴性对照组小鼠肝脏结构未见明显异常;模型组小鼠见大片肝细胞坏死,肝索排列紊乱,同时伴有炎性细胞浸润;柚皮素各剂量组和阳性对照组病理改变较模型组减轻,且柚皮素高剂量组与阳性对照组只存在轻度肝细胞坏死。见图1。
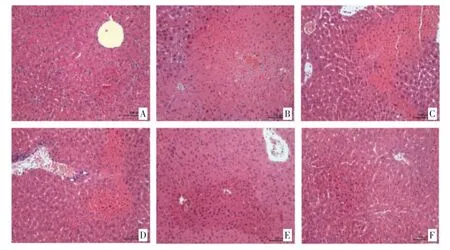
图1 各组小鼠肝脏病理图(HE 染色×200)
2.3 各组小鼠肝组织IL-6和TNF-α 水平比较与阴性对照组比较,模型组小鼠肝组织IL-6和TNF-α水平升高(P<0.05);与模型组比较,柚皮素低、中、高剂量组和阳性对照组小鼠肝组织IL-6和TNF-α 水平降低,柚皮素各剂量组之间呈剂量效应关系(P<0.05);柚皮素高剂量组与阳性对照组作用相似(P>0.05)。见表2。
表2 各组小鼠肝组织IL-6和TNF-α 水平比较(pg/mL,±s)

表2 各组小鼠肝组织IL-6和TNF-α 水平比较(pg/mL,±s)
注:阴性对照组灌胃生理盐水;模型组灌胃生理盐水;柚皮素低剂量组灌胃30mg/kg 柚皮素;柚皮素中剂量组灌胃60mg/kg 柚皮素;柚皮素高剂量组灌胃120mg/kg 柚皮素;阳性对照组灌胃2mg/kg 硫唑嘌呤;IL-6 为白细胞介素-6;TNF-α 为肿瘤坏死因子-α;与阴性对照组比较,aP<0.05;与模型组比较,bP<0.05;与柚皮素低剂量组比较,cP<0.05;与柚皮素中剂量组比较,dP<0.05
2.4 各组小鼠肝组织TRAF6、JNK和p-JNK 蛋白水平比较 各组小鼠肝组织JNK 蛋白水平比较,差异无统计学意义(P>0.05);与阴性对照组比较,模型组小鼠肝组织TRAF6和p-JNK 蛋白水平增加(P<0.05);与模型组比较,柚皮素低、中、高剂量组和阳性对照组小鼠肝组织TRAF6和p-JNK 蛋白水平降低,柚皮素各剂量组之间呈剂量效应关系(P<0.05);柚皮素高剂量组与阳性对照组作用相似(P>0.05)。见表3、图2。
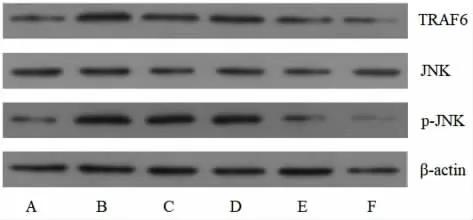
图2 各组小鼠肝组织TRAF6、JNK和p-JNK 蛋白表达印迹图
表3 各组小鼠肝组织TRAF6、JNK和p-JNK 蛋白水平比较(±s)
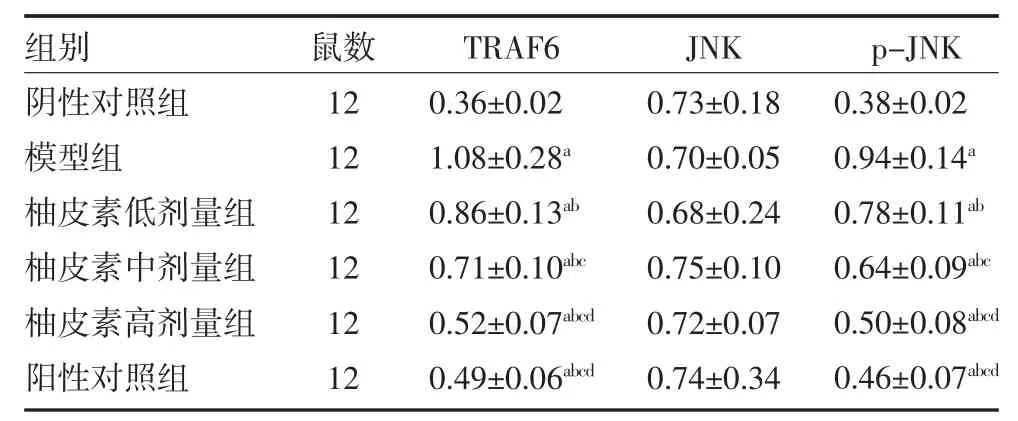
表3 各组小鼠肝组织TRAF6、JNK和p-JNK 蛋白水平比较(±s)
注:阴性对照组灌胃生理盐水;模型组灌胃生理盐水;柚皮素低剂量组灌胃30mg/kg 柚皮素;柚皮素中剂量组灌胃60mg/kg 柚皮素;柚皮素高剂量组灌胃120mg/kg 柚皮素;阳性对照组灌胃2mg/kg 硫唑嘌呤;TRAF6 为肿瘤坏死因子受体相关因子6;JNK 为c-Jun 氨基末端激酶;p-JNK 为磷酸化c-Jun 氨基末端激酶;与阴性对照组比较,aP<0.05;与模型组比较,bP<0.05;与柚皮素低剂量组比较,cP<0.05;与柚皮素中剂量组比较,dP<0.05
2.5 各组小鼠肝组织Bcl-2和Bax 蛋白水平比较与阴性对照组比较,模型组小鼠肝组织Bcl-2 蛋白和Bcl-2/Bax 水平降低,Bax 蛋白水平增加(P<0.05);与模型组比较,柚皮素低、中、高剂量组和阳性对照组小鼠肝组织Bcl-2 蛋白和Bcl-2/Bax 水平增加,Bax 蛋白水平降低,柚皮素各剂量组之间呈剂量效应关系,差异有统计学意义(P<0.05);柚皮素高剂量组与阳性对照组作用相似(P>0.05)。见表4、图3。
表4 各组小鼠肝组织Bcl-2和Bax 蛋白水平比较(±s)
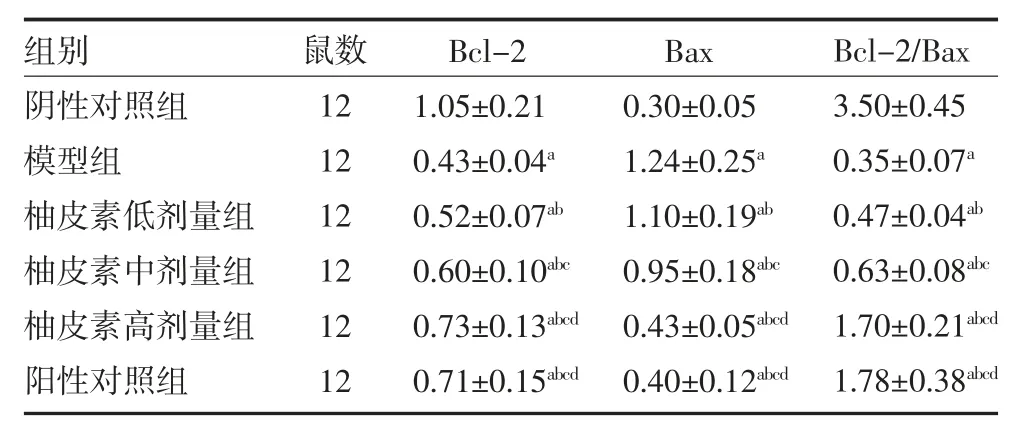
表4 各组小鼠肝组织Bcl-2和Bax 蛋白水平比较(±s)
注:阴性对照组灌胃生理盐水;模型组灌胃生理盐水;柚皮素低剂量组灌胃30mg/kg 柚皮素;柚皮素中剂量组灌胃60mg/kg 柚皮素;柚皮素高剂量组灌胃120mg/kg 柚皮素;阳性对照组灌胃2mg/kg 硫唑嘌呤;Bcl-2 为B细胞淋巴瘤/白血病-2;Bax 为B细胞淋巴瘤/白血病-2相关X 蛋白;与阴性对照组比较,aP<0.05;与模型组比较,bP<0.05;与柚皮素低剂量组比较,cP<0.05;与柚皮素中剂量组比较,dP<0.05

图3 各组小鼠肝组织Bcl-2和Bax 蛋白表达印迹图
3 讨论
柚皮素是一种草药提取物,具有显著的抗炎和抗氧化活性,已有研究证明柚皮素对肝损伤具有保护作用,通过抑制核转录因子-κB(NF-κB)和丝裂原活化蛋白激酶(MAPK)信号通路,发挥抗肝细胞凋亡作用[11]。同时,柚皮素通过阻止NADPH 氧化酶1(Nox1)蛋白质的产生,对胆总管结扎(BDL)诱导的肝损伤具有炎症抑制作用[8]。
AIH 的发病主要是由于免疫调节功能紊乱,免疫系统以肝脏自身抗原为靶点,引起不可控制的免疫反应,从而导致肝脏持续损伤,而炎症是肝细胞损伤的重要机制之一[12],炎性细胞因子(TNF-α、IFN-γ和IL-6)在ConA 致肝损伤的发病机制中发挥重要作用[13]。肝细胞损伤后,ALT和AST 均被释放,这些标记物被广泛用于肝损伤检测[14]。本研究发现,模型组小鼠血清ALT、AST和肝组织IL-6、TNF-α 水平高于阴性对照组,柚皮素低、中、高剂量组小鼠血清ALT、AST和肝组织TNF-α和IL-6 水平低于模型组。组织病理学证据也表明,柚皮素各剂量组小鼠肝脏炎症和肝细胞坏死明显减轻。因此,柚皮素在ConA 诱导的炎症性肝损伤中起着明显的抗炎作用。
TRAF6 是一种细胞质衔接蛋白,在哺乳动物组织中广泛表达,被认为是许多具有免疫调节功能的受体家族的下游因子,可以激活多种信号传导途径,包括JNK 途径[15]。TRAF6 的表达与癌症和自身免疫性疾病等多种疾病密切相关。通过抑制TRAF6 的表达,可以有效减轻肝脏损伤[16]。此外,TRAF6 敲低可阻断Toll 样受体4(TLR4)诱导的JNK 磷酸化[17]。TRAF6/JNK信号传导是许多系统疾病的关键潜在机制之一。p-JNK 是JNK 的活性形式,在ConA 注射后产生p-JNK,并转移到核膜或线粒体膜上,引起肝脏损害[18]。凋亡对于炎症相关的肝病至关重要,可由内源性或外源性因素诱导。p-JNK 可以转运至线粒体膜,使Bcl-2 失活,导致细胞色素C(Cyt C)的释放,启动半胱氨酸蛋白酶(caspases)介导的凋亡[19]。本研究发现,模型组小鼠肝组织TRAF6、p-JNK和Bax 蛋白水平高于阴性对照组,Bcl-2 蛋白和Bcl-2/Bax 水平低于阴性对照组;柚皮素低、中、高剂量组小鼠肝组织TRAF6、p-JNK和Bax 蛋白水平低于模型组,Bcl-2 蛋白和Bcl-2/Bax 水平高于模型组。提示柚皮素可能通过抑制TRAF6 的表达,从而抑制JNK 的磷酸化,抑制肝细胞凋亡,减轻ConA 诱导的肝损伤。
综上所述,柚皮素可能通过抑制TRAF6/JNK信号通路,减轻AIH 模型小鼠肝脏炎症反应,抑制肝细胞凋亡,发挥肝脏保护作用,可能是治疗AIH 的潜在治疗药物,但其临床应用仍需大量研究来论证。
