基因组测序分析矿山作物长势差异区域的土壤微生物群落多样性及优势菌群的筛选
2021-09-10刘芝言林潼臧颖谢懿雯王红蕾
刘芝言 林潼 臧颖 谢懿雯 王红蕾
摘要:本研究为探究废弃矿山不同环境的微生物群落分布和土壤理化性质的关系,分析植物长势差异地区的优势菌群的区别,采用高通量测序技术研究河南省某废弃矿山上植物长势差异区域的微生物群落组成,并对土壤中优势菌群进行分离鉴定,进而解析优势菌群对土壤环境的影响。研究发现废弃矿山土壤pH偏碱性,植物长势优异地区土壤中优势菌群为NEW-1、NEW-2,经初步鉴定NEW-1菌株为Gemmatimonas,NEW-2菌株为Acidobacterium。结果表明,两区域丰富度最高菌群为耐碱性菌株,而植物长势优异区域土壤含有的产酸菌群丰富度较高,推测酸杆菌的丰富度高导致土壤碱性降低,进而为植物的生长提高良好的环境。同时也可推测通过定性补充微生物来促进植物生长来实现对破损环境的修复极具应用潜力。
关键词:土壤DNA提取;宏基因组;群落分布;分离鉴定
引言
土壤是地球上最大的微生物储存库[1],其与植物及微生物呈现相辅相成的关系[2]。微生物群落能够促进植物对土壤中养分的吸收与活化,推动土壤中碳氮磷硫等元素循环[3]。而土壤理化性质的变化为微生物群落在空间分布以及结构改变提供驱动力[4]。微生物对整个生态系统的功能、稳定性和可持续性至关重要。土壤微生物群落结构被认为是土壤生态系统的预警和敏感性指标之一。它在调节土壤养分和生态系统过程中起着重要的作用,是维持植物生长的关键[2]。土壤微生物的空间分布与植物和生境具有明显的相关性。它在很大程度上受到土壤环境条件[5],特别是土壤理化因子的影响。相对应,土壤肥力和健康取决于化学成分,也取决于栖息在土壤中的微生物的种类和数量。微生物多样性不仅对土壤环境有助,同时也和人类的生活息息相关[6,7]。
然而,受限于实验室纯化培养的单一性,人类对微生物的认识存在局限性[8],对微生物群落没有深入的认识。近年来,研究者结合分子生物学技术开发出许多新方法及技术,如变性梯度凝胶电泳[9](DGGM)、随即扩增多态DNA技术[10](RAPD)、限制片段长度多态性[11](RFLP)以及土壤宏基因組学技术[12]等技术。宏基因组于1998年,Handelsman[13]等人提出,是指提取对应环境中的全部遗传物质,然后再将提取到的遗传物质进行建库,通过对基因组文库分析和筛选可以获得很低新的生物分子。新一代的测序技术[14]可以避开建库的工作,使得宏基因组技术更加便捷。宏基因组学是将全部微生物看作一个整体,研究微生物与自然环境以及生物体之间的关系。它克服了传统基于培养方法的缺陷,使得研究者对环境中微生物群落具有更进一步的认识。
近年来,随着国家提出生态文明建设,越来越多的政策被实施,意在推动生态环境有效转好。而我国矿产开发存在时间较长、强度大、数量较多等问题[15,16],导致废弃矿山依靠自然系统恢复其生态环境的方式变得不可行。因此需要有效的治理方法对废弃矿山生态系统进行恢复,而目前关于矿山环境中微生物群落组成、分布及功能的研究依然较少。本研究采用高通量测序技术以及宏基因组技术分析了河南省某矿山区不同类型样本的微生物多样性及群落结构差异,结合土壤理化性质的区别,进而分析了菌群的分布和适应性,并筛选出优势菌株,旨在更全面地发掘环境的微生物资源,同时为废弃矿山的土壤治理和修复以及后续菌肥的制作提供科学依据和理论指导。
1 材料和方法
1.1 土壤样品的采集
样品采集区位于中国河南省辉县市,地理坐标北纬35˚17'~35˚50',东经113˚20'~113˚57'之间。此采样区域为废弃的矿山区,根据矿山区植物的生长状态选择两个采样点,命名为A区和B区。A区为长势旺盛的荆条区,B区为没有植物生长状态区域。每个区域均采用五点取样法,并且分别选择表层土壤(0-3 cm)、植物根际土壤(20-23 cm)及深层土壤(40-43 cm),分别命名为A1、A2、A3和B1、B2和B3。将土壤样品使用无菌取样袋进行保存,储存于实验室4 ℃和-80 ℃备用。4 ℃土壤进行后期的菌株分离筛选,-80 ℃土壤进行基因组DNA提取及分析。
1.2实验试剂及仪器
1.3土壤理化性质的测定
土壤pH值采用电位法测量。有效磷的测定采用0.05mol.L-1 HCl和0.025mol.L-1(1/2 H2SO4)浸提钼锑抗比色法。有效钾测定采用乙酸铵浸提-焰光度法。水解性氮的测定采用碱解-扩散法。
1.3土壤DNA的提取
使用CTAB的方法进行基因组DNA的提取
称土样5.0 g,加入13.5 ml DNA提取液(100 mmoL/L Tris,100 mmol/L EDTA,100mmol/L Na3PO4,1.5 mol/L NaCI,l% CTAB,pH值8.0),振荡5 min;加入1.5 mL 10%SDS后,65 ℃水浴2 h,期间每隔15 min上下颠倒晃动几次;6 000 r/min离心10 min,取上清液,用等体积酚/氯仿/异戊醇(25:24:1)各抽提2次,12 000 r/min离心15 min;取上清,加入2倍体积无水乙醇,4 ℃放置2 h(或者加入0.6倍体积的异丙醇,室温放置2 h或过夜),12000r/min离心15 min,弃上清;沉淀加入5 mL预冷的70%乙醇,12 000r/min离心20 min,收集DNA沉淀,风干,用适量双蒸水溶解。使用酶标仪和1%的凝胶电泳检测DNA的浓度和质量,-20℃保存并进行后续测定实验。
1.4基因组测序
采用生工生物工程(上海)股份有限公司Illumina MiSeq平台进行土壤基因组测序,分析土壤菌群中的V3-V4保守区,对土壤样品的宏基因组数据进行横向及纵向分析,并对物种丰度、菌群间差异性等进行比较分析。
1.5培养基
1.5.1富集培养基
LB培养基:10 g/L胰蛋白胨,5 g/L酵母粉,10 g/L NaCl,固体培养基加入1.5%-2%的琼脂。
1.5.2筛选培养基
酸杆菌的筛选使用V55培养基[17]。
芽单胞菌的筛选使用培养基配方[18]:0.5 g/L葡萄糖,0.5 g/L胰蛋白胨,0.5 g/L谷氨酸钠,0.5 g/L酵母提取物,0.1 g/L硫酸铵,0.1 g/L七水硫酸镁,1 ml/L维生素溶液,固体培养基加入1.5%-2%琼脂,使用NaOH调节pH。维生素溶液:1 g/L烟酸,1 g/L维生素B1,0.5 g/L生物素,0.5 g/L对氨基苯甲酸,10 mg/L维生素B12,0.5 g/L泛酸钙,0.5 g/L维生素B6,0.5 g/L叶酸。
1.6菌株的分离筛选
根据基因组数据结果,对优势菌株进行富集分离筛选及鉴定。取5g含有优势菌群的土壤,加入50 ml無菌水及适量的玻璃珠,30℃摇床振摇2-3 h,进行土壤的破碎及菌株的分离。将破碎的土壤静置15-30 min,取上清进行梯度稀释,然后取适量稀释液至新鲜的LB液体培养基中,30℃培养(每个样品3个平行样),待其具有浊度之后,将菌液进行梯度稀释,在筛选固体培养基中进行将菌落挑至新鲜培养基进行平板涂布,30℃培养,待其长出单菌落,进行纯化及后期鉴定。
1.7菌株的鉴定
使用引物对27F/1492R(27F:5’-AGAGTTTGATCCTGGCTCAG- 3’,1492R:5’-TACGGYTACCTTGTTACGACTT-3’)以待鉴定的菌株基因组DNA为模板进行16s rDNA PCR扩增,并对扩增结果进行测序分析。PCR扩增反应体系:10×PCR Buffer 5 μL,DNA template 2 μL,10 mM Primer F 1 μL,10 mM Primer R 1 μL,dNTPs(A T G C)4.0 μL,DNA聚合酶0.5 μL,ddH2O补齐至20 μL。PCR扩增反应条件:94 ℃10 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,30cycles;72 ℃ 10 min;4 ℃保温。
1.8数据统计及分析
2结果与分析
2.1土壤样品分析
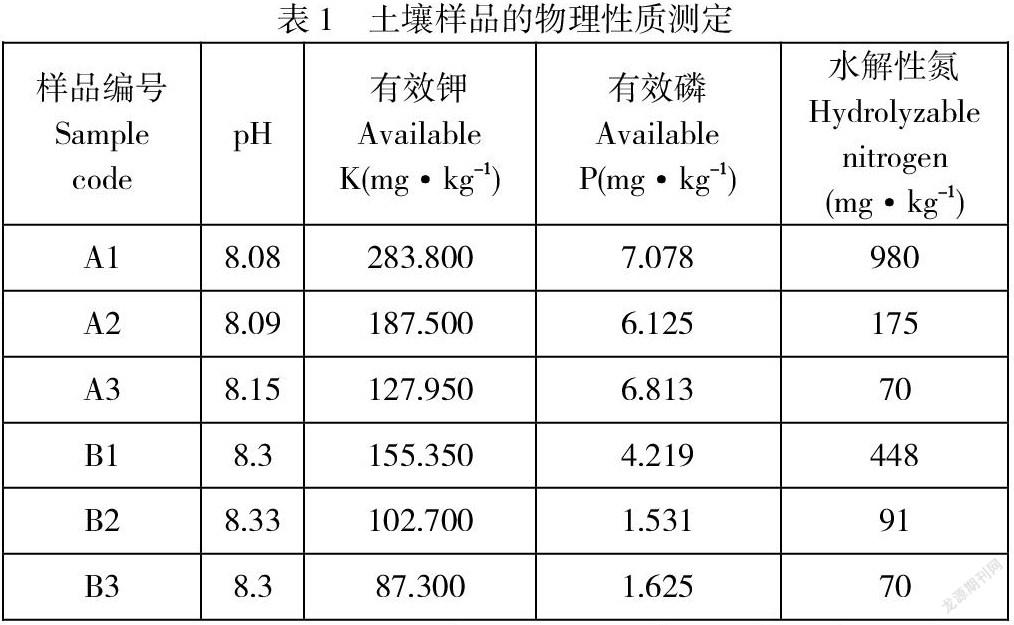
在河南省废弃矿山区进行土壤样品的采集,植物生长状态及地区环境条件如图1所示,从图中可以看出,A区域长有大量的植物,已经恢复了正常的植物生长,而B区域几乎没有什么植物,推测A区土壤状态已经得到恢复,而B区土壤还处于一种待恢复的状态。为了验证这一推测,首先对A区和B区六点土壤理化性质(pH、有效钾、有效磷和水解性氮)进行了测定,测定结果见表1。
从表1中可以看出,土壤样品的pH值无显著差别,维持在8.1-8.3左右,为碱性土壤,这与矿山区域的特征相符,矿山中的一些岩石经过长时间的风化之后将会产生一些氢氧根离子或盐累计在土壤表层中,致使土壤呈碱性,这也为后期菌株筛选pH值的设定提供了参考。测定的土壤样品有效钾、有效磷及水解性氮具有差异,主要表现为A区这三种参数明显高于B区,在2倍左右。并且在B区有效磷参数中,表层土壤(B1)中的有效磷数值比根际土壤(B2)及深层土壤(B3)高3倍左右。我们结合A区土壤的有效磷值,推测B区处于一个恢复前期,对于植物生长具有促进作用的有效磷及水解性氮等物质将会从表层逐渐往下层进行渗透,从而达到恢复其植物生长正常值的状态。
2.2 基因组测序分析
2.2.1 Alpha多样性分析
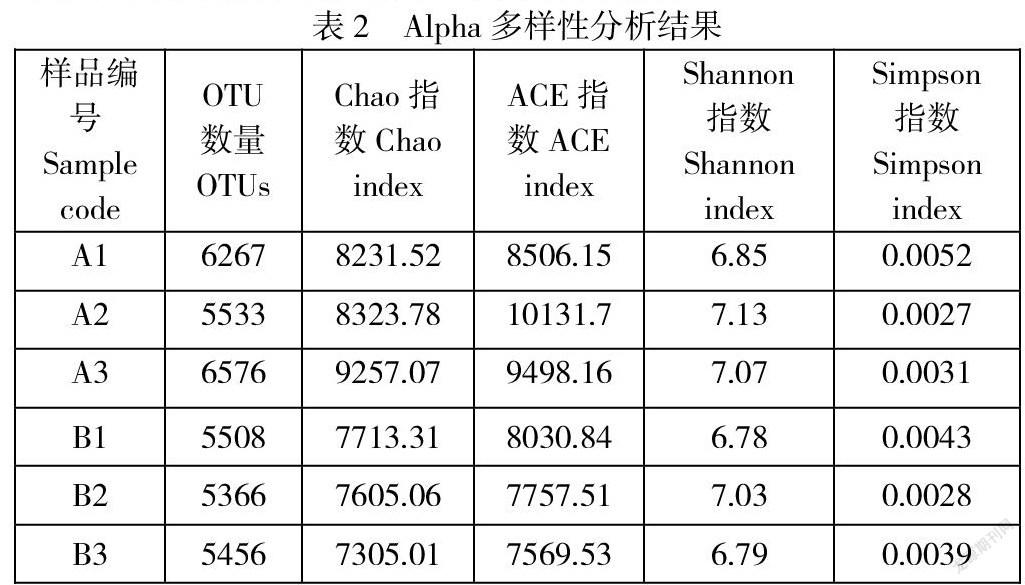
从土壤性质可知,AB两区域的土壤具有差异性,因此分别对AB两区域的土壤进行基因组的提取,并进行测序分析,依据测序结果首先对土壤样品进行了Alpha多样性分析,Chao指数越高,表明此群落的丰富度越高,如表2所示,A区域的Chao指数明显高于B区域,说明A区域的群落丰富度高于B区域,这与之前所推测A区域土壤已经恢复一部分,而B区域刚进入恢复期相对应。ACE值也可以用来估计群落的丰富度,A区域与B区域的ACE值相差不大,无显著差异,但总体来看,A区域的ACE值略高于B区域,这与Chao值所表明的现象相一致。
Shannon和Simpson指数可以用来估算样品中群落的多样性,Shannon值越高,代表样品中群落的多样性越高,而Simpson则相反,从表中可以看出,A区域和B区域的Shannon和Simpson指数相差不大,无显著性差异,说明A区域和B区域样品中群落的多样性无太大差异,几乎相一致,我们可以推测AB两区域中菌群的种类无显著性差异,而菌群丰度具有较大差异。
2.2.2 菌群丰度差异性分析
由Alpha多样性中Chao和ACE指数,我们得到样本中群落的丰度具有差异,而多样性差异不显著,因此对AB两区域之间的菌群丰度进行了横向差异性比较。结果如图2所示,进行汇总了差异性较明显的25个属级别的菌群。从图中可以看出,在属级别上,A1较B1丰富度较优势的菌群主要为酸杆菌(Acidobacteria)、芽单胞菌(Gemmatimonadetes)、拟杆菌(Bacteroidetes)、未分类菌群(unclassified)等,而B1中丰富度较优势的菌群主要为放线菌(Actinobacteria)。A2和B2相比较,A2中丰富度较优势的菌群主要为酸杆菌(Acidobacteria)、芽单胞菌(Gemmatimonadetes)、未分类菌群(Unclassified)等,B2中丰富度较优势的菌群主要为放线菌(Actinobacteria)、变形菌(Proteobacteria)、浮霉菌(Planctomycetes)等。深层土壤区域A3和B3相比,A3中酸杆菌(Acidobacteria)、拟杆菌(Bacteroidetes)、厚壁菌(Firmicutes)的丰富度占优势,而B3中浮霉菌(Planctomycetes)、疣微菌(Verrucomicrobia)、未分类菌群(Unclassified)的丰富度占优势。总的来说,A区域中,除去未分类菌群,相对于B区域来说酸杆菌、芽单胞菌和拟杆菌丰富度具有较大优势,可以依据此数据进行A区域的菌株筛选,后期应用于B区域的土壤恢复。由于取样区域中土壤呈碱性,推测酸杆菌的存在可能是为了使土壤的pH维持恒定并逐渐恢复正常。
2.2.3 功能分析
為了分析两区域菌群丰富差异的原因,依据测序结果,使用PICRUSt软件对两样本进行基因功能预测,对eggNOG和KEGG进行了预测,两者同源基因簇数目之间没有统计学差异。eggNOG功能注释结果如图3所示,共分为25个功能区,其中在碳水化合物的运输和代谢、翻译,核糖体结构和生源,细胞壁/膜/包源生源、通用功能预测及防御机制功能分类丰度上A区域显著高于B区域(P<0.05);KEGG代谢通路功能注释结果如图*所示,在酶家族、多糖的生物合成级代谢、辅因子和维生素的代谢、复制和修复及翻译的功能分类丰度上A区显著高于B区(P<0.05),而在细胞运动、膜运输及生物降解和代谢的功能分类丰度上A区显著低于B区(P<0.05)。综合AB两区域基因功能预测,这说明在A区域的土壤微生物群落部分参与生长代谢的功能基因丰度显著高于B区域,从而与菌群丰度差异相对应,说明A区域的菌群对土壤生态恢复具有促进作用。
2.3 优势菌株的筛选与鉴定
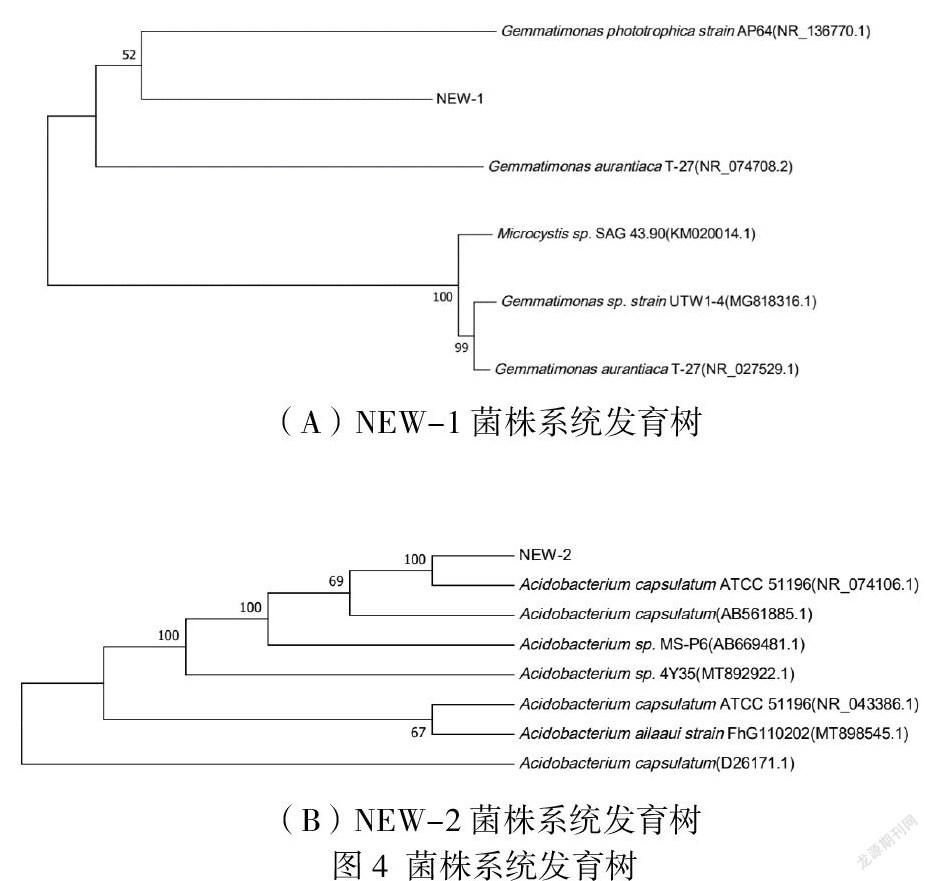
采用富集培养基及分离筛选培养基对A区域较优势菌株进行分离筛选,共筛选得到两株菌,其系统进化树如图4所示,从图4A中可以看出,菌株NEW-1为芽单胞菌属,其在A区域的表层及根际土壤中相对于B区域具有优势,并且由土壤的物理性质可以看出,土壤的恢复可能是一种自上而下的缓慢过程,因此推测芽单胞菌可能对A区域的土壤恢复具有促进作用。从图4B可以看出,菌株NEW-2为酸杆菌属,它在A区域的表层、根际及深层土壤中相对于B区域均具有优势,考虑到AB两区域的土壤pH值偏碱性,推测其可能与土壤pH的恢复具有促进作用。
3 结论与讨论
土壤是一个重要的生态系统,其包含有丰富的微生物资源,当土壤受到人为和自然的破坏时,其生态系统将会发生改变,主要变现为,1:土壤中的N、P、K等有机物质的流逝,使其不适宜植物生长;2:微生物的丰度将会发生变化;3:土壤的性质发生改变,如pH等。在矿山土壤中土壤性质的变化主要是pH呈碱性状态,随着时间的积累,矿石的风化会导致氢氧根及盐离子在土壤中沉积,从而导致其pH的改变。本研究主要是针对遭受破坏的矿山土壤的两区域,已经逐渐恢复植物生长和待恢复的土壤两部分进行比较。在Alpha多样性中,能够看出,其菌群的丰度具有差异,但菌群的组成的差异不显著,并且区域之间的上层、根际及深层土壤也具有差异,主要表现为其土壤恢复的过程为由上至下的一个缓慢的过程。在属级别的菌群丰度上,主要集中在酸杆菌、芽单胞菌及拟杆菌的差异,结合酸杆菌的生物活性可以看出,其差异性主要与pH的改变具有关系,矿山土壤的pH主要为碱性,在酸杆菌的存在下,土壤的pH将会逐渐恢复正常,以此来适宜植物的生长,从而恢复生物多样性,这也与AB两区域的pH些许差异相对应。结合芽单胞菌及拟杆菌的性质,推测其可能与植物的新陈代谢具有关系。在对功能分析中,也可以看出,A区的功能丰度高于B区的主要是在促进植物生长方向,而B区高于A区的在生物降解及修复方向,这也与AB两区域的特征相对应。但前期菌群分析及功能分析主要是为菌株筛选及土壤修复奠定基础,在其基础上,能够使用相应的筛选培养基得到相对应具有丰度优势的菌群,为后续菌肥的制作及土壤修复奠定了一定的基础。
参考文献
[1]W CJ,A HJ,Karl R,M YI.Towards an evolutionary ecology of life in soil[J].Trends in ecology & evolution.2005;20(2).
[2]崔晓辰.根际微生物与土壤植物关系的研究进展[J].现代农业研究.2021;27(05):34-5+49.
[3]Nkongolo KK,Narendrula-Kotha R.Advances in monitoring soil microbial community dynamic and function[J]. Journal of Applied Genetics.2020;61(2).
[4]王雅芸,隆彦昕,李岩,王妍,吕光辉,杨建军,et al.胡杨树冠下土壤理化性质与微生物群落结构和分布之间的关系[J].生态学报.2021(14):1-16.
[5]Zhao X,Huang J,Lu J,Sun Y.Study on the influence of soil microbial community on the long-term heavy metal pollution of different land use types and depth layers in mine[J].Ecotoxicology and Environmental Safety.2019;170.
[6]Meng X,Xiaoliang L,W KT,Ming X,Xiaolin L,Junling Z.High microbial diversity stabilizes the responses of soil organic carbon decomposition to warming in the subsoil on the Tibetan Plateau[J].Global change biology.2021;27(10).
[7]陈慧颖,李慧星,许彬,曹斌,王春艳.河南浓香型酒醅的真菌微生物菌群多样性及共变性[J].工业微生物.2021;51 (02):36-45.
[8]沈菊培,张丽梅,郑袁明,朱永官,贺纪正.土壤宏基因组学技术及其应用[J].应用生态学报.2007(01):212-8.
[9]Takeshi W,Susumu A,Asumi N,Kazunari N,Makoto K.DGGE method for analyzing 16S rDNA of methanogenic archaeal community in paddy field soil[J].FEMS Microbiology Letters. 2006;232(2).
[10]Harry M,Jusseaume N,Gambier B,Garnier-Sillam E.Use of RAPD markers for the study of microbial community similarity from termite mounds and tropical soils[J].Soil Biology and Biochemistry.2001;33(4).
[11]张俊杰,彭姗姗,尚益民,李硕,柴帅杰.湖南益阳地区紫云英根瘤菌的遗传多样性研究[J].河南农业大学学报.2020;54(03): 480-7.
[12]贺纪正,张丽梅,沈菊培,朱永官.宏基因组学(Metagenomics)的研究现状和发展趋势[J].环境科学学报.2008(02):209-18.
[13]Handelsman J,Rondon MR,Brady SF,Clardy J,Goodman RM.Molecular biological access to the chemistry of unknown soil microbes: a new frontier for natural products [J].Chemistry & Biology.1998; 5(10).
[14]贺纪正,袁超磊,沈菊培,张丽梅.土壤宏基因组学研究方法与进展[J].土壤学报.2012;49(01):155-64.
[15]于辉胜.区域性废弃矿山生态修复实践与思考[J].中国国土资源经济.1-9.
[16]杨彩琴.矿山生态修复措施及合理的植物配置分析[J].农业与技术.2021;41(08):8109-11.
[17]Markus O,M.ZC,Tanja C,Marius S,Sanja M,Benedikt L,et al.High-Throughput Cultivation for the Selective Isolation of Acidobacteria From Termite Nests[J].Frontiers in Microbiology.2020.
[18]Zhang H,Sekiguchi Y,Hanada S,Hugenholtz P,Kim H,Kamagata Y,et al.Gemmatimonas aurantiaca gen.nov., sp.nov.,a gram- negative, aerobic,polyphosphate –accumula ting micro-organism,the first cultured representative of the new bacterial phylum Gemmatimonadetes phyl.nov[J].Int J Syst Evol Microbiol.2003;53(Pt 4):1155-63.
作者簡介:
第一作者:刘芝言(1989年3月16日),男,汉族,籍贯:吉林省公主岭市,单位:长春工业大学 职称:助理工程师 研究方向:环境微生物学。
第二作者:林潼(2002.02),女,汉族 籍贯:吉林省长春市 学历:大学本科在读 单位:长春工业大学 吉林省长春市。
第三作者:臧颖(2001.08),女,汉族,籍贯:吉林省延边朝鲜族自治州,学历:大学本科在读 单位:长春工业大学。
第四作者:谢懿雯(2000年10月),女,汉族,籍贯:湖南省娄底市,学历:大学本科在读 单位:长春工业大学。
通讯作者:王红蕾,女,汉族,籍贯:吉林省长春市 学历:博士,单位:长春工业大学 职称:讲师 研究方向:环境微生物学。
