新疆鼠尾草根中酚酸类化学成分的纯化工艺研究
2021-09-10任春晖王晓梅王新玲依明尕哈甫胡君萍
任春晖,王晓梅,王新玲,依明·尕哈甫,胡君萍
(新疆医科大学药学院,乌鲁木齐 830011)
新疆鼠尾草(SalviadesertaSchang)是唇形科(Labiatae)鼠尾草属(Salvia)的一种芳香型多年生草本植物,产于新疆北部,生于海拔为270~1 850 m的田野荒地、沟边、沙滩草地及林下。新疆鼠尾草也被称为新疆丹参,在新疆分布广泛,资源丰富。民间通常以全草入药,具有清热解毒、止咳祛痰、消肿利尿之功效[1]。
课题组前期研究对新疆鼠尾草进行了初步的化学成分和药理活性研究,从中分离得到20余种化学成分,主要包括水溶性的酚酸类和脂溶性的二萜醌类、三萜类[1-3]。这些化学成分的结构类型与其同科同属的丹参(Salviamiltiorrhiza)类似,而丹参的酚酸类化学成分具有治疗糖尿病性心肌病[4]、糖尿病肾病(DN)[5]、糖尿病性视网膜病[6]等糖尿病并发症以及抗病毒[7]和抗炎[8]等作用,丹参脂溶性化学成分则可保护心血管系统、呼吸系统和胰腺[9-11]。现有研究证明,新疆鼠尾草的水溶性酚酸类化学成分能通过抑制肾脏组织细胞蛋白激酶C(PKC)的活性保护DN大鼠肾脏[12],脂溶性成分则具有显著的抗血栓作用,能增强抗血小板聚集和凝血失活[13]。课题组前期对新疆鼠尾草酚酸类化学成分的提取工艺进行了研究[14],发现该提取物可明显改善实验性糖尿病SD大鼠的血糖、血脂紊乱,降低血清中肌酐质量浓度及血尿素水平,对糖尿病大鼠肾脏具有一定的保护作用[15]。但课题组制备的新疆鼠尾草提取物中总酚酸质量分数仅为68.0%,其化学组成尚需阐明。研究显示,鼠尾草属植物主要的酚酸类化学成分有丹参素、丹参素甲酯、原儿茶酸、原儿茶醛、咖啡酸、迷迭香酸及丹酚酸K等,上述成分均具有抗炎、抗氧化活性[16-17]。故本文以新疆鼠尾草根中4种代表性酚酸类成分的质量分数为指标,通过Design-Expert软件,采用Box-Behnken中心组合设计方法,优选大孔吸附树脂法纯化新疆鼠尾草酚酸类化学成分的工艺条件,并对制备的3批样品进行质量控制,为阐明新疆鼠尾草酚酸类化学成分和后期药理研究提供参考。
1 仪器与试药
1.1仪器 ODS HYPERSⅡ色谱柱(250 mm×4.6 mm,5 μm),美国赛默飞世尔科技公司;Waters 2695高效液相色谱仪和Waters 2489双波长紫外可见检测器,均购自沃特世科技(上海)有限公司;KQ-500DE型离心机,昆山市超声仪器有限公司;TDL-5A型离心机,上海菲恰尔分析仪器有限公司;2HWY-2102C型恒温培养振荡器,上海智城分析仪器有限公司;T6型新世纪紫外-可见分光光度计,北京普析通用仪器有限责任公司。
1.2试药 新疆鼠尾草,采于新疆乌鲁木齐水磨沟区,由王晓梅副教授鉴定为唇形科鼠尾草属新疆鼠尾草SalviadesertaSchang的干燥根和根茎。对照品:丹参素(批号628B021),原儿茶醛(批号1228A024)和咖啡酸(批号806D022),均购自北京索莱宝科技有限公司;迷迭香酸(批号Y06A9K67402),上海源叶生物科技有限公司;没食子酸(批号110831-200803),中国食品药品检定研究院。AB-8型、D301-12型和HP20型大孔吸附树脂,均购自天津市光复精细化工研究所;S-8型、DM130型和D3520型大孔吸附树脂,均购自沧州宝恩吸附材料科技有限公司;ADS-17型、HPD100型、HPD722型、HPD600型、HPD400型、HPD500型和HPD826型大孔吸附树脂,均购自郑州勤实科技有限公司;甲酸、盐酸和氢氧化钠(分析纯),均购自天津市致远化学试剂有限公司;甲醇(色谱纯),美国Fisher Scientific公司;其余试剂均为分析纯,均购自国药集团化学试剂有限公司。
2 方法与结果
2.1新疆鼠尾草根提取物浸膏的制备以及4种酚酸类成分的质量分数测定
2.1.1新疆鼠尾草根提取物浸膏的制备 取一定量新疆鼠尾草根粉末(过40目筛),以25倍量体积分数为40%的乙醇加热回流提取3次,每次1 h,过滤,合并滤液,水浴蒸干得干浸膏[14]。浸膏得率为23.8%。
2.1.2溶液的制备
2.1.2.1混合对照品溶液 精密称取咖啡酸、迷迭香酸、原儿茶醛及丹参素对照品适量,加甲醇制成质量浓度分别为1.01、3.02、0.98、1.00 mg·mL-1的单一对照品储备液。精密吸取上述4种单一对照品储备液加甲醇制成质量浓度分别为50.5、39.2、22.5、40.1 μg·mL-1的混合对照品溶液。
2.1.2.2供试品溶液 取2.1项下制备的干浸膏粉末适量,用体积分数为40%的乙醇超声溶解,离心,用0.22 μm微孔滤膜滤过,取续滤液,即得。
2.1.3色谱条件 ODS HYPERSⅡ 色谱柱(250 mm×4.6 mm,5 μm)。流动相:甲醇(A)-2 mL·L-1甲酸(B),梯度洗脱,洗脱程序为:0~10 min,20%A~25%A;10~20 min,25%A~30%A;20~25 min,30%A~35%A;25~35 min,35%A~36%A;35~37 min,36%A~47%A;37~42 min,47%A~60%A;42~47 min,60%A~80%A。流速:1 mL·min-1;检测波长:285 nm;柱温:40 ℃;进样量:10 μL。
2.1.4系统适用性考察 分别精密吸取2.1.2项下制备的混合对照品溶液和供试品溶液各10 μL,按照2.1.3项下色谱条件进样测定,记录色谱图,结果见图1。由图1可知,4种成分的保留时间分别为4.917、7.383、11.583、32.133 min,色谱峰之间的分离度均大于1.5,与其他组分分离完全,拖尾因子在0.95~1.05之间,理论塔板数以迷迭香酸峰计算均大于3 000,符合质量分数测定要求。

图1 HPLC图
2.1.5线性关系考察 吸取适量2.1.2.1项下制备的混合对照品溶液,0.22 μm微孔滤膜过滤,按照2.1.3项下色谱条件分别进样5、10、15、20、25 μL,以4种成分的质量为横坐标(x)、色谱峰面积为纵坐标(y),绘制标准曲线,回归方程分别为y1=8×106x1+38 460(r1=0.999 2),y2=5×107x2-40 696(r2=0.999 6),y3=4×106x3-15 333(r3=0.999 9),y4=2×106x4-55 878(r4=1.000 0),4种成分分别在0.21~1.03、0.02~0.09、0.04~0.21、0.20~1.00 μg范围内线性关系良好。
2.1.6精密度实验 精密吸取2.1.2.1项下制备的混合对照品溶液,按照2.1.3项下色谱条件重复进样测定6次,结果4种成分的峰面积RSD值分别为0.54%、1.40%、1.32%、1.27%,表明仪器精密度良好。
2.1.7稳定性实验 取2.1.2.2项下制备的供试品溶液,分别于配制后的 0、1、2、4、6、8 h 测定4种成分的峰面积,结果RSD值分别为0.77%、0.65%、0.32%、0.84%,表明供试品溶液在8 h内稳定性良好。
2.1.8重复性实验 按照2.1.2.2项下方法制备6份供试品溶液,按照2.1.3项下色谱条件进样测定。结果4种成分峰面积的RSD值分别为0.49%、1.72%、1.59%、1.56%,表明该方法重复性较好。
2.1.9回收率实验 精密称定2.1.1项下制备的新疆鼠尾草提取物浸膏适量,按照2.1.2.2项下方法制备9份供试品溶液,分别精密加入适量高、中、低质量浓度的混合对照品溶液,再按照2.1.3项下色谱条件进样测定,计算平均回收率和RSD值,结果见表1。
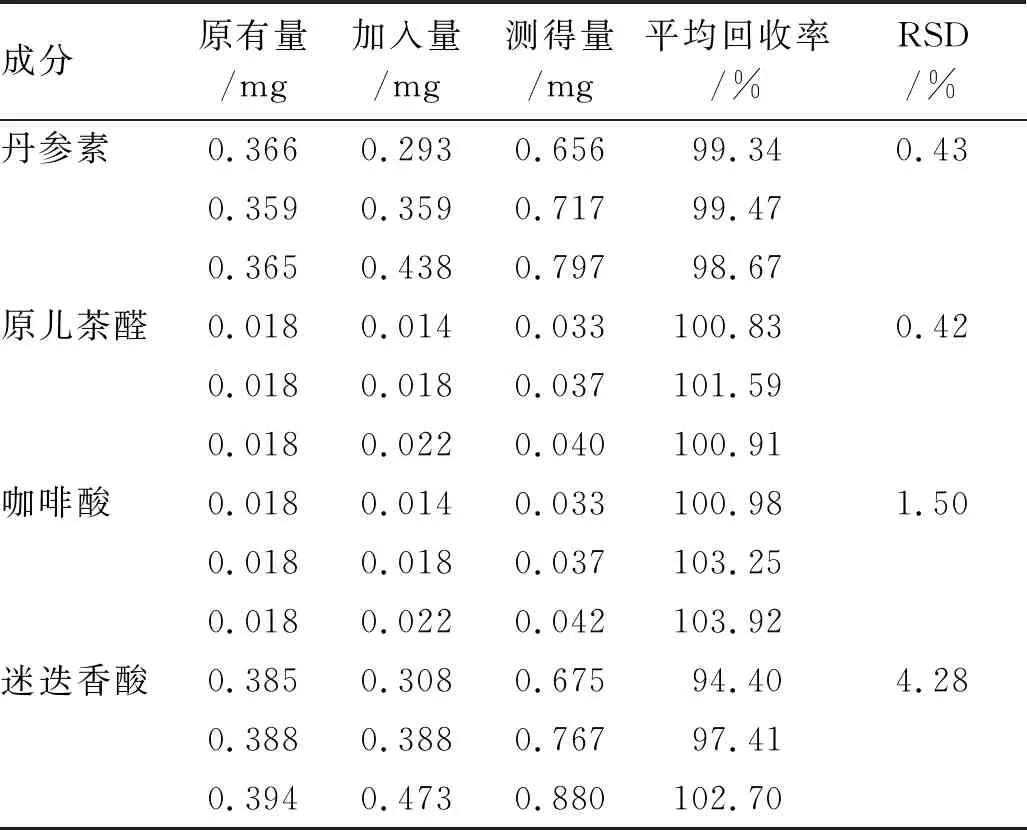
表1 回收率实验结果 (n=3)
2.1.10质量分数测定 按照2.1.2.2项下方法制备供试品溶液,按照2.1.3项下色谱条件进样测定,结果提取物中4种成分的质量分数之和为1.35%。
2.2新疆鼠尾草酚酸类化学成分纯化工艺的考察
2.2.1大孔吸附树脂的预处理 取适量ADS-17、D3520、D301-12、HPD100、S-8、HPD722、HPD500、HPD600、AB-8、HPD400、HP20、DM130和HPD826共13种型号的树脂,用体积分数为95%的乙醇浸泡24 h,湿法装柱,再用体积分数为95%的乙醇洗涤至流出液与5个柱体积(BV)水混合不显白色浑浊,加水洗至无醇味,再用2 BV体积分数为5%的盐酸浸泡4 h,用水洗至中性,最后用2 BV体积分数为2%的氢氧化钠浸泡4 h,用水冲洗至中性,备用[18]。
2.2.2供试品溶液的制备 取2.1.1项下制备的新疆鼠尾草根提取物浸膏粉末适量,用体积分数为40%的乙醇超声溶解,离心,取上清液,即得。
2.2.3树脂的筛选 称取1 g预处理后各种型号的大孔吸附树脂,置于锥形瓶中,分别加入2.2.2项下制备的质量浓度为20 mg·mL-1的供试品溶液10 mL,封口后置于恒温培养振荡器中振荡8 h,抽滤后滤液离心,定容至10 mL,过滤,取续滤液,按照2.1.3项下色谱条件测定4种成分的质量分数,并按照公式(1)计算树脂的吸附率。
将上述吸附饱和的树脂晾干后置于锥形瓶中,加入体积分数为40%的乙醇10 mL,封口后置于恒温培养振荡器中振荡8 h,抽滤后滤液离心,定容至10 mL,过滤,取续滤液,按照2.1.3项下色谱条件测定总酚酸质量分数,并按照公式(2)计算树脂的解吸附率。公式(1):E=(C0-C1)÷C0×100%,公式(2):D=[C2÷(C0-C1)]×100% (E为吸附率(%);D为解吸附率(%);C0、C1、C2分别为样品溶液中总酚酸质量浓度、吸附后溶液中总酚酸质量浓度、解析液中总酚酸质量浓度)。综合考虑各型号树脂的吸附与解吸附情况,选择HPD600进行后续实验。结果见表2。

表2 13种大孔吸附树脂的吸附率和解吸附率
2.2.4单因素考察
2.2.4.1上样质量浓度考察 将48 mL(1 BV)按照2.2.2项下方法制备的不同质量浓度的供试品溶液(1、10、20、30、40 mg·mL-1)分别通过HPD600树脂柱(径高比为1∶10),以1 mL·min-1的流速进行动态吸附,收集流出液定容至48 mL,按照2.1.3项下色谱条件测定总酚酸的质量浓度,计算吸附率。结果显示,上样液质量浓度小于30 mg·mL-1时,吸附率随着上样液质量浓度的增大而升高;而上样液质量浓度大于30 mg·mL-1时,吸附率随着上样质量浓度的增大而下降,上样液质量浓度为30 mg·mL-1时吸附率达到最高,为83%。
2.2.4.2上样量的考察 称取处理好的30 g树脂置于树脂柱中(径高比为1∶10),取2.2.2项下制备的供试品溶液55 mL,上样,吸附流速为1 mL·min-1。每10 mL收集1份流出液,按照2.1.3项下色谱条件测定4种成分的质量浓度,结果显示,上样量为40 mL时达到饱和吸附,以40 mL计算,1 g树脂最大动态吸附约为39.10 mg总酚酸提取物。
2.2.4.3水洗用量考察 称取适量HPD600置于树脂柱中,取2.2.2项下制备的供试品溶液40 mL以1 mL·min-1的流速进行动态吸附,吸附完全后加6 BV蒸馏水洗脱水溶性杂质及未吸附的提取液,收集洗脱液,每1个BV为1流份,按照2.1.3项下色谱条件进行测定,结果显示,第3个BV中基本无酚酸,故确定水洗用量为3 BV。
2.2.4.4洗脱溶剂体积分数考察 称取适量处理好的HPD600大孔吸附树脂湿法装柱,取2.2.2项下制备的供试品溶液40 mL,以1 mL·min-1流速进行动态吸附,吸附完全后加3 BV水洗脱除杂,再用10 BV体积分数分别为20%、40%、60%、80%、95%的乙醇以1 mL·min-1的流速洗脱,分别收集洗脱液并浓缩,按照2.1.3项下色谱条件测定4种成分的质量浓度,计算洗脱率,结果显示,乙醇体积分数为60%时,洗脱率达最大值,为51%,故选用体积分数为60%的乙醇进行洗脱。
2.2.4.5洗脱溶剂用量考察 称取适量处理好的HPD600大孔吸附树脂湿法装柱,取2.2.2项下制备的供试品溶液40 mL,以1 mL·min-1的流速进行动态吸附,吸附完全后加3 BV水洗脱除杂,再用6 BV体积分数为60%的乙醇以1 mL·min-1的流速洗脱,收集洗脱液并浓缩,按照2.1.3项下色谱条件测定4种成分的质量浓度,计算洗脱率,结果显示,在3 BV时已基本洗脱完全,故选用3 BV体积分数为60%的乙醇进行洗脱。
2.2.4.6洗脱流速考察 称取适量处理好的HPD600大孔吸附树脂装3根树脂柱,取2.2.2项下制备的供试品溶液40 mL,以1 mL·min-1的流速进行动态吸附,吸附完全后加3 BV水洗脱除杂,再分别用3 BV体积分数为60%的乙醇以0.5、1、2 mL·min-1的流速洗脱,收集洗脱液并浓缩至50 mL,按照2.1.3项下色谱条件测定总酚酸质量浓度,并精密量取各流速的洗脱液45 mL水浴蒸干,称定质量后计算得总酚酸质量分数分别为2.70%、2.55%、2.69%。结果表明,洗脱流速为0.5 mL·min-1时,总酚酸质量分数最高。
2.2.5响应面法优选纯化工艺 根据单因素考察结果,以4种成分质量分数为考察指标,选取上样液质量浓度、洗脱剂体积分数和洗脱流速3个因素,设计3因素3水平实验方案,见表3。

表3 因素与水平
通过Design-Expert 8.0.6响应面分析软件设计实验,共17组。通过软件对表3的数据进行回归拟合分析,得到质量分数与各因素水平间的二次多项式方程:R=0.035+1.887×10-3A-8.159×10-3B-2.212×10-3C-2.150×10-3AB+3.711×10-4AC+1.970×10-3BC-8.125×10-4A2+4.513×10-3B2-2.475×10-3C2。设计方案见表4。方差分析结果见表5。

表4 响应面设计方案
由表5可知,各因素对吸附率的影响顺序依次为:B(洗脱剂体积分数)>C(洗脱流速)>A(上样液质量浓度)。模型回归分析结果显示,模型P=0.000 7<0.01,表示差异极显著,失拟项P=0.362 6>0.05,表示差异不显著,说明实验设计拟合度良好,误差小;同时决定系数R2=0.953 0,说明实验可靠性较好,模型可用于分析和预测大孔吸附树脂吸附新疆鼠尾草总酚酸的能力。为更直观地反映各因素与响应值的关系,绘制了各因素交互作用的三维响应面图,结果见图2。通过软件分析计算得出最佳纯化条件为:上样液质量浓度为40 mg·mL-1,洗脱剂体积分数为40%,洗脱流速为0.67 mL·min-1。在此条件下4种成分最大理论质量分数之和为5.22%。
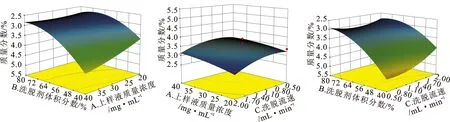
图2 响应面图
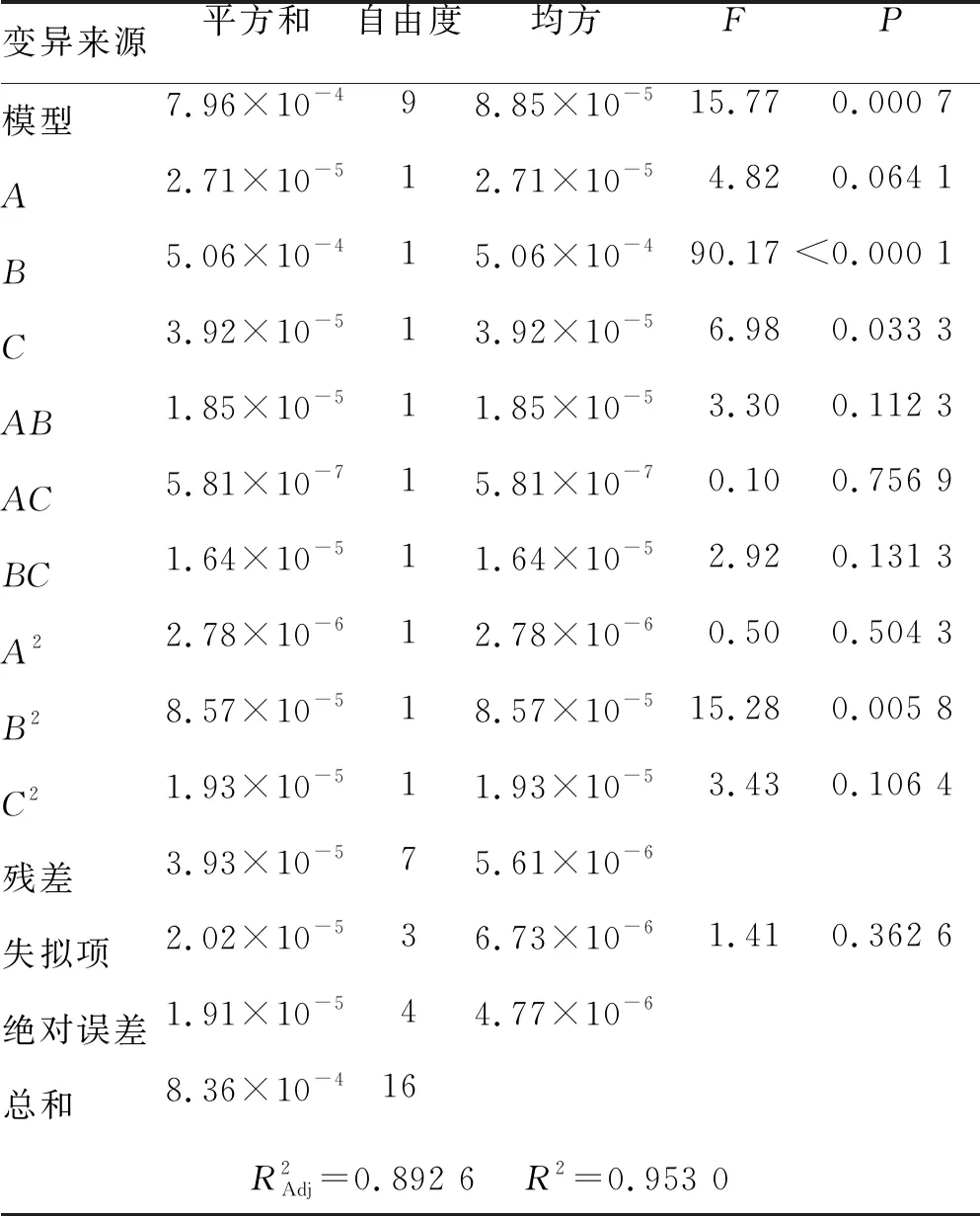
表5 方差分析结果
2.2.6验证实验 按照响应面法优化出的纯化工艺进行验证实验,即上样液质量浓度为40 mg·mL-1,上样体积为40 mL进行吸附,吸附饱和用3 BV水以1 mL·min-1流速洗脱,再用3 BV体积分数为40%的乙醇以0.67 mL·min-1流速洗脱,收集洗脱液后浓缩蒸干,即得总酚酸纯化物,得率为67.6%。按照2.1.3项下方法测定丹参素、原儿茶醛、咖啡酸及迷迭香酸4种成分的质量分数,平行测定3次,其质量分数之和为5.92%,相较于纯化前增加了4.4倍,表明HPD600大孔吸附树脂对新疆鼠尾草总酚酸有纯化作用,是有效的纯化材料。
3 讨论
据文献报道,酚酸类化合物丹参素、原儿茶醛、咖啡酸和迷迭香酸等是鼠尾草属植物的主要活性成分,都具有一定的抗炎、抗氧化作用,能较好地清除体内自由基[19]。其中丹参素能降低H2O2诱导的血管内皮细胞损伤中丙二醛(MDA)的质量分数,提高超氧化物歧化酶(SOD)的活性,增加细胞清除氧自由基的能力[20];原儿茶醛能显著降低紫外线照射的人真皮成纤维细胞(HDF)细胞内活性氧(ROS)、一氧化氮(NO)和前列腺素(PGE2)的水平,还可抑制环氧合酶(COX-2)的表达[21];咖啡酸、迷迭香酸因其具有邻二酚羟基,可通过抑制ROS的产生,升高SOD和谷胱甘肽(GSH)水平,改善小鼠氧化性肺损伤中肺组织的病理变化,发挥保护作用[22-23]。结合DN的发病机制,推测新疆鼠尾草的酚酸类化学成分可能通过抗氧化具有一定防治DN的作用[11,14]。故本实验采用HPLC法同时检测上述4种具有代表性结构的酚酸类化合物作为优化纯化工艺的指标。鉴于对新疆鼠尾草化学成分的研究尚不完善,本研究拟进一步阐明纯化物的化学组成。
通过考察ADS-17、D3520、D301-12、HPD100、S-8、HPD722、HPD500、HPD600、AB-8、HPD400、HP20、DM130及HPD826 13种不同型号和极性的大孔吸附树脂对新疆鼠尾草总酚酸的静态吸附及解吸附功能,最终选择HPD600大孔吸附树脂进行单因素实验。研究表明,新疆鼠尾草的有效成分包括水溶性化学成分和脂溶性化学成分[24],水溶性化学成分中主要是极性较大的酚酸类化学成分,而HPD600为极性吸附树脂,洗脱溶剂为极性较大的乙醇,便于酚酸类化学成分的洗脱,因此HPD600型大孔吸附树脂适用于新疆鼠尾草酚酸类化学成分的纯化。
在考察洗脱溶剂的体积分数时发现,当乙醇体积分数达到60%时,洗脱率最高(51%),当乙醇体积分数从20%增加到60%时,洗脱率增加,当乙醇体积分数大于60%时,解吸能力下降。因为水溶性酚酸需要一定的含水环境,随着乙醇体积分数的增加,酚酸很难被溶出,解吸率也较低。
本实验筛选出的纯化工艺能有效去除杂质,纯化有效成分。纯化物中4种成分的质量分数之和为5.92%。综上所述,该纯化工艺操作简单,参数准确可靠,经济环保,为新疆鼠尾草总酚酸后续的研究奠定了基础。
