玉米叶状Cu2O/Cu负极的制备及其电化学性能
2021-09-04孔建柱王昕璐王进贤
孔建柱,王昕璐,王进贤
(长春理工大学 化学与环境工程学院,长春 130022)
锂离子电池因具有高能量密度,较低的环境污染和低自放电效应等优点,被广泛应用在电动汽车、便携式电子产品和储能设备等领域[1-3]。负极材料做为锂离子电池重要组成部分,一直以来都是科研工作者们研究的对象。金属锂是最早被使用的负极材料,但由锂枝晶引发的安全问题促使人们寻找其他材料来替代锂金属负极材料[4-5]。目前,已经商业化的石墨因其容量较低(372 mAhg-1),所以难以满足大功率设备的需求,所以,开发比容量高、性能好、安全性较高的负极材料具有重要的意义[6]。
在诸多的负极材料中,过渡金属氧化物(TMO)有望成为下一代高性能锂离子电池(LIBs)的电极材料,因为它们的锂存储容量比商用石墨(372 mAh g-1)高两倍以上[7-9]。其中 Cu2O 是一种重要的过渡金属氧化物,且具有资源丰富、成本较低、对环境无污染等一系列优点,被广泛应用于徐料、催化剂、传感器、有色玻璃和太阳能电池等研究领域[10-12]。同时Cu2O也可通过与Li+发生置换反应而存储锂,被认为是一种很有应用前景的锂离子电池负极材料[13]。与其他过渡金属氧化物类似,由于其导电性较差且在充‒放电过程中体积变化较大,不可避免地会引起电极材料的粉化而失去电化学活性,导致容量快速衰减,阻碍了其实际应用[14]。为了解决导电性问题,科研工作者研究了各种策略,包括准备双组份结构或与其他导电材料结合[15-17]。双组份结构可以整合不同功能的金属氧化物表现出较好的协同效应,提高了各组份的固有性质,如电化学反应活性和电子/离子电导率。此外,金属氧化物与导电材料(如石墨烯和碳)的结合[18-19],能容纳金属氧化物的体积膨胀,能够充分利用具有电化学稳定性的活性材料,从而增加导电性。为了解决体积膨胀问题,科研工作者研究了各种策略,包括空心金属氧化物结构已经被用来缓解体积变化的问题,同时缩短了锂离子扩散路径[20-22]。此外,纳米结构的电极材料似乎是最有希望提供的候选者,具有锂离子通道距离短、电子输运能力强、与电解质的接触面积大等优点,可以更好的适应充‒放电过程中体积变化较大,具有更好的电化学性能[23-24]。
鉴于此,本工作以阳极氧化法及后续高温煅烧制备了玉米叶状Cu2O/Cu锂离子电池负极材料,并研究其微观形貌、结构及锂电性能。此外,在这种情况下不需要粘合剂和导电剂集成电极,将改善电池的整体能量密度。
1 实验方法
1.1 样品制备
第一步用砂纸打磨铜箔(纯度为(99.99%)去除表面的氧化层;第二步用丙酮、异丙醇、无水乙醇和二次水分别超声清洗15 min去除铜箔表面的油污和杂质;第三步用恒压直流电压在不同的电压下进行阳极氧化反应,腐蚀液为3 mol/L氢氧化钾,反应时间为1 h;第四步将阳极氧化完成的铜箔在350℃下退火1 h,得到玉米叶状Cu2O电极材料。
1.2 材料的测试与表征
采用TD-3000 X射线粉末衍射仪对材料的物相结构进行分析。测试时条件:以Cu靶作为辐射源,工作电流为30 mA,工作电压为40 kV。所得谱图采用Jade 6.0软件定性分析产物的晶体结构和晶胞参数等;采用XL-30 ESEM-FEG场发射扫描电镜对制备的电极材料进行形貌表征。
电化学性能测试采用CR-2032型纽扣电池,本实验采用三维微纳结构的铜箔作为集流体,因此无制浆和涂膜两步操作,将干燥完成的材料切片作为负极极片。电池组装时玉米叶状Cu2O/Cu作为负极极片,金属锂片为对电极,电解液的溶剂采用碳酸乙烯酯(EC):碳酸二乙酯(DMC)体积比为 1∶1,加入电解质 LiPF6,并保持电解液浓度为1 mol L-1。在充满氩气气氛内的手套箱中完成电池组装。采用BTS-5V6A电池性能测试系统对组装的半电池进行恒流充放电测试,测试条件:电压范围为0.01~ 3.0 V,循环性能测试的电流密度为100 mAg-1,倍率性能测试的电流密度依次为 100 mAg-1、200 mAg-1、300 mAg-1、500 mAg-1、1 000 mAg-1、100 mAg-1。采用 CHI760D电化学工作站对电池进行电化学交流阻抗测试,测试条件:频率范围为10~ 100 kHz,振幅为0.5 mV。测试得到的交流阻抗图谱通过Zview软件进行数据拟合,拟合数值误差小于10%。
2 结果与讨论
2.1 材料结构与形貌表征
图1为不同阳极氧化电压下所制备Cu2O的X射线衍射谱图。从XRD图谱中可以看出合成的样品均有明显的衍射峰,表明合成的样品具有良好的结晶性,所制备的Cu2O样品为立方相结构氧化亚铜(PDF#78-2076)。随着氧化电压的不同,Cu2O的峰明显的发生了强弱的变化,说明氧化亚铜的晶格常数随着阳极氧化电压的变化发生了显著的改变。经过数据处理,将Cu和Cu2O的X射线衍射谱图进行拟合得到阳极氧化后Cu和Cu2O的晶格常数。表1展示了不同阳极氧化电压下Cu和Cu2O的晶格常数。从表1可以看出在不同阳极氧化电压为0.4 V、0.8 V和1.0 V下Cu晶格常数变小了,体积也变小了;尤其是0.8 V下Cu晶格常数变得最小边长3.601 34 A,体积46.71 A3,晶粒尺寸居中38 A。从表格可以看出不同阳极氧化电压下条件下Cu2O晶格常数发生了一些变化,但是变化不大。在0.2 V、0.4 V、0.6 V和1.0 V下Cu2O晶格常数变小了,体积也变小了;尤其是0.2 V下Cu2O晶格常数变得最小,边长为5.982 3 A,体积214.1 A3,晶粒尺寸居中30.8 A。在0.8 V和1.2 V下Cu2O晶格常数变大了,体积也变大了;尤其是1.2 V下Cu2O晶格常数变得最大,边长6.014 7 A,体积217.6 A3,晶粒尺寸居中26.9 A。综上所述不同的阳极氧化电压使Cu2O和Cu晶格参数发生了变化。
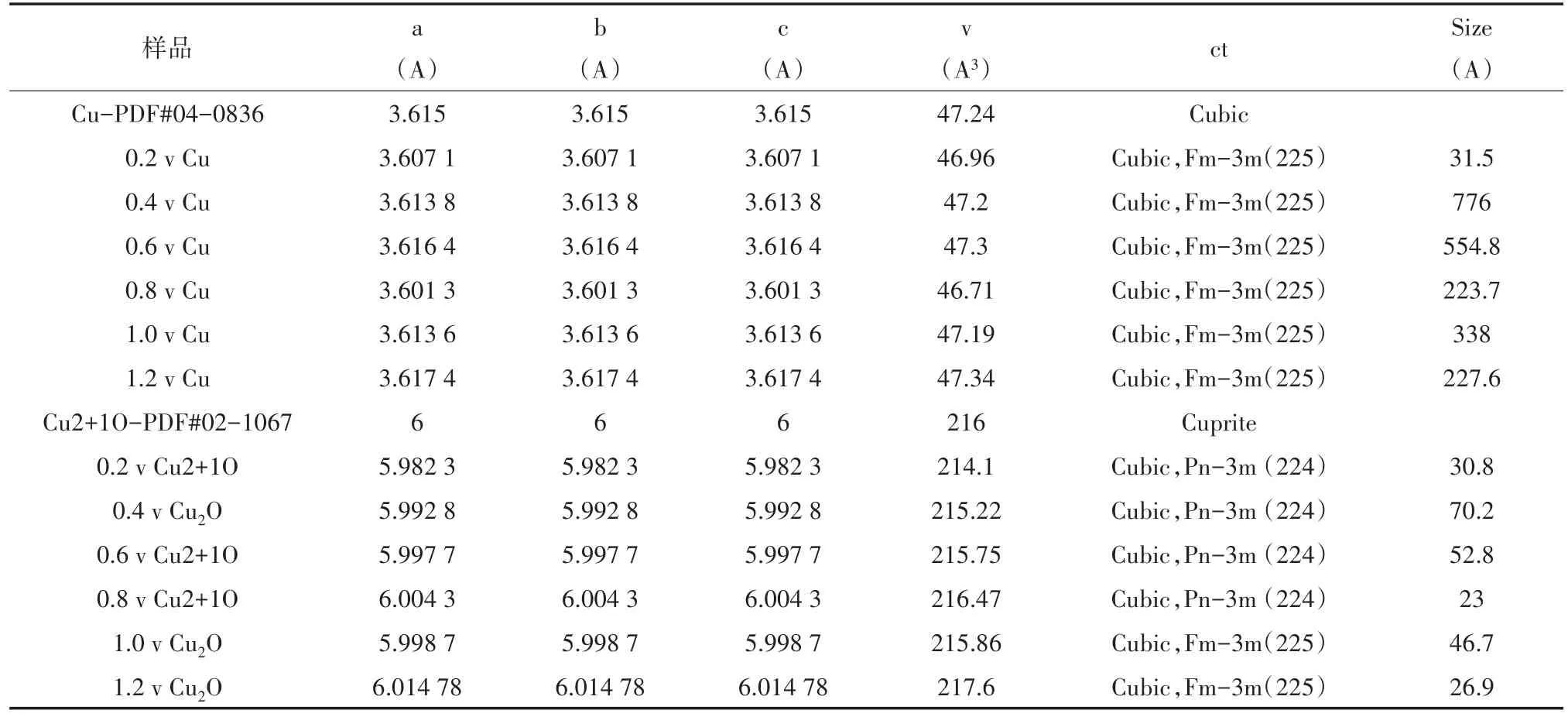
表1 Cu2O和CuO晶格参数
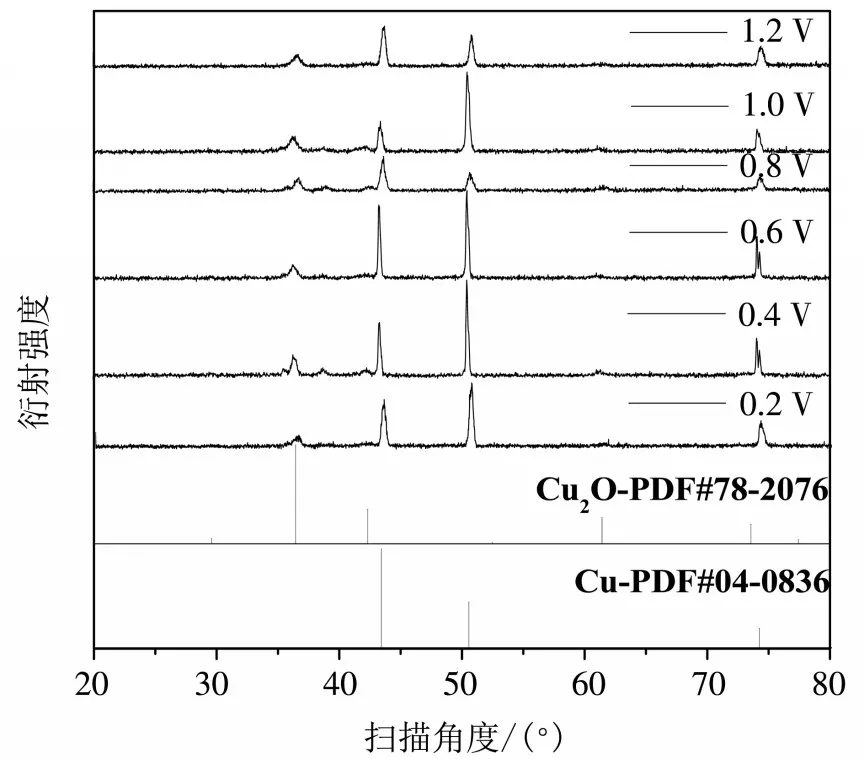
图1 在不同的电压阳极氧化下Cu2O的XRD谱图
图2为不同电压 0.2 V(a)、0.4 V(b)、0.6 V(c)、0.8 V(d)、1.0 V(e)、1.2 V(f)阳极氧化下Cu2O的SEM照片。
图2为不同阳极氧化电压下铜箔阳极氧化后的形貌。从SEM上面看出在阳极氧化电压为0.2 V、0.4 V条件下铜箔表面刚刚开始有变化出现了裂纹并出现了一些针状的氧化亚铜,如图2(a),图2(b);在阳极氧化电压为0.6 V、0.8 V条件下铜箔表面出现了大量的裂纹并出现了一些针状的氧化亚铜,针状的氧化亚铜尺寸明显变大并出现了裂纹聚结,如图 2(c),图 2(d);在阳极氧化电压为1.0 V条件下铜箔表面出现了玉米叶子状的氧化亚铜,并且均匀的覆盖在铜箔表面,如图2(e);在阳极氧化电压为1.2 V条件下铜箔表面严重的聚结氧化亚铜,铜箔表面被腐蚀成镂空状,如图 2(f)所示。

图2 不同电压阳极氧化下Cu2O的SEM照片
2.2 电化学性能测试
图3为六种电极材料在100 mAg-1电流密度下,电压范围0.01~ 3 V的前三圈充放电曲线。表2为Cu2O前三圈充放电容量和库伦效率,通过曲线和表2看出电压为0.6 V和1.0 V首圈的放电过程(嵌锂),电池的容量高于相应的充电过程(脱锂)。

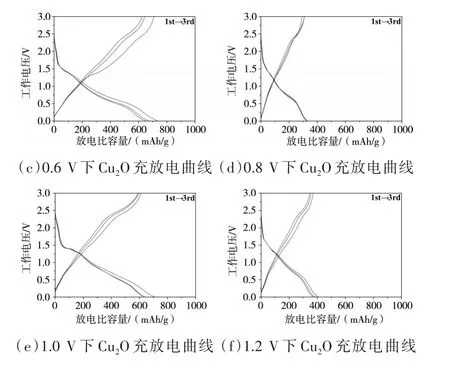
图3 不同电压阳极氧化下Cu2O前三圈充放电曲线

表2 Cu2O前三圈充放电容量和库伦效率
实验测得的首圈放电比容量分别为733.355 mAhg-1、705.31 mAhg-1,对应的充电容量为 708.968 mAhg-1、611.892 mAhg-1,库 伦 效 率 为 103.44%、115.267%。虽然1.0 V阳极氧化样品的容量高,但是起伏比较大,0.6 V阳极氧化样品容量稳定性更好。从图中可以看出第一圈嵌锂(放电)过程,放电曲线在1.5 V和0.75 V有两个放电平台,开路电位到1.75 V对应着Li+的嵌入,同时伴随着 SEI膜的生成以及电解液的分解,而0.75 V出现的较长的放电平台,主要贡献了电极整体的放电容量,主要对应着被还Cu2O原成金属Cu,以及无定型的Li2O的生成,而在脱锂(充电)过程中,充电曲线在1.25 V和2.25 V出现两个充电平台,对应这金属Cu的氧化。
图4为六种电极材料的循环性能图。由图可知在0.2 V、0.4 V、0.6 V、0.8 V、1.0 V、1.2 V的初始容量分别为179.183 mAhg-1、598.263 mAhg-1、733.355 mAhg-1、328.642 mAhg-1、705.31 mAhg-1、406.34 mAhg-1。放电容量随着循环圈数增加而逐渐降低,这是因为在循环过程中,Li+反复地从材料中嵌入脱出从而导致结构逐渐改变,使材料中Li+可以嵌入和脱出的有效位点减少,从而导致容量下降。因为材料的活化作用,1.0 V电极在经过25圈循环后容量逐渐升高,当电极材料没有被活化时,Li+的嵌入与脱出的活性位点少,当经过几圈电化学循环后活性位点被激发,使容量上升。通过循环性能曲线可以看出1.0 V电极材料稳定性最好,容量衰减的最缓慢,经过300圈循环后,容量仍然有887 mAhg-1,库伦效率为91%,循环性能最好。实验表明在1.0 V电压下电极材料的循环性能最好。

图4 不同电压下Cu2O在电流密度为100 mAg-1,0.01~ 3 V电压范围内的循环性能图
图5为六种电极材料的倍率性能图。由图5可知,在每个电流密度下循环10圈,六种电极材料在不同的电流密度下充放电容量都较为稳定。当充放电电流密度由100 mAg-1逐渐增加到1 000 mAg-1时,1.0 V下的Cu2O电极仍然有487 mAg-1放电比容量。该电极材料在经历了大电流密度循环后,当电流密度再次回到100 mAg-1,其放电容量仍然可以恢复到初始容量。上述结果表明玉米叶状结构负极材料具有良好的结构稳定性。

图5 不同电压下Cu2O的倍率性能图
图6(a)为不同阳极氧化电压下6个电极材料的交流阻抗曲线。交流阻抗曲线由高频区、中频区和低频区组成。高频区左侧与横轴的交点表示溶液电阻Re,中频区域半圆为电荷传质电阻Rct,在低频区内Z'与Z″的斜率为Warburg阻抗Zw。图6(b)是拟合后的阻抗曲线,利用交流阻抗测试数据计算锂离子的传导率(D)。其中,Warburg因子σ由低频区Zˊ与角频率的平方根ω-1/2的关系曲线确定。
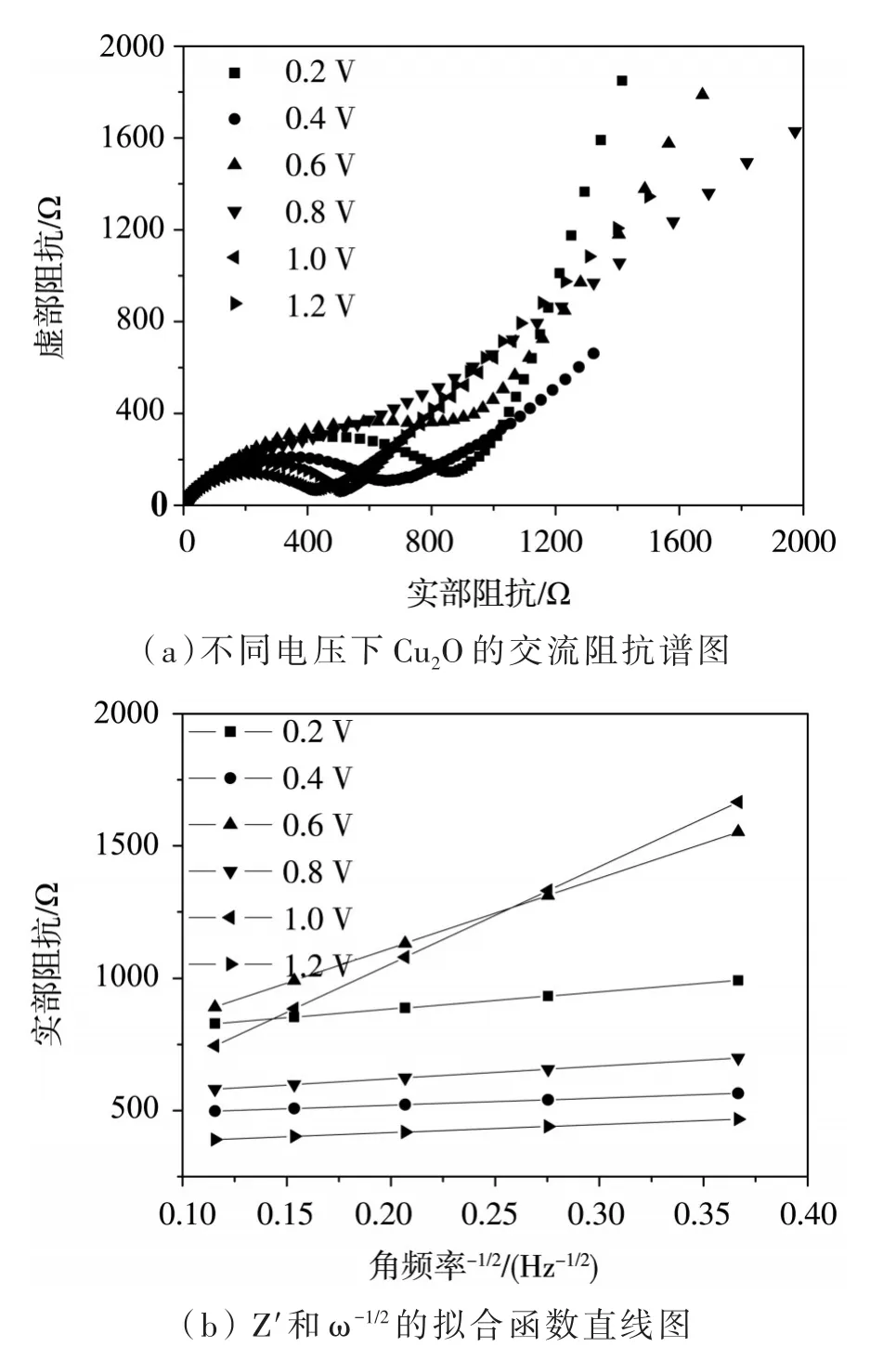
图6 不同电压下Cu2O的交流阻抗谱图和Z'与ω-1/2的拟合函数直线图
表3可以准确得出1.0 V下具有最小的溶液电阻Re(0.465 47 Ω)和最小电荷传质电阻Rct(471.1 Ω),其Warburg因子较大,为3 667.941 Ω·s-0.5,这说明了Li+在进入材料内部时阻力较大,且1.0 V下材料 Li+传输速率D较大,为 4.82×10-15cm2·s-1,证明在材料内部,Li+的扩散速率较快。
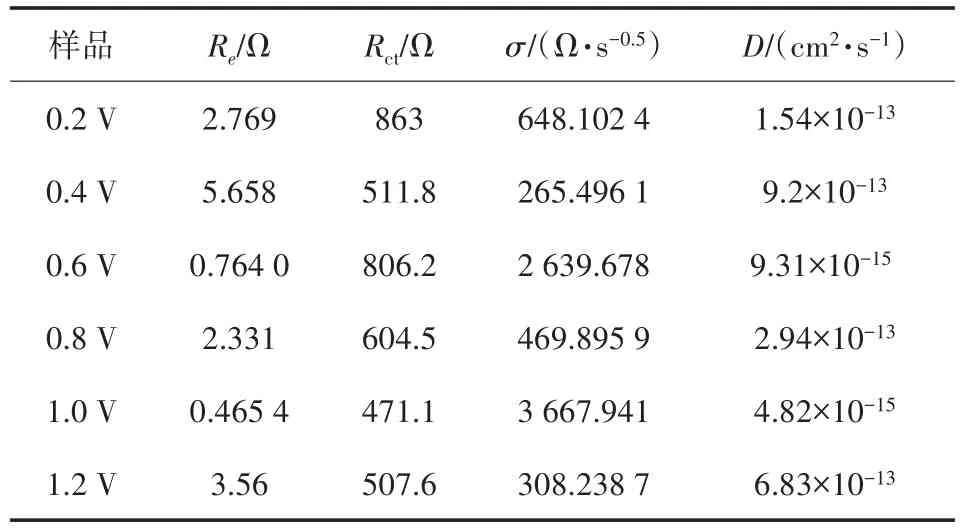
表3 不同电压下Cu2O的电化学交流阻抗参数
3 结论
通过阳极氧化法合成了Cu2O,对所获得的样品进行了XRD、SEM测试与电化学性能表征,使用Cu2O为负极材料、锂片为正极组装成CR-2032型半电池,系统地研究了阳极氧化电压对样品的结构、形貌、粒径分布以及电化学性能造成的影响,得出结论如下:
(1)制备该材料的最优反应电压为1.0 V、氢氧化钾的浓度为3 mol/L、反应时间为1 h、在此合成条件下可以合成出形貌最为均匀的玉米叶子状的氧化亚铜。
(2)通过电镜观察发现材料的表面形貌发生了从出现裂纹变成出现针状到再后来变成均匀的玉米叶子状最后聚结在一起的变化过程,在电压为1.0 V条件下获得的材料形貌最均匀,其相貌像玉米叶子。
(3)电化学性能测试中,阳极氧化电压为1.0 V的电化学性能最为突出,在100 mAg-1电流密度条件下的首次容量可以达到733.355 mAhg-1,库伦效率为103.44%。经过300圈充放电循环后,其放电容量高达为887.3 mAg-1,容量得到明显的提升。
(4)通过电化学工作站测试,阳极氧化电压为1.0 V的电荷转移电阻最小,为Rct=0.465 74 Ω,Warburg因子σ为 3 667.941 Ω·s-0.5,Li+扩散系数为 4.82×10-15cm2·s-1,证明了材料内部的 Li+扩散速度较快。
