黄精多糖体外消化特性及对Ⅱ型糖尿病小鼠肠道菌群的调节作用
2021-09-02杨明琛袁梦欣陆维包怡红柴洋洋
杨明琛,袁梦欣,陆维,包怡红,2,柴洋洋,2
(1.东北林业大学林学院,黑龙江哈尔滨 150040)(2.黑龙江省森林食品资源利用重点实验室,黑龙江哈尔滨 150040)
多糖是一种天然高分子多聚物,在自然界中广泛存在,在生命体的各项生命活动中承担重要的职责,对生命体的正常运转起到非常重要的作用。对植物多糖的研究是目前的研究热点。我国植物资源丰富,植物多糖是植物中除蛋白质和核酸外的主要活性成分之一,具有多样生物活性,且副作用小、来源广泛[1],对植物多糖的研究提供了有力的条件。有大量的研究结果表明植物多糖具有降血糖、抗氧化、抗肿瘤等功能,特别是对植物多糖降血糖方面的研究,已经取得较大的进展。植物多糖在人体内发挥多种生物活性作用,这些作用的发挥主要与其结构以及消化、酵解和吸收过程有关[2]。许多植物多糖是在被人体消化酵解分解成小分子物质后才能进入细胞内发挥作用。
黄精属(Polygonatum)是药食同源的百合科植物[3],主要分布在北半球温带地区,如中国、印度、韩国、日本等,还有欧洲和北美洲的一些国家。黄精(Polygonatum sibiricum)在我国主要分布于黑龙江、辽宁、河北等地,资源丰富,具有广阔的开发前景,对黄精的研究也取得一定的进展,已经被应用于功能食品以及保健品等的开发中。目前黄精已有多种生物活性被报道,如抗氧化性和抗衰老性等。此外,现代药理研究表明,黄精还具有降血糖、调节血脂、抗肿瘤、抗疲劳、抗骨质疏松、增强免疫力等功能[4,5]。黄精有多种活性成分,包括多糖、甾体皂苷类等,具有较高的食用价值。黄精多糖是黄精的主要活性成分之一,属于杂多糖,其成分有半乳糖、鼠李糖、木糖、阿拉伯糖、葡萄糖[6],具有降血糖、降血脂、调节免疫力、抗肿瘤、抗病毒等功效[7]。
随着对植物多糖的深入研究,关于植物多糖对肠道菌群结构功能的调节作用也被越来越多的学者注意到,并且植物多糖还会影响肠道稳态和肠道微生物之间的相互作用,从而起到对人体健康的调节作用。由于植物多糖属于大分子多聚物,人体无法直接消化吸收利用,肠道菌群能够帮助宿主消化自身无法消化的物质,将植物多糖分解为一系列具有生物活性的小分子物质[8]。同时肠道菌群还对宿主细胞起到一定的调节、保护、促进营养吸收等作用。此外,进入肠道内的多糖也会对肠道菌群的组成和生理状态产生一定的影响。因此宿主和肠道菌群之间是一种互利共生的关系[9],目前我国糖尿病的发病率逐年增长,特别是Ⅱ型糖尿病。研究人员发现肠道菌群对糖尿病的诱发和控制有一定的作用。通过调整肠道菌群的结构,不仅对糖尿病有一定的治疗作用,甚至能够起到一定的预防作用[10]。
本文主要研究黄精多糖的消化特性及其对Ⅱ型糖尿病鼠肠道菌群的影响。通过黄精多糖体外消化模拟实验,研究黄精多糖的消化特性;进一步采用Ⅱ型糖尿病鼠粪便,建立黄精多糖体外酵解模型,并对酵解产物进行16S rDNA测序分析,探究黄精多糖对Ⅱ型糖尿病小鼠肠道菌群的影响。
1 材料与方法
1.1 材料与设备
1.1.1 材料
黄精购自哈尔滨药材市场,Ⅱ型糖尿病小鼠购自青岛大任富城畜牧有限公司(许可证号:SCXK (Lu)2014-0007)。
1.1.2 试剂
瓜尔豆胶,购自北京索莱宝科技有限公司;胆酸钠、粘蛋白、α-淀粉酶、果胶、刃天青、L-半胱氨酸购自大连美仑生物技术有限公司;一水合硫酸镁购自上海阿拉丁生化科技股份有限公司;阿拉伯半乳聚糖购自上海源叶生物科技有限公司;牛血清蛋白购自北京博奥拓达科技有限公司。其他试剂均为国产分析纯。
1.1.3 仪器
高速多功能粉碎机:上海市顶帅工贸有限公司;电子天平:上海佑科仪器仪表有限公司;超声波清洗机:宁波新芝生物科技股份有限公司;真空旋蒸仪:郑州长城科工贸有限公司;电热鼓风干燥箱:上海一恒科学仪器有限公司;UV-5500PC紫外可见分光光度计:上海元析仪器有限公司;IS-RSD3台式恒温振荡器:美国精骐有限公司;电热恒温水浴锅:天津市泰斯特仪器有限公司;酶标仪:美国伯腾仪器有限公司;离心机:湖南凯达科学仪器有限公司。
1.2 方法
1.2.1 黄精多糖提取与含量测定
1.2.1.1 黄精多糖提取
将黄精粉末按照液料比15:1加入蒸馏水,使用超声波清洗仪在60 ℃下浸提90 min,离心(4000 r/min,10 min),取上清液在55 ℃下旋蒸得浓缩液,加入3倍体积75%乙醇醇沉12 h后离心,取沉淀冷冻干燥得到黄精多糖粗提物(PSP),用Sevage法除蛋白,冷冻干燥得到PSP1。计算得率,取三个平行的均值。公式如下:

式中:W1为样品中的PSP1的得率,%;M为样品的质量,g;M1为样品中的PSP1的质量,g。
1.2.1.2 含量测定
取PSP1样品进行含量的测定,配置10 mg/mL的样品溶液。总糖含量使用苯酚硫酸法[11]测定,还原糖含量使用 DNS法[12]测定,蛋白质含量使用考马斯亮蓝法[13]测定。计算PSP1的多糖含量,计算公式如下:

式中:W2为样品中黄精多糖含量,%;W3为样品溶液中可溶性总糖含量,%;W4为样品溶液中还原糖含量,%。
1.2.2 体外消化模拟
1.2.2.1 口腔消化模拟
口腔电解质的配置参考文献[5]稍作修改:NaCl 0.7644 g、KCl 1.491 g、CaCl20.1332 g溶于1 L的蒸馏水中,用1 mol/L HCl和1 mol/L NaHCO3将pH调至6.9(±0.05)。
取6支试管,分成3组,每支试管都加入10 mg/mL PSP1溶液5 mL与口腔电解质5 mL,α-淀粉酶0.05 g,37 ℃消化2 min,每组取一支试管沸水浴2 min灭酶活,储存待测,剩下的口腔消化液做进一步消化。
1.2.2.2 胃部消化模拟
胃液的配置参考文献[5]稍作修改:KCl 2.2 g,NaCl 6.2 g,CaCl20.3 g,NaHCO31.2 g溶于2 L蒸馏水中,用1 mol/L HCl将pH调至2。
取胃液100 mL,加入胃蛋白酶0.03 g,最终酶活达到 500 U/mL。加入经过口腔消化后的消化液 10 mL,在37 ℃下恒温振荡2 h,分别在15、30、60、90、120 min时取消化液2 mL,沸水浴2 min灭酶活,储存待测,剩下的胃部消化液做进一步消化。
1.2.2.3 肠道消化模拟
肠液的配置参考文献[5,14]:KCl 0.65 g,NaCl 5.4 g,CaCl20.33 g溶于1 L蒸馏水中,用1 mol/L NaOH将pH调至7。胆汁:4%胆酸盐溶液。
模拟肠道消化:取肠电解质100 mL加入胰酶0.04 g,使最终酶活达到100 U/mL,加入胆汁12.5 mL,加入经过口腔和胃部消化的多糖溶液10 mL,在37 ℃下恒温振荡2 h,分别在15、30、60、90、120 min时取消化液2 mL,沸水浴2 min灭酶活,储存待测。
1.2.2.4 含量测定
取各阶段的消化液样品,采用 DNS法测定还原糖含量。方法同1.2.1.2。根据OD值和葡萄糖标准曲线,计算还原糖含量。
1.2.2.5 分子量测定
使用凝胶色谱法测定消化液中多糖分子量[15,16]。取黄精多糖的消化液,用0.22 µm水系膜过滤后的滤液进行色谱分析。色谱分离条件如下:色谱柱:PL aquagel-OH 30(7.5×300 mm,8 µm)和PL aquagel-OH 30(7.5×300 mm,8 µm)凝胶柱串联使用;检测器:Agilent 1260示差检测器;流动相:水;柱温:30 ℃;流速1 mL/min;进样量:50 μL。
1.2.3 体外酵解实验
1.2.3.1 配制发酵培养基
酵解培养基的配制[17]:氯化钠4.5 g,氯化钾4.5 g,果胶2.0 g,粘蛋白4.0 g,一水合硫酸镁0.69 g,瓜尔胶1.0 g,L-半胱氨酸0.8 g,磷酸二氢钾0.5 g,磷酸氢二钾0.5 g,酪蛋白3.0 g,阿拉伯半乳聚糖2.0 g,碳酸氢钠1.5 g,胆酸盐0.4 g,七水合硫酸亚铁0.005 g,氯化钙0.08 g,1 mL Tween 80和4 mL(0.025%,W/V)刃天青(厌氧指示剂),用蒸馏水定容于1.0 L容量瓶中,在121 ℃条件下灭菌30 min,备用。
1.2.3.2 体外发酵
通过高脂饮食-链脲霉素诱导[18]的方法建立Ⅱ型糖尿病鼠模型,采用应激性排便法,将小鼠尾部提起,轻轻按压其下腹部,收集小鼠新鲜粪便于无菌EP管中。取Tween 0.5 mL,酵母2 g,蒸馏水定容至500 mL配制成溶液。将小鼠的新鲜粪便加入到溶液中,配置成20%(W/W)的固液混合物,涡旋混匀,随后立即转入到厌氧操作台中,用两层滤布过滤,收集滤液,备用。
根据文献[17]的方法稍作改进:以无菌蒸馏水作为对照组(CG),黄精多糖作为实验组(PG),最终酵解培养体系的体积组成为小鼠粪便液:发酵培养液:多糖=4:4:2,将样品发酵液转移到厌氧袋中密封,放入37 ℃培养箱,48 h后取出,打开厌氧袋并迅速冰水浴10 min,终止多糖的酵解反应。将样品发酵液4000 r/min离心10 min,取上清液进行16S rDNA分析。
1.2.3.3 肠道菌群分析
使用E.Z.N.A.®Stool DNA Kit肠道内容物DNA提取试剂盒提取酵解液中肠道菌群DNA,操作步骤按照试剂盒说明书进行。通过引物341F(5'-CCTACGGG NGGCWGCAG-3')和805R(5'-GACTACHVGGGTA TCTAATCC-3')的扩增16S rDNA的V3-V4区。扩增和上机测序分析工作委托杭州联川生物技术股份有限公司完成。Fqtrim(v0.94)软件将原始序列进行过滤,并获得高质量的读段。为了分析微生物群落组成的多样性,使用Vsearch软件(v2.3.4)对最终序列进行聚类以获得操作分类单位(OTU),并在不同物种分类级别对OTU进行统计和分析。利用QIIME2软件统计微生物群落的α多样性和β多样性,它们包含的指标可以反映微生物群的多样性。SILVA(Release 132)和NT-16S数据库用于物种分类和随后的物种组成分析以确保注释结果完整准确。
1.2.4 数据处理
所有试验均重复 3次,数值用平均值±标准差表示(n=3)。采用SPSS 22.0和Excel 2016软件对实验数据进行分析,方差分析采用t检验,p<0.05表示具有显著统计学意义。
2 结果与讨论
2.1 黄精多糖提取与含量测定
黄精多糖经超声辅助热水浸提,乙醇沉淀获得PSP,对黄精多糖进行脱蛋白处理后,得到黄精多糖样品 PSP1,得率为 19.93%。经测定总糖含量为84.04%,还原糖含量为0.95%,蛋白质含量为0.71%,多糖含量为83.09%。
2.2 黄精多糖的体外消化模拟
在消化过程中,导致多糖相对分子量发生变化的因素主要是多糖的解聚作用和糖苷键的断裂[19,20]。本研究对黄精多糖进行体外消化模拟,探究黄精多糖的消化特性。如图和表所示,在各个消化阶段,PSP1的相对分子质量基本不变。随着消化时间的延长,PSP1相对分子质量逐渐降低,还原糖含量逐渐升高。在经过胃部模拟消化2 h后,PSP1相对分子量由24.19 ku降低为20.39 ku,还原糖含量从0.17 mg/mL增加至0.20 mg/mL。差异具有显著性(p<0.05)。在小肠模拟消化2 h后,PSP1相对分子量由28.85 ku降低为24.35 ku,还原糖含量从0.17 mg/mL增加至0.19 mg/mL。差异具有显著性(p<0.05)。在陈春等[21]的研究中,桑葚多糖在胃部消化模拟过程中,相对分子量显著下降,还原糖含量上升,可能是由于胃部酸性环境造成,但是在肠道消化阶段相对分子量未发生显著变化,可能是由于多糖糖苷键种类、分子量、多糖的组成等因素不同导致。黄精多糖经过胃肠消化模拟,相对分子质量有一定程度的下降,同时还原糖含量有相应程度的上升,说明在肠胃消化过程中相对分子质量的降低主要是由于糖苷键的断裂引起。黄精多糖在消化过程中会发生一定程度的降解,可能是受到胃部酸性环境以及消化道中消化酶的影响,导致黄精多糖发生多糖的解聚作用,部分糖苷键断裂,还原糖含量上升。但是从PSP1相对分子质量的变化趋势可以得出,虽然黄精多糖会在消化过程中发生一定的降解作用,但是大部分的黄精多糖能够达到大肠末端,被肠道菌群利用。

图1 黄精多糖体外模拟口腔(a)、胃部(b)和小肠(c)消化不同时间点的HPGPC色谱图Fig.1 HPGPC chromatograms of polysaccharide after simulated mouth (a), gastric (b) and small intestinal (c)digestion

表1 口腔、胃和小肠消化不同时间点的黄精多糖的相对分子质量(Mw)和还原糖含量的变化(CR)Table 1 Molecular weight distribution and content of reducing sugars (CR) of polysaccharide at different time points in gastric and small intestinal digestion
2.3 肠道菌群多样性和物种组成分析
2.3.1 Alpha多样性分析
Alpha多样性指的是肠道菌群的多样性,能够综合反映肠道菌群的物种丰富度和均匀度。其中物种丰富度指的是肠道菌群的物种多样性,均匀度指的是物种组成多少的整体分布。本研究通过稀释曲线和物种相对丰度曲线综合评估酵解产物的Alpha多样性[22]。
稀释曲线是指从一个样测序得到的所有序列进行随机数目的抽取,并且统计随机抽取得到序列的OTU数目,以抽取序列数目为横坐标,相应的 OTU数目为纵坐标,绘制曲线。稀释曲线能够统计feature的丰富度,通过不同样品的稀释曲线能够直接观察物种多样性的差异,此外稀释曲线还能够直接反映测序数据量的合理性,当曲线趋于平坦时,说明测序数据量趋于合理。如图2所示,小鼠肠道菌群稀释曲线趋于平坦,说明测序数量足够大,更多的数据只会增加少量的新的OTU,测序结果具有一定的合理性,可以反映样品中绝大多数的微生物信息。在测序深度相同的情况下,PG组的丰富度显著高于CG组,说明黄精多糖对小鼠的肠道菌群能够起到一定的调节作用,提高肠道菌群的丰富度。

图2 基于OUT总数的肠道菌群稀释曲线Fig.2 Dilution curve of intestinal flora based on total OUT
物种相对丰度曲线也常用于分析样本中肠道菌群的物种多样性,主要通过物种丰富度和物种均匀度两项指标综合反映物种的多样性。其中物种相对丰度曲线的宽度反映样品的丰富度,形状反映样本中物种的均匀度。如图3所示,6个样品的曲线趋势在总体上较为相似。在水平方向上,PG组的丰富度显著高于CG组。从样品曲线的形状进行分析,图中各个样品曲线的平滑程度较好,在末端有部分曲折,整体趋势平缓,说明两组样品的物种分布均匀[23]。
图3 小鼠肠道菌群物种相对丰度曲线Fig.3 Relative species richness curve of mice intestinal flora
2.3.2 Beta多样性分析
Beta多样性分析主要用于分析不同样本之间的物种组成结构差异性。基于样品的feature分析结果,综合unweighted unifrac和weighted unifrac两个指标进行UPGMA聚类分析,衡量两个样本组之间的差异性。图中不同颜色代表不同分组,聚类树主要显示样本之间的相似度,样本间的分支越短,说明两个样本的物种组成结构越相似。UPGMA聚类分析能够直观地表达不同样本之间的物种组成结构差异程度,如图4所示,比较PG组和CG组的分支,结果显示两个样本组分别有各自聚集的趋势,说明两个样本组的组内差异性显著低于组间差异性,既两个样本组的物种组成结构差异显著,说明黄精多糖对酵解产物中肠道菌群的物种组成结构具有一定的调节作用。

图4 小鼠肠道菌群UOGMA聚类分析Fig.4 Clustering analysis of mice intestinal flora UOGMA
2.3.3 在门水平上的菌群丰度及差异
为了进一步分析黄精多糖对肠道菌群的影响,通过对小鼠粪便中微生物进行测序和生物信息学分析,将微生物由门到种进行各个水平上的分类,绘制肠道菌群门(Phylum)水平物种组成柱状图。如图5所示,肠道菌群在门水平上的优势菌门主要有厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)等[24]。其中 PG 组中厚壁菌门(Firmicutes)占57.44%,变形菌门(Proteobacteria)占30.79%,拟杆菌门(Bacteroidetes)占10.55%。而CG组中厚壁菌门(Firmicutes)占84.27%,变形菌门(Proteobacteria)占8.81%,拟杆菌门(Bacteroidetes)占6.26%。经过黄精多糖的干预后,肠道菌群的厚壁菌门(Firmicutes)相对丰度下降 26.83%,变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)的相对丰度分别提高21.98%、4.29%。门水平中,厚壁菌门、拟杆菌门和变形菌门是最优势菌门,占比90%以上。研究表明,糖尿病患者在高血糖的同时往往伴随菌群失调。与正常人相比,糖尿病患者肠道菌群中的厚壁菌门的丰度显著上升,而拟杆菌门的丰度显著降低,厚壁菌门与拟杆菌门的比例也显著升高[25]。厚壁菌门和拟杆菌门对宿主能量的吸收和代谢有协同作用,肠道菌群经过黄精多糖的酵解之后,菌群结构往正常人的方向发展。说明黄精多糖对肠道菌群结构组成有明显的调节作用,并且这种调节作用对人体是有益的。姜雅杰等[26]的研究表明,正常小鼠和Ⅱ型糖尿病小鼠的肠道菌群对比,拟杆菌门的相对丰度显著升高,厚壁菌门相对丰度显著降低。和本研究结果一致,说明黄精多糖对Ⅱ型糖尿病小鼠的肠道菌群有显著的改善调节作用。

图5 小鼠肠道菌群门水平物种组成柱状图Fig.5 Phyla species composition of mice intestinal flora at phylum level
2.3.4 在属水平上的菌群丰度及差异
如图6所示,肠道菌群从属(Genus)分类水平上比较,优势菌属有乳酸菌属(Lactobacillus)、韦荣氏球菌属(Veillonella)、埃希氏菌属(Escherichia-Shigella)、克雷伯氏菌属(Klebsiella)等。其中,PG组中乳酸菌属(Lactobacillus)占34.02%、韦荣氏球菌属(Veillonella)占 20.88%、埃希氏菌属(Escherichia-Shigella)占 15.75%、克雷伯氏菌属(Klebsiella)占14.11%、拟杆菌属(Bacteroides)占2.95%、普雷沃菌属(Prevotella_9)占 2.63%、狄氏副拟杆菌(Parabacteroides)占2.52%。而CG组中,乳酸菌属(Lactobacillus)占 77.69%、韦荣氏球菌属(Veillonella)占 2.33%、埃希氏菌属(Escherichia-Shigella)占 3.94%、克雷伯氏菌属(Klebsiella)占 4.49%、拟杆菌属(Bacteroides)占1.40%、普雷沃菌属(Prevotella_9)占 0.34%、狄氏副拟杆菌(Parabacteroides)占0.41%。PG组和CG组对比,乳酸菌属(Lactobacillus)相对丰度降低43.67%,韦荣氏球菌属(Veillonella)、埃希氏菌属(Escherichia-Shigella)和克雷伯氏菌属(Klebsiella)相对丰度分别提高18.55%、11.81%、9.62%。此外,拟杆菌门的拟杆菌属(Bacteroides)、普雷沃菌属(Prevotella_9)、狄氏副拟杆菌(Parabacteroides)分别升高1.55%、2.29%、2.11%。研究表明[27]普雷沃菌属能够产生乙酸和琥珀酸及少量的异丁酸、异戊酸等代谢产物,体内普雷沃菌的丰度提高能减少机体过敏以及肥胖的发生率。刘双江等[28]的研究表明狄氏副拟杆菌能通过产生琥珀酸和次级胆汁酸减轻肥胖和代谢功能障碍。以上表明黄精多糖对糖尿病鼠的肠道菌群有显著的调节作用。周建波等[29]对于黄精生物活性的研究发现,口服黄精多糖能够改善肠道菌群,起到预防糖尿病的作用。
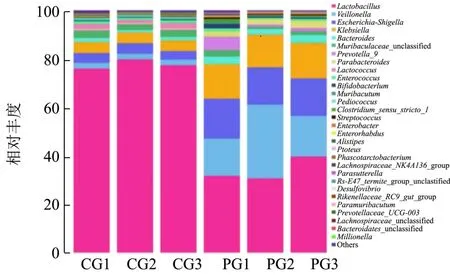
图6 小鼠肠道菌群属水平物种组成柱状图Fig.6 Phyla species composition of mice intestinal flora at genus level
3 结论
3.1 本文对黄精多糖的消化特性进行探究,通过体外消化模拟和体外发酵实验探究黄精多糖的消化规律及其对Ⅱ型糖尿病小鼠肠道菌群的影响。首先提取黄精多糖,得率为19.93%,总糖含量为84.04%,还原糖含量为 0.95%,蛋白质含量为 0.71%,多糖含量为83.09%。
3.2 对黄精多糖进行体外消化模拟实验,在胃部消化模拟阶段,PSP1相对分子量由24.19 ku降低为20.39 ku,还原糖含量从0.17 mg/mL增加至0.19 mg/mL;在肠道模拟消化阶段,PSP1相对分子量由 28.85 ku降低为24.35 ku,还原糖含量从0.17 mg/mL增加至0.19 mg/mL。差异具有显著性(p<0.05)。
3.3 在黄精多糖的体外酵解模拟实验中,通过对酵解物进行16S rDNA分析,发现Ⅱ型糖尿病小鼠的肠道菌群经过黄精多糖的酵解后,其肠道菌群的结构组成发生显著变化。从菌门水平上比较,其厚壁菌门的相对丰度显著降低,变形菌门和拟杆菌门的相对丰度显著上升。从菌属水平上比较,乳酸菌属的相对丰度显著降低,韦荣氏球菌属、埃希氏菌属和克雷伯氏菌属的相对丰度显著上升,两组菌属结构差异显著。
3.4 研究表明,黄精多糖是天然大分子多聚物,在消化过程中无法被完全消化吸收,主要通过被肠道末端的肠道菌群分解成小分子进而被吸收利用,同时黄精多糖还对肠道菌群结构起到一定调节作用。
