二甲双胍抗肿瘤机制研究进展
2021-09-02崔琳琳王洋关桦楠袁甜申光焕
崔琳琳,王洋,关桦楠,袁甜,申光焕
(1.哈尔滨商业大学药学院,黑龙江省预防与治疗老年病药物研究重点实验室,黑龙江哈尔滨 150076)(2.哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076)
二甲双胍(C4H11N5),见图1,是从豆科植物中提取的天然化合物,于1957年首次被报道为治疗糖尿病药物,至今已有60多年的历史[1]。目前,在临床上二甲双胍已被作为治疗2型糖尿病的一线药物。二甲双胍是一种亲水型化合物,在生理条件下以正电荷形式存在,需要有阳离子膜运转体来摄取细胞[2]。主要运载体溶质载体(SLC)家族,其中包括SLC22A1、SLC22A3、SLC22A4。近年来普遍认为二甲双胍降糖作用的主要靶点是线粒体[3],二甲双胍主要通过各种组织细胞内特异性抑制线粒体呼吸链酶复合体 I,从而抑制肝脏的糖异生,促进脂肪酸氧化,改善胰岛素敏感性,降低血糖水平,从分子水平发挥作用[4]。

图1 二甲双胍结构式Fig.1 The structure of metformin
二甲双胍除治疗2型糖尿病之外,其抗肿瘤作用也被广泛研究。关于二甲双胍有抗肿瘤作用,最先源于研究糖尿病和糖尿病治疗与癌症的关系的人口调查中,研究人员发现尽管患有糖尿病的癌症患者死亡率较高,但与其他药物治疗相比,使用二甲双胍更能降低其对癌症的负担[5]。同时也有研究通过对比二甲双胍与磺脲类或胰岛素治疗组发现,二甲双胍治疗组的2型糖尿病患者肿瘤相关发病率及病死率均显著低于其余两组。其中Bowker[6]等调查发现服用二甲双胍降糖患者的肿瘤相关死亡率明显低于使用磺脲类降糖药物或胰岛素的患者。Evans,Libby[7,8]等也发现,2型糖尿病患者服用二甲双胍治疗可降低其肿瘤发生风险。近期Cancer Cell刊登了一篇文章,研究人员发现在禁食状态下使用二甲双胍可以显著抑制肿瘤生长,并发现治疗肿瘤的新靶点,PP2A的抑制靶点[9]。近年来人们对二甲双胍类作用机制的研究屡有新的发现,本篇综述将根据前人报道进行归纳总结,更系统的对二甲双胍抗肿瘤作用产生的机制进行综述,为其日后应用于抗肿瘤治疗方面奠定良好的理论基础。
1 AMPK依赖的机制
AMPK即AMP依赖的蛋白激酶,由一个催化亚基(α)和两个调节亚基(β和γ)组成,是参与细胞代谢的能量传感器,也是脂糖代谢,细胞生长,自噬和凋亡等关键细胞过程的主要调节因子之一。AMPK广泛的代谢途径主要包括ATP的消耗途径、ATP的生成途径,以及参与细胞调控和线粒体生物生成过程[10]。关于AMPK的代谢途径还有许多问题需要我们解决。但目前据我们所知道,激活该途径主要有两种方式包括直接激活和间接激活。
1.1 激活AMPK依赖的直接途径
AMPK蛋白均以一种异源三聚体复合物的形式存在,其中α-亚基N-末端包含一个保守的Ser/Thr激酶区,包含一个保守的苏氨酸(Thr-172)位点,该位点的磷酸化是其激酶活性所必需的。AMPK主要被细胞内AMP水平的增加所激活,通过AMP与γ调节亚基结合,使AMP/ATP比例增大,从而导致构像改变,抑制α亚基上的Thr-172去磷酸化。肝激酶B1(LKB1,又称SKT11)是AMPK是的上游作用因子,LKB1能够直接激活AMPK并促进α亚单位的172位苏氨酸磷酸化,而后者正是Peutz-Jeghers癌症易感综合征中肿瘤抑制基因突变的蛋白产物[11],也间接证明了二甲双胍的抗癌作用。同时有研究发现此方式也是二甲双胍激活AMPK所必需的,研究显示哺乳动物细胞中缺乏LKB1基因时,二甲双胍不能激活AMPK,但ATM可以通过磷酸化使LKB1其活化,而活化的LKB1又可直接磷酸化AMPKα亚单位的172位苏氨酸而激活AMPK[12]。
1.2 激活AMPK依赖的间接途径
二甲双胍也可以通过磷酸化间接激活 AMPK,Ben等[13]在前列腺癌和卵巢癌细胞体外实验表明,LKB1-AMPK轴是二甲双胍诱导的组蛋白和非组蛋白乙酰化过程,通过AMPK磷酸化介导抑制乙酰化辅酶A羧化酶(ACC)。磷酸化是使ACC失活促进脂肪酸氧化机制之一。二甲双胍通过磷酸化间接激活AMPK,使ACC失活,抑制脂生成酶的表达。同时,有研究表明磷酸化可以抑制固醇调节元件结合蛋白 1(SREBP1)的表达,对细胞膜表面调节细胞死亡信号分子(fas)和核糖蛋白(S14)等酯酶也有下调的作用[14]。另外也有研究发现乙酰辅酶A羧化酶(ACC)为AMPK的下游信号因子,二甲双胍也可以通过激活AMPK来磷酸化ACC,引起细胞的细胞周期G1期阻滞,抑制细胞增殖[15]。
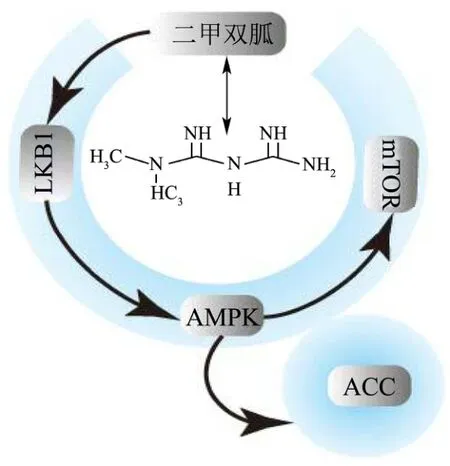
图2 AMPK依赖的机制Fig.2 Mechanism of AMPK dependence
mTOR(雷帕霉素靶蛋白)是一种丝氨酸/苏氨酸激酶,mTOR含有两种复合体,分别为mTORC1和mTORC2。相比较而言,mTORC1发挥着更为重要的作用,mTORC2构成的信号通路较为简单。mTOR信号在绝大多数肿瘤中被激活,而且活化的mTOR蛋白与肿瘤的恶性进程、不利预后以及化疗和靶向治疗耐药密切相关[16]。关于mTOR的信号通路,其主要包括PI3K/AKT/mTOR和LKB1/AMPK/mTOR两条关键通路,其中PI3K/AKT/mTOR信号通路,包含3个关键蛋白分子,即PI3K、AKT、mTOR,然而此信号通路在人类肿瘤细胞中往往是失控的,促使肿瘤细胞的快速生长和增殖。另一条通路即LKB1/AMPK/mTOR信号通路,LKB1能够通过磷酸化的方式激活AMPK,活化的 AMPK可以激活肿瘤抑制基因结节性硬化复合物2(TSC2),进而实现对mTOR的负性调控。二甲双胍可以激活AMPK,促使mTOR下游的分子磷酸化失活:翻译起始因子 4E结合蛋白(4E-binding proteins,4E-BPs)和核糖体S6激酶(ribosomal protein S6 kinases,S6Ks),抑制肿瘤细胞蛋白的合成[17]。同时也抑制了PI3K-PKB/AKT信号通路,从而抑制肿瘤细胞的生长和增殖[18]。二甲双胍对mTOR及其下游的靶点的抑制并非必须AMPK的参与。如Zhang等[19]发现,二甲双胍通过下mTOR/S6K1介导的c-FLIP,从而增强膀胱癌细胞对TRAIL诱导凋亡的敏感性,在此过程中mTOR和S6K1的表达降低,然而用AMPK抑制剂处理后并未影响二甲双胍对mTOR和S6K1。
2 AMPK非依赖的机制
2.1 抑制胰岛素受体/胰岛素样生长因子-1受体信号通路
胰岛素受体通常在正常脂肪、肌肉和肾组织中有较高表达[20]。然而近年在乳腺癌细胞[21]、前列腺癌细胞[22]中也发现了胰岛素受体的过表达,研究发现胰岛素通过与胰岛素受体结合后产生的抗凋亡和促有丝分裂效应,促进肿瘤生长,其主要通过生长因子受体结合蛋白 2传递信号到 Ras/Raf/ERK 形成IR/GRB2/Ras/Raf/ERK通路,促进有丝分裂和生长刺激的作用,导致肿瘤细胞有丝分裂的作用增强[23]。
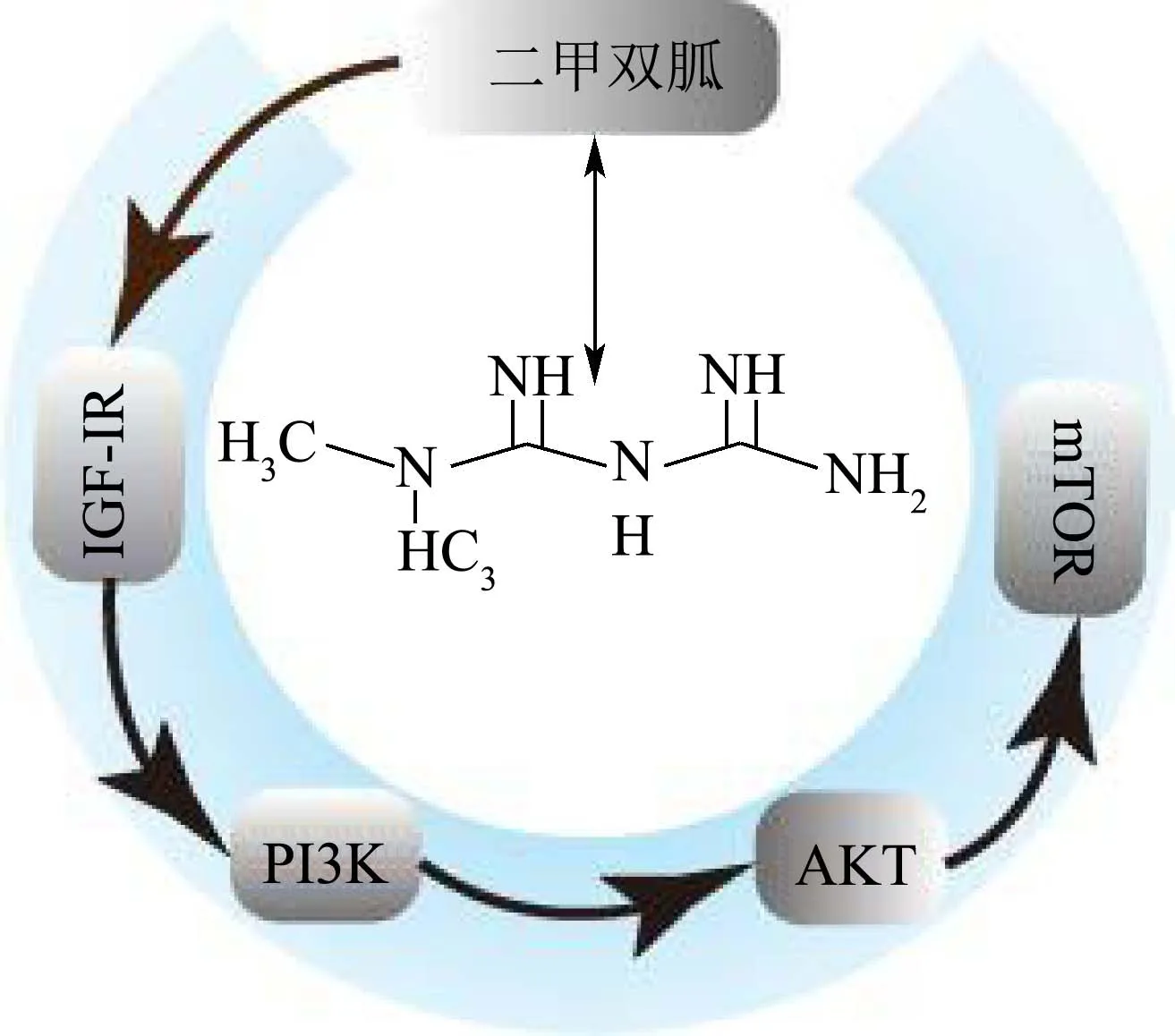
图3 抑制胰岛素受体/胰岛素样生长因子-1受体信号通路Fig.3 Inhibition of insulin receptor/ insulin-like growth factor-1 receptor signaling pathway
作为一种在质膜中的受体,酪氨酸激酶胰岛素样生长因子-1受体(IGF-IR),它可以介导IGF-1参与促进蛋白质激素增殖和细胞凋亡等。目前,IGF-IR受体受到广泛关注,有研究证明IGF-IR介导的信号转导通路可以促有丝分裂活性,防止细胞凋亡,使正常细胞向恶性细胞转化。同时也发现IGF-IR表达持续增高是乳腺癌、胰腺癌、结肠癌、肺癌发生的危险因子[24]。IGF-1可与IGF-1R结合后,激活磷脂酰肌醇3-激酶(PI3Ks),紧接着 PI3K激活 AKT,形成IGF-1/PI3K/AKT通路,促进细胞生长。二甲双胍主要通过对葡萄糖代谢内环境的平衡作用逆转2型糖尿病和非糖尿病患者的高胰岛素血症,然而二甲双胍抗增殖作用的发挥可能正是通过此机制。有研究显示,二甲双胍具有粘合和下调胰岛素受体、下调胰岛素和IGF-1受体的量,从而作用于肿瘤细胞发挥抗肿瘤作用[25]。二甲双胍也能够通过降低胰岛素和胰岛素结合蛋白间接抑制IGF-1,从而有效的干扰IGF信号通路作用的发挥,尤其是在肿瘤细胞中,二甲双胍能够有效的通过调控该通路抑制肿瘤细胞的生长[26]。Memmott等[27]研究发现二甲双胍可通过该通路间接降低雷帕霉素靶蛋白导致肿瘤细胞生长受到抑制,这主要与其下调IGF-1受体/胰岛素受体/Akt通路有关。
2.2 Micro RNAs
Micro RNAs(miRNAs)作为内源性基因编码的非编码RNA分子,其长度约为22个核苷酸。近年来,二甲双胍通过调节Micro RNAs(miRNAs)而抑制肿瘤的生长得到了广泛的关注。有研究发现,对不同类型癌症的miRNAs,二甲双胍对其有不同的影响。例如,在乳腺癌症中,二甲双胍可以通过诱导miRNA-193家族成员上调,从而杀死三阴性乳腺癌细胞[28]。同时也有研究发现,二甲双胍在肾细胞癌中可以通过miRNA-193的介导PTEN表达抑制细胞生长[29]。此外,有研究发现二甲双胍可以通过多个细胞通路,尽而激活AMPK[30],我们可以猜测AMPK也可能作用于小鼠miRNAs的上游。同时miRNAs作为T细胞分化和功能的调控因子,在肿瘤生长增殖中具有关键作用。有研究表明二甲双胍具有增强 CD8+T细胞的抗肿瘤能力[31]。
2.3 免疫作用
在免疫作用中二甲双胍主要可以通过对先天免疫系统和适应性免疫系统两方面产生影响。
2.3.1 先天免疫系统
先天免疫系统是我们防御系统产生信号的第一道免疫防线,这些信号主要由数量有限生殖细胞编码的模式识别受体PRRSl来识别。二甲双胍在各种细胞群中主要通过影响中性粒细胞,巨噬细胞和髓源性抑制细胞来抑制肿瘤增殖。有研究表明二甲双胍可以诱导细胞M2向M1分化,并抑制巨噬细胞M2极化[32],这也证实了细胞可能从免疫抑制型向免疫刺激型转变的猜想。同时有实验报告还显示,促肿瘤细胞的炎症因子水平也明显降低[33]。
2.3.2 适应性免疫系统
适应性免疫系作为抵御病原体的第二道防线,其主要是对个体抗原进行特异性识别。二甲双胍在第二道防线中主要影响的是T细胞,抗原可以通过识别导致T细胞分化为效应T细胞,其中包括T辅助细胞和细胞毒性T细胞[34]。此外抗原也可以激活记忆T细胞,在再次遇到特定抗原时会加强次级免疫反应。另外T细胞还能激活发挥免疫抑制功能的调节性T细胞。
2.4 抗血管生成
血管生成介导心血管的生成是肿瘤形成的标志,血管生成抑制剂在肿瘤治疗中已成为一种干预手段。因此抗肿瘤药物(AADs)也得到广泛的发展,也成为一种主要的抗癌药物。AADs主要的抗癌机制有两种说法,一种通过抑制肿瘤血管生成阻断血液供应从而杀死癌细胞。另一种说法则是使“血管正常化”,AADs不仅可以抑制肿瘤生长和转移,还可以提高肿瘤血管的成熟度和功能,提高化疗的增敏性,改善肿瘤缺氧[35]。同时,有众多研究表明二甲双胍具有抗肿瘤血管生成的作用。从众多文献中我们发现二甲双胍对两种机制似乎都有作用。在临床评估中,有研究者发现,在切除肝癌的糖尿病患者后,大部分患者血管内皮生长因子在肿瘤中的表达明显减弱,同时p-mTOR,CCND,核糖蛋白S6激酶(B1RPS6KB1)也有所下调[36]。除此之外有研究发现二甲酸双胍可以抑制转移性乳腺癌的进展,并通过血管机制诱导化疗增敏性。并发现二甲双胍可以减低肿瘤 PDGF-B,抑制过度血管生成,提高血管成熟度和功能[37]。
2.5 抑制上皮间质转化(EMT)作用
上皮间质转化(EMT)是一个高度保守的发育过程,上皮细胞在特定的生理和病理情况下可以向间质细胞进行转分化。上皮间质转化是促进肿瘤细胞进展中关键的过程,其可以调节癌细胞的侵袭、META转移和治疗耐药性。TGFβ信号通路是促进肿瘤发展的重要途径,具有调控细胞生长、分化、凋亡、血管生产和转移等多种功能,而且其在抑制上皮间质转化(EMT)中扮演重要角色。其中TGFβ信号通路可以抑制细胞凋亡,同时诱导两个EMT诱导基因Snail家族的主要成员,Snail1和Snail2的表达[38]。而二甲双胍可以抑制TGFβ1诱导Snail家族磷酸化,同时还抑制纤维连接蛋白,结缔组织生长因子和白细胞介素 6的表达。并且也有研究发现二甲双胍可以通过靶向信号传导和转移因子3以及转移因子β1/Smad信号通路抑制EMT,影响分子转录,抑制肿瘤细胞增殖[39]。
2.6 P53/Redd1通路
有研究表明二甲双胍在正常情况下比P53受损状态更能抑制癌细胞增殖。并且发现P53的状态可以影响二甲双胍的效率[40]。DNA损伤诱导转录子 4(Redd1)是P53的直接靶点,P53/Redd1可以不用通过AMPK机制,并且使mTORC1下调。正常情况下,P53的存在可以使二甲双胍上调Redd1m诱导TORC1的抑制机制和细胞周期阻滞,其表达主要与抑制mTOR有关。
2.7 诱导细胞自噬和凋亡
二甲双胍自噬在肿瘤生流生长过程中扮演重要角色,二甲双胍可以通过自噬调节炎症因子,改善细胞代谢状态,抑制肿瘤生长。有研究发现黑色素瘤在使用二甲双胍后,在电镜,荧光免疫,LC3蛋白比例观察中均出现自噬现象。但是二甲双胍的自噬作用,本身也会促使肿瘤细胞生长[41]。我们猜想这主要与细胞生存的微环境有关。同时二甲双胍可以上调细胞周期素依赖性抑制剂(P21),使细胞阻滞在G1期和G2/M期,促使细胞凋亡。有研究表明二甲双胍可以通过c-FLIP蛋白的降解和caspase-8的激活诱导细胞凋亡,caspase-8可以激活导致死亡诱导的信号复合物Diss,促进细胞凋亡[42]。同时也有研究表明在肺癌和膀胱癌中,二甲双胍能抑制c-FLIP蛋白的表达[43]。
2.8 氧化性
大部分人认为二甲双胍抗肿瘤和化疗增敏作用是通过AMPK和抑制ATK-mTOR通路来实现。然而我们认为这些还不能证明肿瘤化疗增敏作用,在不同细胞中,二甲双胍还可以引起氧化应激性,增加 ROS生成。一般来说,细胞氧化剂和氧化还原稳态受抗氧化系统调节,而Nrf2是调节抗氧化和代谢基因的关键转录因子。同时,也有研究发现,二甲双胍可以降低Nrf2mRNA的表达[44],因此我们可以猜测Nrf2mRNA的下调可以引起氧化生成增加,导致线粒体功能紊乱。并且也有研究发现二甲双胍在乳腺癌线粒体损伤时可以增加ROS形成[45]。
2.9 协同化疗药物治疗
化疗方案中加入二甲双胍主要用于提高药物的敏感性。一些体内体外实验已经探索了二甲双胍与各种抗癌药物的组合,优化和调整出更完善的方案。例如,在人为胃癌和食道癌细胞系和异种小鼠模型中,二甲双胍联合 2DG抑制能量通路,促使细胞死亡,ATP下调,使 AMPK激活时间延长。同时,二甲双胍与2DG联用,在抑制细胞增殖和诱导细胞脱离上比单一给药效果更强。在直肠癌中,奥沙力联合二甲双胍可以协同细胞毒性,限制存活调节因子高迁移率盒(HMGB1)的表达[46]。并且也有研究表明在胃癌中二甲双胍可以抑制HIF1α,通过HIF1α/PKM2信号通路诱导细胞凋亡,但其具体机制还有待研究[47]。同时也有研究表明在乳腺癌中,与二甲双胍联用可以增强其耐药应,例如二甲双胍与他莫昔芬联用可以克服抵抗,增强敏感性。二甲双胍联合多柔吡星,可以增强化疗敏感性,使肿瘤体积减少,延长生命时间[48]。此外,二甲双胍与紫杉醇联合应用还可以增强抗癌率,并且与其浓度成正比。综上我们可知由于二甲双胍良好的耐受性,将二甲双胍作为治疗佐剂与多种治疗方式结合,可以促进肿瘤治疗效果。但由于肿瘤细胞的代谢可塑性,靶向特定的代谢通路并不能有效地抑制肿瘤,不过近期有研究发现联合间歇性禁食和二甲双胍能够同时抑制肿瘤细胞的糖酵解和氧化磷酸化[49]。在这样的前提下不仅二甲双胍可以单独使用会产生治疗效果,而且其他治疗方法联合使用也具有潜在临床应用前景。
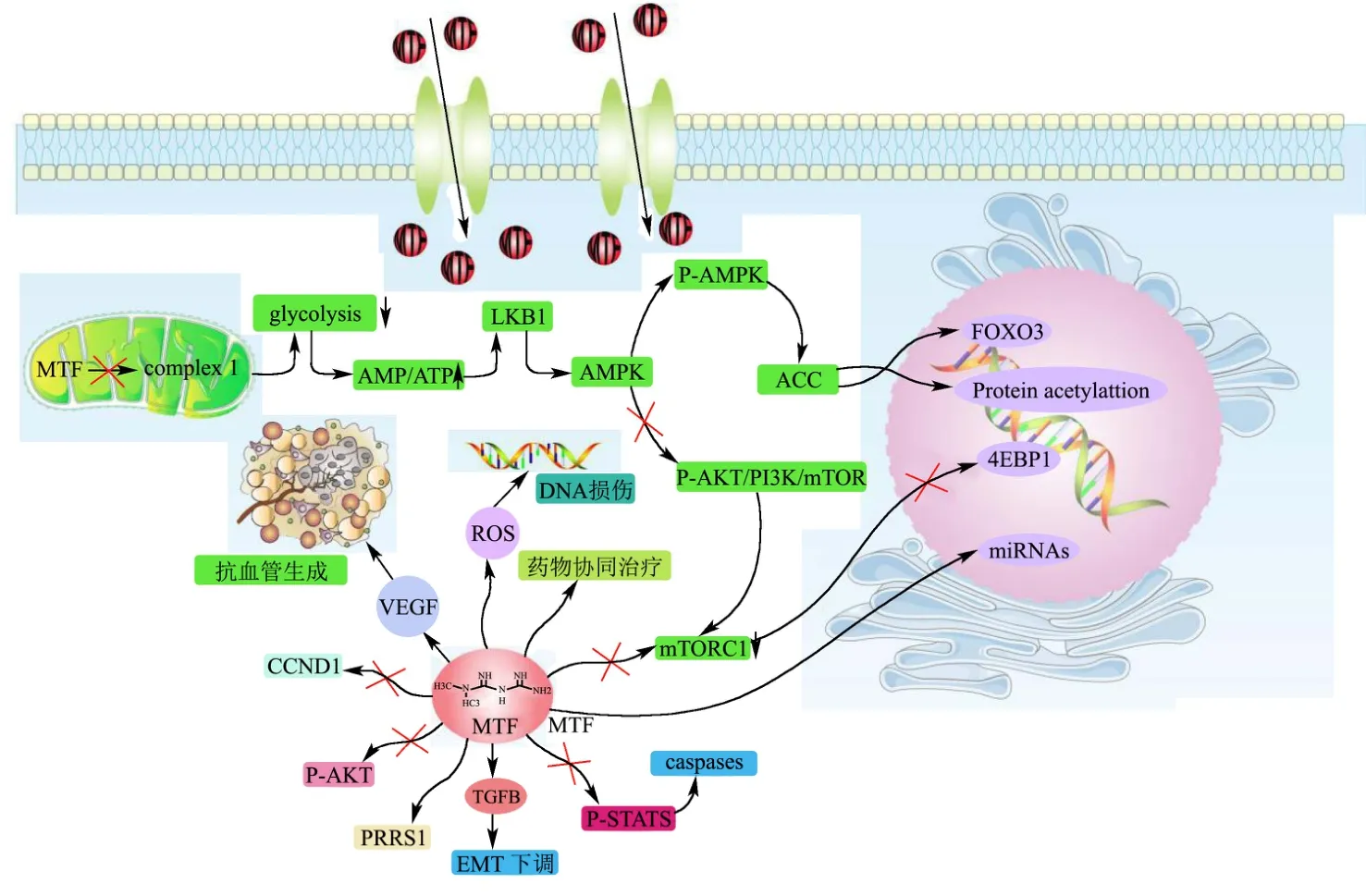
图4 二甲双胍抗肿瘤机制总图Fig.4 Overview of anti-tumor mechanism of metformin
3 结语
虽然随着肿瘤研究的不断深入,二甲双胍除作为一线的降糖药物外,其抗肿瘤作用机制也得到了大量研究报道,但其也存在很多尚不明确的地方,临床上也未实际应用。不过二甲双胍作为一种新型的抗肿瘤药物,随着研究人员的不断深入探究,有很大的可能性可以应用于临床,为肿瘤的预防和治疗提供了新的方法。因此深入研究二甲双胍的抗肿瘤机制,揭示其作用特点,将为二甲双胍抗肿瘤的临床应用奠定理论基础。
