硫唑嘌呤致骨髓抑制的克罗恩病患者的药学监护*
2021-08-25李卉张宏亮黄振光
李卉,张宏亮,黄振光
(广西医科大学第一附属医院药学部,南宁 530021)
克罗恩病(Crohn’s disease)是一种病因尚不十分清楚的胃肠道慢性炎性肉芽肿性疾病,在欧美多见,近年来,在我国的发病率明显增高。硫嘌呤类免疫抑制药在中、重度克罗恩病治疗中占有重要地位。目前,由于硫唑嘌呤(azathioprine,AZA)给药后个体差异较大,国内对于AZA应用于克罗恩病的给药剂量尚无指南、共识,部分患者在服药期间会发生严重的不良反应,如骨髓抑制等,对于这类患者用药方案的制定及不良反应发生后的治疗方案调整及药学监护值得关注。本文通过对临床药师参与1例糖皮质激素治疗无效合并AZA致骨髓抑制的克罗恩病患者用药方案的制定、调整和药学监护进行分析,为类似病例的治疗提供参考。
1 病例资料
患者,女,25岁,身高163 cm,体质量56 kg。患者2018年2月无明显诱因出现黏液稀便,伴白色黏膜状物,无便血,每日最多6次,伴发热及腹痛,体温约38 ℃,便后腹痛可缓解,伴乏力、消瘦、腹胀、食欲减退、纳差及双侧膝盖疼痛,无里急后重,无胸闷、气短等症状,至我院就诊,行结肠镜检查提示“克罗恩病”,予美沙拉嗪片1 g,qid, po,治疗10 d效果不佳,调整治疗方案为泼尼松片30 mg,qd,po治疗,症状缓解后每周减量5 mg至每日服用10 mg时停药,糖皮质激素治疗时间共1个月。停药后患者自行口服家中“土方子”(具体药物不详)2个月,自诉效果尚可,停药后又出现上述症状,腹泻每日3次,为黏液便,色黄,无血,至外院就诊,行全腹部CT平扫提示“部分小肠及大部分结肠壁异常增厚,符合克罗恩病表现”,予静脉输注注射用甲泼尼龙40 mg,qd,静脉滴注及灌肠后症状稍有缓解,注射用甲泼尼龙使用15 d后改泼尼松片40 mg,qd, po,之后间断服用泼尼松片3个月余,用药剂量根据症状自行加减,期间症状有反复。2018年9月,患者因腹痛症状加重,排便后不能缓解,入我院治疗。体检:体温36.0 ℃,脉搏80次·min-1,呼吸20次·min-1,血压120/80 mmHg(1 mmHg=0.133 kPa)。辅助检查:2018年9月6日腹部立位X线片:考虑低位小肠不完全梗阻;2018年9月9日小肠CT提示远段回肠及大部分结肠改变,符合克罗恩病表现。入院诊断:克罗恩病(狭窄型, 中度活动期,回结肠型)。
2 治疗经过
患者入院后解黏液便,每天3次,发热,2018年9月10日体温39 ℃,复查血常规白细胞(WBC) 7.02×109·L-1,中性粒细胞百分比71.5%,血培养结果阴性,胸部CT未见异常,予泼尼松片40 mg, qd,po,联合美沙拉嗪缓释片1 g, tid, po,治疗20 d,患者仍有发热,体温波动在37.0~38.6 ℃,诉腹痛,解黏液便每天1或2次。期间复查WBC 6.81×109·L-1,中性粒细胞百分比75.7%,予调整治疗方案为注射用甲泼尼龙40 mg, qd, 静脉滴注,联合美沙拉嗪缓释片1 g,qid,po,治疗7 d,患者无发热,大便及腹痛情况较前好转,诉偶有腹痛,稀烂便,每天1或2次,调整糖皮质激素治疗方案为泼尼松片40 mg, qd, po,每周减量5 mg;患者泼尼松片减量至25 mg·d-1时,诉腹痛症状较前加重,解黏液便,每天2或3次,此时克罗恩病疾病活动指数(Crohn's disease activity index,CDAI)评分385分,评估克罗恩病为中度活动期;临床药师与医师、患者进行沟通后,建议调整治疗方案为英夫利昔单抗(infliximab,IFX),期间糖皮质激素逐渐减量至停药后,再予联合AZA进行治疗,AZA用药前需检测TPMT基因多态性、NUDT15 基因多态性。医师同意并采纳药师建议。2018年10月31日开始调整治疗方案为IFX 300 mg,静脉滴注,后于11月14日、12月15日及2019年2月9日再次接受IFX 300 mg,静脉滴注,期间糖皮质激素逐渐减量,第4次IFX治疗后,TPMT基因检测结果:c.238G>C(p.Ala80Pro)基因型为G/G野生型,c.460G>A(p.Ala154Thr)基因型为G/G野生型,c.719A>G(p.Tyr240Cys)基因型为A/A野生型,未检测到相关变异,相比于其他基因型,有较低的毒副反应风险;NUDT15 基因检测结果:c.50_55dupGAGTCG(p.Val18_Val19insGlyVal)位点未发生变异、c.52G>A(p.Val18Ile)基因型为G/G、c.415C>T(p.Arg139Cys)基因型为C/C、c.416G>A(p.Arg139His)基因型为位点G/G,均为野生型,相比于其他基因型,有较低的毒副反应风险。此时患者泼尼松片已减量至停药,予调整药物治疗方案为IFX300 mg,静脉滴注,联合硫唑嘌呤片100 mg, qd,po,并带药出院,嘱患者于8周后来我院行第5次IFX治疗,出院后定期门诊监测血常规及肝功能。患者采用联合方案治疗1.5个月后,监测血常规发现白细胞计数、血小板计数、中性粒细胞百分比进行性降低,自行停用硫唑嘌呤后再次入院接受治疗。患者血常规监测结果见表1。
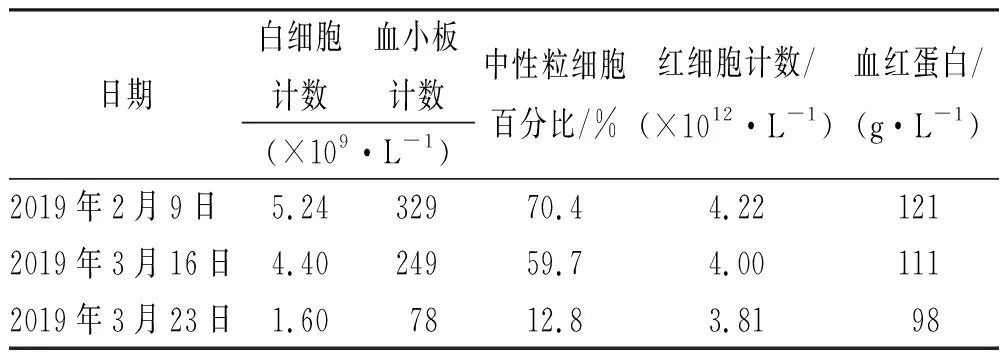
表1 患者血常规监测结果
患者入院后,CDAI评分230分,评估克罗恩病仍为临床活动期,经与医师、患者进行沟通后,临床药师分析认为导致患者“三系”下降的原因可能为AZA给药剂量过大引起的骨髓抑制不良反应,建议升白细胞、升血小板等对症支持治疗,待血常规恢复正常后可予IFX联合较小剂量AZA继续治疗,用药期间监测血常规、肝功能、6-巯基嘌呤核苷酸(6-thioguanine nucleotides,6-TGN)药物浓度调整给药剂量。经利可君片20 mg, tid,po;鲨肝醇片60 mg, tid, po;重组人粒细胞刺激因子注射液300 μg, qd, ih等治疗6 d后,患者WBC、中性粒细胞百分比逐步升高,2019年4月27日予第5次IFX300 mg,静脉滴注,并调整AZA给药剂量为50 mg,qd,po。调整治疗方案后,患者病情稳定,无发热、腹痛等症状,解黏液便每天1或2次,期间复查血常规均无异常,监测6-TGN药物浓度为205.67 pmol·(8×108红细胞)-1,临床药师认为AZA可按当前给药剂量继续用药,并于6月26日、9月2日行第5次、第6次IFX300 mg,静脉滴注治疗,第6次IFX治疗后CDAI评分120分,克罗恩病转为临床缓解期,病情控制较好。停用AZA后患者血常规监测结果见表2。给予小剂量AZA后患者血常规监测结果见表3。

表2 停用AZA后患者血常规监测结果

表3 给予小剂量AZA后患者血常规监测结果
3 不良反应发生的原因和调整用药方案的依据
3.1第1次用药方案调整 患者2018年先后2次糖皮质激素诱导缓解停药后复发,本次入院再次予糖皮质激素治疗,疾病仍处于中度活动期,无法诱导缓解。根据《炎症性肠病诊断与治疗的共识意见(2018年,北京)》[1],对于接受糖皮质激素治疗而复发频繁的患者(一般指每年复发≥2次),应考虑更积极的治疗,主要包括糖皮质激素联合免疫抑制药或可直接给予抗肿瘤坏死因子α(TNF-α)单克隆抗体(单独应用或与AZA联用);2018年《JSGE循证临床实践指南:炎症性肠病》[2]和2018年《ACG临床指南:成人克罗恩病的管理》[3]均提到,对于糖皮质激素抵抗或无效的患者,应给予抗 TNF-α单克隆抗体进行治疗;多篇国际、国内指南和共识[3-6]均提到,抗 TNF-α单克隆抗体联合AZA的治疗方案较两者任一单药治疗效果更佳,尤其是应用IFX治疗早期(前6个月)联合使用AZA可降低其免疫原性,提高临床缓解率和黏膜愈合率。对于在使用IFX前正在接受糖皮质激素治疗者,开始IFX治疗时应继续原糖皮质激素治疗方案,并且糖皮质激素应逐渐减量至停药[1,7]。综合上述文献资料,对于本患者,药师建议可采用先予IFX联合糖皮质激素进行治疗至糖皮质激素停药,之后再予联合AZA的方案进行治疗。IFX 用法用量为5 mg·kg-1,静脉滴注,在第 0,2,6 周给药作为诱导缓解,随后每隔8周给予相同剂量长程治疗[1];目前国内对于AZA的给药剂量尚无共识,且个体差异较大,临床上比较常用的剂量调整方案是按照当地的推荐,一开始即给予目标剂量,用药过程中进行剂量调整。欧洲和我国共识意见推荐的目标日剂量为1.5~2.5 mg·kg-1[8-9],本患者身高163 cm,体质量56 kg,体质量指数21.08 kg·(m2)-1,可予100 mg, qd,po(1.79 mg·kg-1·d-1)治疗。
3.2第2次用药方案调整
3.2.1导致骨髓抑制不良反应发生的原因 患者2019年2月9日行第4次IFX治疗后,除联用AZA外未使用其他药物,2019年3月16日监测血常规发现“三系”进行性减少,在此期间否认其他放射性、化学性有毒、有害物质接触史。目前,笔者暂未见IFX骨髓抑制相关不良反应的报道;而骨髓抑制是AZA最严重的不良反应之一,我国炎症性肠病患者巯嘌呤类药物骨髓抑制的发生率为15%~20%[8,10],AZA不良反应以服药3个月内常见,尤以1个月内最常见[1];患者骨髓抑制在服用AZA1.5个月以内,有时间相关性,考虑 AZA引起骨髓抑制可能性较大。因患者用药前已检测过常见的TPMT基因型和NUDT15 基因型均无异常,已知常见的基因型引起该药不良反应的可能性可排除;但是,由于一些新的可能导致骨髓抑制的基因突变位点如TPMT 26(208F-L)[11]等未列入常规检测范围,同时可能还存在一些突变的基因位点尚未发现,因此,不能排除这些因素导致患者发生骨髓抑制的不良反应。另外,AZA不良反应的发生呈剂量相关性,且通常可逆;给药方案有两种,一种是开始用药即给予目标剂量,用药中进行剂量调整;另一种是从小剂量开始,逐步增量至有效或外周血白细胞下降至临界值或达到目标剂量[1]。第一种方案发生剂量相关不良反应风险较大,第二种方案判断疗效所需时间较长,但可减少剂量依赖不良反应的发生风险。本患者AZA初始给药方案虽然参考文献推荐给予目标剂量1.79 mg·kg-1·d-1,但开始即给予目标剂量,临床药师认为初始给药剂量过大导致骨髓抑制不良反应可能性较大。
3.2.2用药方案调整 AZA用药12~16周后才达到最大疗效[12],现患者用药6周,疾病仍处于活动期,并且考虑AZA给药剂量过高引起骨髓抑制不良反应,根据《西班牙克罗恩病和溃疡性结肠炎工作组对于硫嘌呤类药物在炎症性肠病中应用的推荐》[9]建议发生中度中性粒细胞减少症应停止硫嘌呤治疗,一旦中性粒细胞计数恢复正常,可以尝试通过使用小剂量AZA(初始剂量的50%)提高治疗耐受性,如果再次出现中性粒细胞减少,则该药物应该永久停用;我国专家共识[1,8]建议可通过监测外周血白细胞计数和6-TGN药物浓度调整AZA用药剂量;6-TGN浓度在230~450 pmol·(8×108红细胞)-1间疗效佳,不良反应发生少,是有效的治疗窗浓度[8];对于AZA联合IFX的患者,6-TGN的浓度阈值是否同样适用还有待研究;ROBLIN等[13]认为 在AZA联合IFX治疗下,减少AZA剂量与继续给予全剂量AZA一样有效;对于仅耐受较小剂量AZA的患者,当与IFX联用时,6-TGN目标浓度≥120 pmol·(8×108红细胞)-1即可获得满意的疗效[14-15]。 综合上述文献资料,临床药师建议,患者对症治疗后,待血常规恢复正常,可调整AZA用药剂量为初始剂量的50%(即50 mg·d-1);监测6-TGN药物浓度高于文献推荐的有效治疗浓度,且血常规正常,患者病情无加重,故药师认为AZA用药剂量不需进一步调整。
4 临床药师对本患者的药学监护要点
4.1加强用药前筛查 IFX给药前需注意排除以下禁忌证,包括过敏、合并感染、中重度心力衰竭、神经系统脱髓鞘病变、近3个月内接受过活疫苗接种等。用药前需完善活动性感染的筛查如结核分枝杆菌和慢性乙型肝炎病毒的感染[8]。TPMT基因型对于预测AZA骨髓抑制的特异性高,但存在对汉族人灵敏性低的缺点;有研究认为NUDT15基因型对预测包括我国在内的亚洲人群发生骨髓抑制的灵敏性和特异性均较高[8,14]。因此,临床药师建议本患者应用AZA前需对常见的TPMT基因型、NUDT15基因型进行检测,若检测出基因突变应避免使用AZA或在严密监测下减量使用。本患者用药前接受上述筛查均无异常,无用药禁忌。
4.2药物治疗效果的评估 患者药物治疗期间,临床药师通过观察、记录患者体温、腹痛程度、大便次数等临床症状和炎症指标的改善情况来评估患者用药疗效;发生骨髓抑制不良反应后,建议临床医师通过监测6-TGN的药物浓度来降低患者不良反应发生风险和评估AZA用药疗效;本患者减少AZA用药剂量后监测6-TGN药物浓度高于文献推荐有效治疗浓度,且体温、腹痛程度、大便次数等临床症状并未较前加重,监测血常规等指标未见异常,故无需进一步调整AZA用药剂量。
4.3对药物不良反应的监护 IFX可能导致的不良反应包括药物输注反应、迟发型变态反应、药物性红斑狼疮、机会性感染、恶性肿瘤、皮肤反应、神经系统受损等,用药后需严密观察及监测,本患者治疗过程中未发现上述不良反应相关症状。免疫抑制药不良反应发生率>20%,普通的不良反应包括发热、关节痛、皮疹,常常发生在服药后2~3周;AZA的不良反应还包括骨髓抑制、肝功能损伤、肌萎缩等,其中白细胞减少症的发生往往较为突然,且毫无预兆。因此,临床药师建议患者用药后最初1个月内每周复查1次血常规,第2~3个月内每2周复查1次,之后每月复查,半年后复查间隔时间可视情况适当延长,但不能停止;另外,用药后最初3个月需每月复查肝功能。本患者用药后通过对血常规的积极监测,较早发现骨髓抑制不良反应的发生,及时给予了相应的处理措施、调整了药物治疗方案。
5 结束语
克罗恩病具有病程长、病情易反复的特点。近年来,对于糖皮质激素治疗无效的克罗恩病患者,免疫抑制药及生物制剂越来越多地应用于该病的治疗;由于该病药物治疗周期较长,且患者对药物治疗效果及不良反应的发生存在较大的个体差异,因此,临床药师为患者提供安全、有效、合理的个体化药学监护具有重要的意义。为降低用药风险,临床药师通过基因检测的方法对患者应用AZA可能导致骨髓抑制的常见基因型进行了排查,尽管如此,本患者仍然发生了骨髓抑制不良反应,临床药师应用血药浓度监测技术对患者AZA用药剂量和疗效进行了调整和评估,确保了患者用药安全、有效。本病例同时也提示,对于应用AZA的克罗恩病患者,尽管常见基因型检测无异常,也不能完全排除不良反应发生的可能性,临床药师应重视并加强对此类患者的药学监护,以保障患者安全用药。
