脂多糖对U251细胞内芳烃受体和核受体NR4A1表达的抑制作用及其机制*
2021-08-25余绪明余世荣石金敏龚杰王佳
余绪明,余世荣,石金敏,龚杰,王佳
[十堰市人民医院(湖北医药学院附属人民医院)药学部,十堰 442000]
核受体NR4A1 ( nuclear receptor subfamily 4 group A member 1,也称为Nur77)是孤儿核NR4A亚家族重要成员之一,可被多种复杂的细胞信号所诱导,作为分子开关在基因的表达调控中发挥重要作用,主要参与代谢、免疫调控、细胞应激、记忆、胰岛素敏感性和心脏稳态的调控等。NR4A1主要在脑组织中表达[1]。NR4A1与炎症的关系紧密。DIATCHENKO等[2]报道,NR4A1是单核细胞内核因子-κB(nuclear factor kappa-B,NF-κB)信号通路中最强的抑制基因之一。LI等[3]研究揭示Nur77是NF-κB介导的炎症反应中的重要制动因素。Nur77敲除的小鼠对细菌脂多糖易感,且Nur77可通过阻断p65与其κB元件的结合从而抑制NF-κB的活性,进而抑制促炎细胞因子的产生。研究表明,激活的小胶质细胞内Toll样受体4(Toll-like receptor 4,TLR4)信号通路介导了脂多糖抑制Nur77的表达,特殊的TLR4拮抗剂CLI-095可以抑制BV2细胞内Nur77的下调作用[4]。然而,脂多糖诱导的TLR4信号通路中Nur77下调的具体分子机制仍未阐明。
芳烃受体(aryl hydrocarbon receptor,AhR)属于螺旋-环-螺旋/Per-Arnt-Sim同源超家族(basic helix-loop-helix/Per-Arnt-Sim homology superfamily)成员之一,是一种在脊椎动物细胞中广泛表达的配体依赖性转录因子[5]。其激活后,AhR与芳烃受体核转位蛋白(aryl hydrocarbon receptor nuclear translocator,ARNT)一起进入细胞核参与其靶基因表达的调控。AhR的生物学功能包括化学和微生物防御,器官发育,免疫和炎症的调节,繁殖和NAD+依赖的能量代谢等[6]。WANG等[7]和ZHOU[8]报道了配体依赖的AhR的激活抑制了肠道炎症反应。AhR -配体轴在各种类型的炎症反应[9]和骨稳态[10]中发挥关键作用。目前研究聚焦在寻找人源AhR的靶基因以及与之串联的转录因子[6]。NR4A1是否是AhR的下游靶基因,二者之间是否存在串联以及是否参与了脂多糖诱导的TLR4信号通路中Nur77的下调过程,笔者尚未检索到国内外相关报道。
本研究对体外神经胶质瘤细胞系U251细胞给予外源性脂多糖,构建炎症细胞模型,探究AhR是否参与了脂多糖诱导的TLR4信号通路中Nur77的下调过程,及其可能的分子机制。
1 材料与方法
1.1材料 胎牛血清(fetal bovine serum,FBS,杭州四季青生物公司,批号:2104);达尔伯克高糖培养基(Dulbecco's minimum essential medium,DMEM)(Thermofisher公司,美国,批号: 10569044);青链霉素溶液(Thermofisher公司,美国,批号: 15140122);opti-MEM培养基(Gibco公司,美国,批号:31985-070);脂质体 (Invitrogen公司,美国,批号:11668-027);裂解液(Invitrogen公司,美国,批号:15596018);脂多糖 (Invitrogen公司,美国,批号: 00-4976-93);TLR4抑制剂CLI-095(InvivoGen公司,美国,批号:tlrl-cli95);髓样分化因子抑制剂ST 2825(Medchem Express,公司,美国,批号:HY-50937);DH5α感受态(Tianfen公司,批号:CB101);酵母提取物(Invitrogen公司,美国,批号: 18180059);蛋白胨(Invitrogen公司,美国,批号:LP0043B);氨苄西林钠(Amresco公司,批号:0339);T4DNA连接酶( Invitrogen公司,美国,批号: IVGN2104)、快速限制性内切酶XhoI( Thermo Scientific公司,美国,批号:FD0694)和快速限制性内切酶HindIII( Thermo Scientific公司,美国,批号:FD0504);空载pDONR223质粒(湖南优宝生物公司提供),人源AhR(湖南优宝生物公司,批号: G119772)和人源ANRT(湖南优宝生物公司,批号:G116155)cDNA克隆质粒;pGL4.11[luc2P]质粒(湖南优宝生物公司,批号: VT1728 );DNA 梯度条带( 碧云天生物公司,批号:D0107);琼脂糖(Sigma公司,美国,批号:A9539);染料法荧光定量试剂盒(TAKARA,批号:DRR041A);高保真预混液(I-5TM2X High Fidelity Master Mix)(Molecular Cloning Laboratones,批号:I5HM-200);cDNA合成预混液( Biotool公司,美国,批号:B24403);双荧光素酶分析试剂盒(Promega公司,美国,批号:E1910,Lot.220597);GoldViewⅡ型核酸染色剂(5000×)(Solarbio,批号: G8142 );胶回收试剂盒( BiomiGA,批号:122131-2);AxyPrep质粒DNA小剂量试剂盒(AxyGEN,批号: AP-MN-P-4);染色质免疫共沉淀试剂盒(Epigentek公司,美国,批号: P-2002-2);ChIP级单克隆小鼠抗人AhR抗体 (RPT9,Invitrogen公司,美国,批号: MA1-513); 人胶质瘤细胞系U251细胞和人肾上皮细胞系293T细胞(武汉大学基础医学院乐江教授实验室)。
1.2方法
1.2.1细胞培养 U251和293T细胞置于DMEM(含10% FBS,1% 双抗)的培养基中,培养条件为37 ℃、5%二氧化碳( CO2)培养箱恒温培养。6孔板内细胞密度约为70%时,将完全培养基弃去,PBS冲洗1或2次,更换无血清培养基根据具体实验目的加药处理,继续培养至24 h。
1.2.2TLR4 -MyD88抑制性实验 采用二甲亚砜(DMSO)分别将CLI-095、ST 2825和脂多糖稀释成1,20 μmol·L-1和1,0.1 μg·mL-1。U251细胞于6孔板中培养,分别给予不同剂量脂多糖(1,0.1 μg ·mL-1)处理24 h。U251细胞给药分组:对照组(DMSO)、脂多糖组、CLI-095组、CLI-095+脂多糖组、ST 2825组、ST 2825+脂多糖组。其中CLI-095+脂多糖组和ST 2825+脂多糖组中,CLI-095和ST 2825先分别预处理1 h后添加脂多糖(1 μg·mL-1),连续培养至24 h,每组设3个复孔[11]。
1.2.3实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测 采用Trizol抽提U251细胞总RNA,Nano drop测定其浓度。加入All-in-one cDNA Synthesis SuperMix按如下条件进行RT-PCR扩增得到cDNA样本,25 ℃,10 min;42 ℃,30 min;85 ℃,5 min。扩增基因,人源NR4A1上游引物GGCTCGGG-GATACTGGATACA,下游引物CTGGCATGAAGCGT-TGTCC;人源AHR上游CAAATCCTTCCAAGCGGCATA,下游引物CGCTGAGCCTAAGAACTGAAAG;人源ARNT上游CTGCCAACCCCGAAATGACAT,下游引物CGCCGC-TTAATAGCCCTCTG;人源GAPDH上游引物CATCACCATCTTCCAGGAGCGAGA,下游引物TGCAGG-AGGCATTGCTGATGATCT;扩增体系为:样本cDNA 2 μL,荧光染料混合液(SYBR mix)5 μL,正向引物0.3 μL,反向引物0.3 μL,焦碳酸二乙酯处理的超纯水2.4 μL;反应条件为95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,40个循环。
1.2.4质粒构建 ENSEMBL(http://asia.ensembl.org/index.html)网站上寻找人源NR4A1启动子片段(距离ATG为0~-2000 bp,NR4A1-003 ENST00000545748.5)。根据生物信息学方法以及网站(http://tfbind.hgc.jp)预测NR4A1启动子上AhR/ARNT的结合位点。依据评分,最大分值并包含AhR / ARNT位点的片段序列547 bp(距离ATG为-1606 ~-1590 bp)插入到pGL4.11[luc2P]载体中,构建NR4A1启动子片段的Luc-报告质粒(NR4A1 -pGL4.11[luc2P])。构建的上游引物: CCGCTCGAGTTATGTAACCGGGTGTGCCGG(限制性内切酶为XhoI);下游引物:CCCAAGCTTAAAGGCATCC-ACCGAAGAGGG(限制性内切酶为HindIII)。
1.2.5瞬时共转染实验 U251细胞于6孔板中培养,实验分组:空载组和AhR/ANRT表达组。采用Lipofectamine 2000转染试剂盒进行操作,转染体系为质粒DNA浓度1 μg : 脂质体2000 3 μL,分别用 opti-MEI 250 μL优化培养稀释并配置成混合液,室温孵育放置10~20 min,加入无血清培养基的6孔板中继续培养24 h。
1.2.6双荧光素酶报告(dual-luciferase reporter)分析实验 293T细胞培养于6孔板,实验分为对照组和转染组。对照组转染空载pDONR223质粒+NR4A1-pGL4.11[luc2P]报告质粒,转染组为AhR -pDONR223表达质粒+ARNT-pDONR223表达质粒+NR4A1-pGL4.11[luc2P]报告质粒。按照Lipofectamine2000转染试剂盒和双荧光素酶报告实验试剂盒说明操作,每组平行设3个复孔,ModulusTM单管型多功能检测仪测定荧光强度,计算相对荧光强度。
1.2.7染色质免疫共沉淀(chromatin immuno-precipitation,ChIP)分析 实验分组:对照组(DMSO)和脂多糖(1 μg·mL-1)组。按照染色质免疫共沉淀试剂盒提供的方法进行操作。调整每皿U251细胞密度为(2×106) ~( 2×107)个·mL-1,按上述分组分别处理,细胞计数,1%甲醛固定,室温孵育10 min。加入1.25 mol·L-1甘氨酸1 mL终止交联。超声破碎,将DNA打碎成500~1000 bp的片段。测定染色质浓度,将约10%的染色质预留作为裂解液处理。10 μg的ChIP级单克隆小鼠抗人AhR抗体和使用正常的小鼠IgG(ChIp试剂盒提供,Epigentek公司,美国)作为阴性对照。回收免疫沉淀的DNA,使用PCR纯化试剂盒纯化,使用qRT-PCR扩增裂解液样本中的DNA以及从沉淀复合物中分离得到的DNA。扩增产物在2%琼脂糖凝胶上分离,使用Auto Chemi成像系统对条带强度进行定量分析。
2 结果
2.1脂多糖对NR4A1和AhR表达的影响 U251细胞给予不同浓度脂多糖(1和0.1 μg·mL-1)处理24 h。与对照组比较,脂多糖剂量依赖性下调NR4A1和AhR的表达,脂多糖1 μg·mL-1组分别下调56%,32%;脂多糖0.1 μg·mL-1组分别下调38%,19%,见表1。

表1 脂多糖对U251细胞中NR4A1和AhR表达水平的影响
2.2TLR4-MyD88通路介导脂多糖下调AhR和NR4A1的表达 U251细胞采用脂多糖(1 μg·mL-1)处理24 h后,qRT-PCR结果显示,与对照组比较,脂多糖显著下调了NR4A1和AhR mRNA水平,分别下降了53.78%(t=13.15,P<0.01 )和42.96%(t=8.062,P<0.01)。TLR4特殊的抑制剂CLI-095(1 μmol·L-1)和MyD88拮抗剂ST 2825(20 μmol·L-1)分别预处理1 h,接着给予脂多糖(1 μg·mL-1)处理至24 h。单用CLI-095组和单用ST 2825组与对照组比较差异无统计学意义,表明二者均不影响NR4A1和AhR mRNA的表达水平。与单用脂多糖组比较,CLI-095+脂多糖组和ST 2825+脂多糖组NR4A1和AhR mRNA水平的下调作用显著被逆转,且CLI-095的逆转作用更明显(t=7.467,P<0.01),ST 2825部分逆转了其表达的下调(t=5.485,P<0.05)。提示,在U251细胞内脂多糖下调AhR和NR4A1的表达可能通过TLR4 -MyD88通路实现,见图1。

A.对照组;B.脂多糖组;C.CLI-095组;D.CLI-095+脂多糖组;E.ST 2825组;F.ST 2825+脂多糖组。①与对照组比较,P<0.01;②与脂多糖组比较,P<0.01;③与对照组比较,P<0.05。
2.3NR4A1作为AhR的下游靶基因,其表达受到AhR的调控 U251细胞瞬时转染人源的AhR / ANRT表达质粒。qRT-PCR检测发现,与对照组比较,转染组AhR和ARNT表达分别上调了106.63倍和165.23倍,提示U251细胞成功转入AhR / ANRT表达质粒。qRT-PCR检测NR4A1的表达,与对照组比较,NR4A1 mRNA水平上调至2.63倍(t=7.384,P<0.01),提示AHR作为转录因子调控了下游靶基因NR4A1的表达。
2.4AhR结合到NR4A1启动子区域,在转录水平上调控其表达 将预测包含AhR/ARNT结合位点的NR4A1启动子片段(-1606~-1590 bp)构建入pGL4.11[luc2P]质粒中,经基因测序,成功构建NR4A1启动子的luc-报告质粒。293T细胞内瞬时共转染实验,与对照组比较,转染组荧光强度明显增加,上调至19.08倍(t=52.42,P<0.01),提示AhR与ARNT形成异源二聚体,并结合到NR4A1启动子区域,在转录水平上调控其表达。
2.5脂多糖抑制了AhR蛋白与NR4A1启动子位点的结合 ChIP分析结果显示,与对照组比较,脂多糖显著抑制了AhR蛋白与NR4A1启动子位点的结合,下调32.7%(t=5.621,P<0.05),见图2。
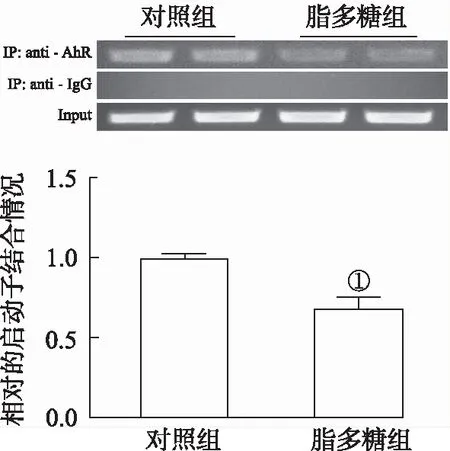
①与对照组比较,P<0.05。
3 讨论
本实验研究发现U251细胞内,脂多糖呈剂量依赖性下调NR4A1和AhR的表达。TLR4-MyD88信号通路介导了脂多糖抑制AhR和NR4A1的表达;此外,U251细胞高表达AhR和ARNT,同时NR4A1的表达明显上调,提示NR4A1是AhR的下游靶基因;荧光素酶分析结果提示,AhR和ARNT形成异源二聚体结合在NR4A1启动子结合位点,在转录水平上调控其表达。ChIP分析结果表明,在U251细胞内脂多糖抑制了AhR蛋白与NR4A1启动子位点的结合。由此推论,脂多糖通过U251细胞内的TLR4-MyD88信号通路抑制了AhR的表达,进而在转录水平上减少了AhR和ARNT异源二聚体在下游靶基因NR4A1启动子上的结合,从而抑制其表达。
近年来的诸多研究表明,神经炎症是神经退行性疾病发生的重要机制之一[12-20]。核受体作为神经退行性疾病治疗潜在的靶标,在过去的十多年里受到了极大的关注。大量的文献报道了小鼠神经退行性疾病模型以及一些临床试验证实了核受体在不同神经退行性疾病中发挥重要作用[21]。有关NR4A1与神经炎症以及帕金森病(Parkinson’s disease,PD)之间关系的报道也较多。在正常条件下,脑内的NR4A1主要在多巴胺能神经元的靶区内表达,如纹状体的复合区和前额叶皮质,然而在成年大鼠脑黑质以及腹侧被盖区域(ventral cover area,VTA)内NR4A1则呈现低水平表达[22]。ROTHE等[23]报道了NR4A1作为小胶质细胞活化的调制子,成为自身免疫性中枢神经系统炎症的潜在治疗靶标。MONTAROLO等[24]报道,与健康志愿者比较,PD患者外周血内整个NR4A亚家族基因(NR4A1、NR4A2和NR4A3)的表达呈现显著下调。此外,研究显示小胶质细胞内Nur77的活化衰减了促炎介质的产生以及保护了多巴胺能神经元免受炎症诱导的细胞损伤。体外脂多糖激活的小胶质细胞内以及1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)诱导的小鼠PD模型中Nur77的表达下调[4]。因此,可以大胆假设NR4A1作为炎症的一个负向调控子在神经炎症诱导的神经退行性疾病(如PD)中发挥关键保护作用,其可能是PD治疗新的潜在分子靶标。
本实验探讨了U251细胞内脂多糖抑制NR4A1表达的可能的分子机制,为进一步探究NR4A1的生物学功能,阐明其与炎症的关系,进而为炎症诱导的神经退行性疾病、肿瘤、代谢性疾病等病理过程的逆转提供参考,同时为寻找针对PD的靶标开发治疗药物提供实验依据。此外,实验还证实了NR4A1是AhR的下游靶基因,这对于遴选人源AhR的靶基因以及细胞内串联的转录因子至关重要。NR4A1是否像AhR紧密耦联的转录因子靶基因AHRR(aryl hydrocarbon receptor repressor)和核因子Nrf2(nuclear factor,erythroid 2 like 2,NFE2L2)一样发挥AhR依赖的生物学功能[25-28],仍需进一步探讨。然而,实验仅从mRNA水平上进行了考察,缺乏蛋白水平的证据。课题组将进一步在U251细胞内从蛋白水平探究这一论断,并且在U251细胞内敲高NR4A1,以便探究NR4A1的生物学功能,诸如是否抗炎、抗线粒体氧化应激和内质网应激,以及是否参与脂质代谢相关基因表达的调控等。同时,脂多糖诱导的在体PD模型中通过慢病毒包装NR4A1质粒,使其感染黑质-纹状体区域,并使NR4A1呈现高水平表达,以探究NR4A1的抗PD作用。
