乏氧条件下坎地沙坦增加肺腺癌A549细胞放射敏感性①
2021-08-23刘洪良周寒静隆姝孜
刘洪良 周寒静 周 丽 隆姝孜 万 林 廖 奎 张 涛
(重庆医科大学附属第一医院肿瘤科,重庆400016)
我国肺癌发病率和死亡率居世界首位,严重威胁人民的健康[1]。其中肺腺癌约占肺癌的40%,且绝大部分诊断时已为晚期[2-3]。放疗是恶性肿瘤常用的治疗方法,在晚期肺腺癌的治疗中占据重要地位[4-5]。临床中肺腺癌放化疗疗效较差,五年生存率仅为15%左右[1]。研究发现在肿瘤发生发展过程中,肿瘤微环境中广泛存在乏氧,而乏氧进一步介导的放射抗拒是导致肺腺癌放疗疗效差的重要原因之一[6]。乏氧条件下肿瘤细胞中普遍存在HIF-1α和AngⅡ表达上调,其中HIF-1α 表达上调与放射抗拒密切相关,且AngⅡ与HIF-1α 表达正相关,AngⅡ可上调 HIF-1α 表达[7-11]。因此,在增加肿瘤细胞放射敏感性和提高肿瘤的放疗疗效的研究中,可以重点研究寻找能减弱AngⅡ效应以下调乏氧条件下肿瘤细胞HIF-1α 表达水平的药物。坎地沙坦是一种临床中应用广泛且安全性良好的药物,其主要用于治疗高血压和心血管等疾病,它能特异性阻断AngⅡ与自身受体的结合而降低AngⅡ的生物学效应,但坎地沙坦能否增加乏氧肺腺癌放射敏感性尚不明确。鉴于此,本研究探讨坎地沙坦对乏氧条件下肺腺癌A549细胞放射敏感性的影响以及相关机制,旨在为提高肺腺癌的放疗疗效寻找新的易于临床推广的药物。
1 材料与方法
1.1 材料 人肺腺癌A549细胞由重庆医科大学附属第一医院分子肿瘤及表观遗传学重庆市重点实验室提供。胎牛血清、1640 培养基和胰蛋白酶购自BI 公司;CCK-8 试剂盒购自 Bimake 公司;坎地沙坦和AngⅡ购自Med Chem Express 公司;AngⅡ ELISA试剂盒购自基因美公司;兔抗人HIF-1α 单克隆抗体、兔抗人P53 单克隆抗体和兔抗人P21 单克隆抗体购自Abcam 公司;兔抗人GAPDH 单克隆抗体购自CST 公司;HRP 标记的羊抗兔二抗购自万类公司;ECL 发光液、全蛋白提取试剂盒、BCA 全蛋白浓度测定试剂盒购自碧云天公司;直线加速器购自VARIAN Medical Systems 公司。
1.2 方法
1.2.1 细胞培养 肺腺癌A549 细胞株在含10%胎牛血清的1640培养液中培养。设置常氧组、乏氧组和坎地沙坦+乏氧组。常氧组:37℃、5%CO2饱和湿度的培养箱中培养;乏氧组:37℃、1%O2、94%N2、5%CO2的三气培养箱中培养;坎地沙坦+乏氧组:添加坎地沙坦使其终浓度为1.6µmol/L 后置入37℃、1%O2、94%N2、5%CO2的三气培养箱中培养。
1.2.2 ELISA 检测AngⅡ的表达 将常氧培养的肺腺癌A549 细胞接种至直径10 cm 的培养皿,接种细胞密度为50 万/皿。常氧培养细胞至70%~80%汇合状态时更换培养液。然后设置常氧组、乏氧组和坎地沙坦+乏氧组进行对应条件培养24 h。ELISA法检测各组细胞上清液中AngⅡ的水平,按试剂盒说明书进行AngⅡ检测。
1.2.3 Western blot 检测 HIF-1α、P53 和P21 蛋白表达 将常氧培养的肺腺癌A549 细胞接种至直径10 cm的培养皿,接种细胞密度为50万/皿。常氧培养细胞至70%~80%汇合状态时更换培养液,然后设置4 个组,同时向4 个组中分别添加AngⅡ使其终浓度分别为 0 µmo/l L、0.1 µmo/l L、1 µmo/l L、10 µmo/l L,继续常氧培养24 h 后提取蛋白。另外常氧培养细胞至70%~80%汇合状态时更换培养液,然后设置常氧组、乏氧组和坎地沙坦+乏氧组,向坎地沙坦+乏氧组添加坎地沙坦使其终浓度为1.6 µmo/l L。将各组分别进行对应条件培养24 h后提取蛋白。按照说明书进行总蛋白提取,用BCA试剂盒测蛋白浓度。蛋白热变性后进行10%SDSPAGE 电泳,每孔蛋白上样量为40 µg,以250 mA 为参数恒流转膜至聚偏二氟乙烯膜上,用5%脱脂奶粉室温封闭1 h。封闭后分别用相应一抗4℃孵育过夜,TBST洗膜3次(10 min/次)。然后用二抗孵育1 h,TBST 洗膜3 次(10 min/次)。再用化学发光试剂盒显色,进行发光成像。采用ImageJ 软件分析条带的灰度值,蛋白相对表达量的结果用目的条带与组内参照的灰度值比值表示。
1.2.4 流式细胞仪检测细胞周期 将常氧培养的肺腺癌A549 细胞接种至直径10 cm 的培养皿,接种细胞密度为50 万/皿。常氧培养细胞至70%~80%汇合状态时更换培养液,设置常氧组、乏氧组和坎地沙坦+乏氧组,向坎地沙坦+乏氧组添加坎地沙坦使其终浓度为1.6 µmo/l L。将各组分别进行对应条件培养24 h。消化收集常氧组、乏氧组和坎地沙坦+乏氧组细胞,制备成单细胞悬液,置于预冷的80%乙醇中4℃固定过夜。将细胞浓度调整为1×106个/ml,然后依次加入 RNA 酶抑制剂、碘化丙啶,37℃避光30 min后经流式细胞仪检测细胞周期。
1.2.5 CCK-8 检测细胞增殖 将常氧培养的肺腺癌A549 细胞接种至96 孔板中,细胞接种密度为3 000个/孔,设置常氧组、乏氧组、坎地沙坦+乏氧组,待常氧培养各组细胞至细胞贴壁后,向坎地沙坦+乏氧组中加入坎地沙坦。各组分别进行对应条件的培养。分别于培养 0 h、24 h、48 h、72 h 时避光加入CCK-8 试剂(10µ/l 孔),在各自的孵箱中培养1 h。然后用酶标仪测450 nm波长的光密度值OD450。
1.2.6 克隆形成实验及单击多靶模型拟合细胞存活曲线 将常氧培养的肺腺癌A549 细胞接种至6 孔板,细胞接种密度为 400 个/孔,设置常氧组、乏氧组、坎地沙坦+乏氧组,待常氧培养各组细胞至细胞贴壁后,向坎地沙坦+乏氧组中加入坎地沙坦。将各组对应条件培养24 h 后分别给予0 Gy、2 Gy、4 Gy、6 Gy、8 Gy 放射线照射,照射后进行常氧培养。待其培养10 d 观察到肉眼可见细胞集落后,给予多聚甲醛固定和结晶紫染色后计算克隆数。克隆形成率(plating efficiency,PE)=(细胞克隆数/接种细胞数)×100%。细胞的存活分数(surviving frac‑tion,SF)=PE(照射组)/PE(对照组)。用单击多靶模型拟合细胞存活曲线,公式为SF=1−(1−e-kD)N。其相关参数 k=1/D0、lnn=D/qD0、增敏比=D0(乏氧照射组)/D(0坎地沙坦+乏氧照射组)。
1.3 统计学分析 各项试验均独立重复3 次。采用SPSS22.0软件对实验数据进行统计学分析,实验数据用表示,两组间比较采用t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 AngⅡ对常氧条件下A549细胞HIF-1α表达的影响 Western blot 结果显示:常氧条件下A549 细胞经 0 µmol/L、0.1 µmol/L、1 µmol/L、10 µmol/L不同浓度AngⅡ处理后其HIF-1α 表达逐渐上调,这提示AngⅡ能上调A549细胞中HIF-1α表达(图1)。
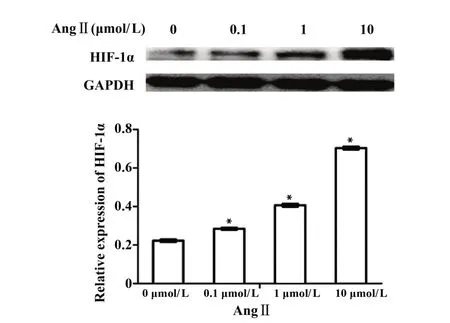
图1 常氧条件下不同浓度AngⅡ处理A549细胞后HIF-1α表达Fig.1 Expression of HIF-1α in A549 cells under normox⁃ic conditions treated with AngⅡ at different conen⁃trations
2.2 常氧组、乏氧组和坎地沙坦+乏氧组AngⅡ的表达 ELISA 结果显示:乏氧组细胞上清液AngⅡ表达显著高于常氧组(P<0.01,图2),坎地沙坦组+乏氧组与乏氧组细胞上清液AngⅡ表达无显著差异(P>0.05,图2)。
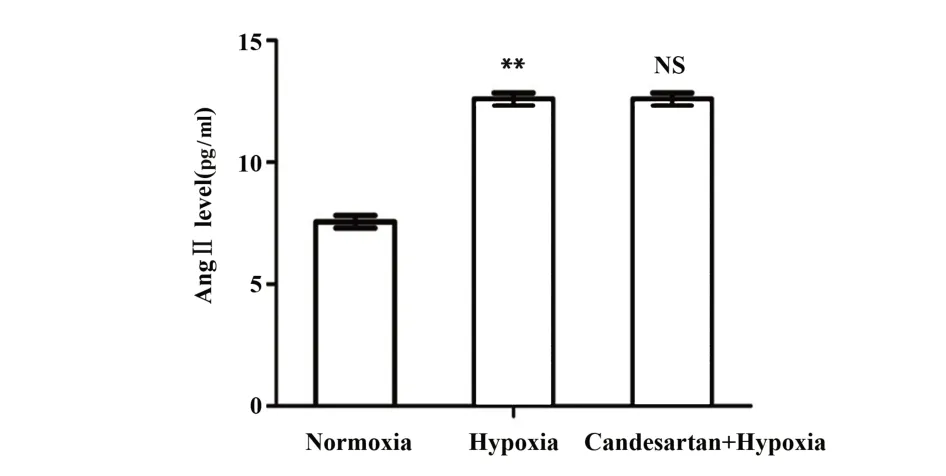
图2 常氧组、乏氧组和坎地沙坦+乏氧组AngⅡ的表达水平Fig.2 Expression of Ang Ⅱ in normoxia group,hypoxia group and candesartan combined with hypoxia group
2.3 常氧组、乏氧组和坎地沙坦+乏氧组HIF-1α、P53 及 P21 的表达 Western blot 结果显示:乏氧组HIF-1α、P53 和P21 表达较常氧组均上调(图3),坎地沙坦+乏氧组HIF-1α、P53 和P21 表达较乏氧组均下调(图3)。
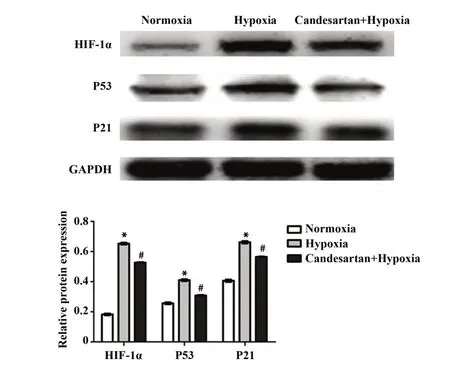
图3 常氧组、乏氧组和坎地沙坦+乏氧组HIF-1α、P53 和P21表达Fig.3 Expression of HIF-1α,P53 and P21 in normoxia group,hypoxia group and candesartan combined with hypoxia group
2.4 常氧组、乏氧组和坎地沙坦+乏氧组的细胞周期分布 流式细胞仪结果显示:乏氧组细胞周期G0/G1/S比例显著高于常氧组(图4,P<0.05),乏氧组细胞周期G2/M 比例显著低于常氧组(图4,P<0.05),坎地沙坦+乏氧组细胞周期G0/G1/S比例显著低于乏氧组(图4,P<0.05),坎地沙坦+乏氧组细胞周期G2/M比例显著高于乏氧组(图4,P<0.05)。

图4 常氧组、乏氧组和坎地沙坦+乏氧组细胞周期分布Fig.4 Cell cycle distribution in normoxia group,hypoxia group and candesartan combined with hypoxia group
2.5 常氧组、乏氧组和坎地沙坦+乏氧组细胞增殖情况 CCK8 结果显示:常氧组与乏氧组细胞OD450值无显著差异(P>0.05,图5),坎地沙坦+乏氧组和乏氧组细胞OD450值无显著差异(P>0.05,图5)。这表明与常氧比较,乏氧对A549细胞的增殖无显著影响(P>0.05,图5)。与乏氧比较,坎地沙坦对A549细胞的增殖无显著影响(P>0.05,图5)。
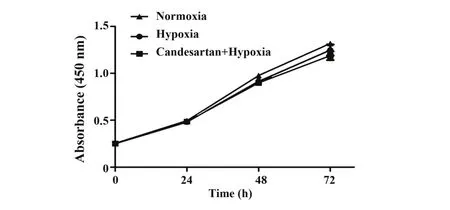
图5 常氧组、乏氧组和坎地沙坦+乏氧组OD450结果Fig.5 Results of OD450 in normoxia group,hypoxia group and candesartan combined with hypoxia group
2.6 常氧组、乏氧组和坎地沙坦+乏氧组细胞的存活分数 克隆形成实验和单击多靶模型拟合细胞存活分数曲线结果显示:乏氧组细胞存活分数(surviving fraction,SF)显著高于常氧组(表1及图6,P<0.01),坎地沙坦+乏氧组细胞存活分数显著低于乏氧组(表1、图6,P<0.01)。乏氧组的D0为3.226,坎地沙坦+乏氧组的D0为2.166,放射增敏比为1.489(表 2)。
表1 常氧组、乏氧组和坎地沙坦+乏氧组细胞的存活分数()Tab.1 Surviving fraction of normoxia group,hypoxia group and candesartan combined with hypoxia group()
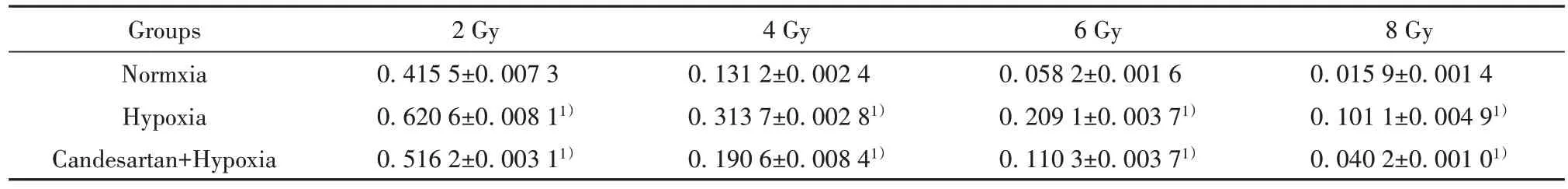
表1 常氧组、乏氧组和坎地沙坦+乏氧组细胞的存活分数()Tab.1 Surviving fraction of normoxia group,hypoxia group and candesartan combined with hypoxia group()
Note:1)P<0.01,hypoxia group vs normoxia group,candesartan combined with hypoxia group vs hypoxia group.
8 Gy 0.015 9±0.001 4 0.101 1±0.004 91)0.040 2±0.001 01)Groups Normxia Hypoxia Candesartan+Hypoxia 2 Gy 0.415 5±0.007 3 0.620 6±0.008 11)0.516 2±0.003 11)4 Gy 0.131 2±0.002 4 0.313 7±0.002 81)0.190 6±0.008 41)6 Gy 0.058 2±0.001 6 0.209 1±0.003 71)0.110 3±0.003 71)
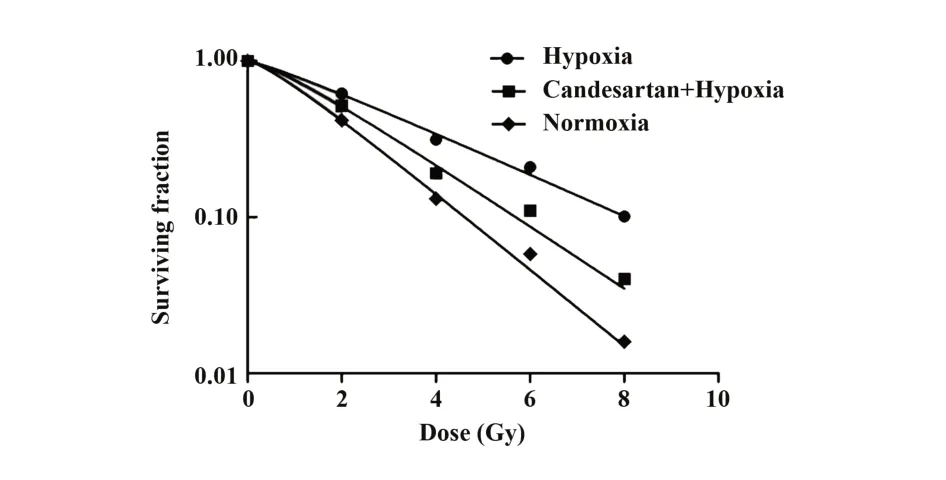
图6 常氧组、乏氧组和坎地沙坦+乏氧组细胞存活分数曲线Fig.6 Cell survival fraction curve of normoxia group,hy⁃poxia group and candesartan combined with hypox⁃ia group
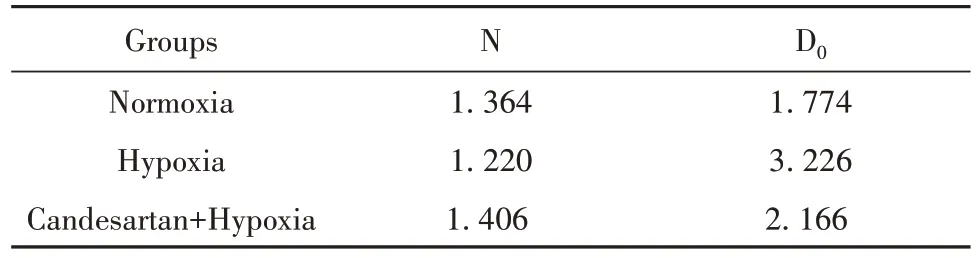
表2 常氧组、乏氧组和坎地沙坦+乏氧组细胞单击多靶模型参数Tab.2 Parameter of click on multi-target model in nor⁃moxia group,hypoxia group and candesartan combined with hypoxia group
3 讨论
肺癌是目前对人类健康和生命安全威胁最大的恶性肿瘤,其发病率及死亡率均居我国恶性肿瘤首位[2,12]。而肺腺癌是肺癌中最常见的病理类型,其主要好发于女性和不吸烟者[3,13]。放疗作为目前肺腺癌的重要治疗方式,其疗效与氧浓度密切相关,而肺腺癌组织中普遍存在的乏氧会导致放射抗拒,这给提高肺腺癌放疗疗效和改善患者的预后带来了严峻的挑战。
MIAO 等[14]发现肺癌患者化疗时使用血管紧张素Ⅱ受体阻滞剂(ARBs)能增加患者的无疾病进展期,这提示ARBs 有可能在肿瘤的治疗中发挥重要作用。然而ARBs 是否对肿瘤的放疗疗效也会产生影响尚不明确。坎地沙坦是ARBs 的代表药物之一,因此我们对其能否影响乏氧条件下肺腺癌A549细胞的放射敏感性进行了研究。实验发现,与常氧相比,乏氧未对肺腺癌A549 细胞的增殖产生影响,但其显著增加了其细胞存活分数。当给予坎地沙坦处理乏氧肺腺癌A549 细胞后,与乏氧相比,坎地沙坦亦未对肺腺癌A549细胞的增殖产生影响,但却显著降低了其细胞存活分数。这表明坎地沙坦增加了乏氧肺腺癌A549 细胞的放射敏感性。但其相关机制尚不明确,因此在实验中对机制进行了进一步研究。
坎地沙坦发挥作用的途径是通过阻断AngⅡ的受体从而使AngⅡ的生物效应降低。有研究发现在实体肿瘤中存在AngⅡ表达,且在实体肿瘤乏氧区域内 AngⅡ的表达可被乏氧显著上调[7,10]。另外还有研究发现乏氧条件下HIF-1α 表达亦上调,而且HIF-1α 在肿瘤细胞适应乏氧微环境中发挥着重要作用,同时乏氧肿瘤细胞对放射线产生放射抗拒也与 HIF-1α 密切相关[9-15]。在肺腺癌 A549 细胞中,AngⅡ与HIF-1α 的表达是否存在着联系尚不得而知。进一步研究发现乏氧促进了肺腺癌A549 细胞AngⅡ和HIF-1α 表达上调,且常氧条件下随着AngⅡ浓度的增加A549 细胞中HIF-1α 表达亦逐渐上调,这表明AngⅡ能促进HIF-1α 表达上调。从实验结果中还得知,与常氧相比,乏氧条件下A549 细胞中HIF-1α 表达上调引起了P53 和细胞周期调节蛋白P21 表达上调,这与相关研究报道HIF-1α 可上调P53 表达后进一步上调 P21 的表达是一致的[16-17]。此外,P21 可阻止细胞周期 G1/S 和 S/G2 转化[9,18]。因此推测HIF-1α 使P21 表达上调后可能会进一步对细胞周期产生影响,本实验对此展开了相关研究。从实验结果中得知,与常氧相比,乏氧诱导A549 细胞中细胞周期G0/G1/S 比例显著增加且G2/M 比例显著降低,从而导致细胞周期G0/G1/S阻滞。现已知放射线敏感性与细胞周期时相有关,G2/M 时相的细胞对放射线敏感性较高,而G0/G1和S 时相的细胞对放射线敏感性较低[19-20]。由此可知,与常氧相比,乏氧通过促进AngⅡ表达而上调HIF-1α 表达,后者进一步上调 P53 和 P21 表达而促使细胞周期G0/G1/S 阻滞,最终导致乏氧肺腺癌A549 细胞放射敏感性降低。本实验已经证实坎地沙坦能改善乏氧引起的肺腺癌A549 细胞放射抗拒而增加其放射敏感性,它能阻断AngⅡ受体降低AngⅡ的效应。因此本研究推测坎地沙坦可能通过降低AngⅡ效应最终对细胞周期G0/G1/S 阻滞产生影响,从而增加乏氧肺腺癌A549 细胞放射敏感性。鉴于此,本研究发现乏氧条件下给予坎地沙坦处理A549 细胞后,与乏氧组比较,其HIF-1α 表达下调且P53 和P21 表达亦下调,同时细胞周期G0/G1/S 比例显著降低且G2/M 比例显著增加。这证实乏氧条件下坎地沙坦通过降低AngⅡ的效应可使A549细胞中HIF-1α表达下调,进一步导致P53、P21表达下调后抑制细胞周期G0/G1/S阻滞,从而增加对放射线更敏感的细胞周期G2/M 比例,最终导致乏氧条件下A549细胞放射敏感性增加。综上所述,坎地沙坦增加乏氧条件下A549 细胞放射敏感性的机制可能与其下调HIF-1α 表达后进一步抑制细胞周期G0/G1/S阻滞有关。
目前本研究发现坎地沙坦能增加乏氧条件下肺腺癌A549细胞的放射敏感性,同时初步揭示了其可能的机制。坎地沙坦是当前临床中广泛用于治疗心血管等疾病的药物,这为进一步研究改善乏氧肺腺癌放疗疗效和探寻新的易于临床推广的放疗增敏剂提供了新的思路。我们将在后续的动物实验中进一步研究坎地沙坦放疗增敏的作用和其相关机制。
