miR-150-5p 通过调控DDR1 表达对缺氧缺糖诱导的大鼠皮质神经细胞损伤的影响①
2021-08-23王立侠韩金芬马明明郑州市第七人民医院神经电生理室郑州450000
王立侠 韩金芬 马明明 (郑州市第七人民医院神经电生理室,郑州450000)
缺血性脑卒中又称脑梗死,是由脑部供血障碍而引起的局限性脑组织缺血性坏死或脑软化,其发病率和致残率较高,是导致人类死亡和残疾的主要原因之一[1-2]。研究显示,miRNA 在急性缺血性脑卒中发生发展中具有重要作用[3]。研究报道,miR-150-5p 与缺血性脑卒中患者二级预防治疗的中期预后有关,参与脑血栓形成的生理病理过程[4]。缺血性脑卒中患者外周血miR-150-5p 表达显著降低,可作为缺血性脑卒中的生物标志物[5]。盘状结构域受体1(discoidin domain receptor 1,DDR1)是一种受体型蛋白酪氨酸激酶,其激活可活化一系列细胞内外信号传导,参与多种疾病过程[6]。抑制DDR1 活化可降低缺氧缺血脑损伤新生鼠皮层组织中微管相关蛋白Tau 磷酸化水平,促进乙酰胆碱释放,DDR1 抑制剂对新生大鼠缺氧缺血性脑损伤具有保护作用[7]。但miR-150-5p对缺血性脑损伤的影响及机制尚未阐明。研究发现,缺氧缺糖可导致神经元损伤[8]。本研究采用缺氧缺糖(oxygen-glucose depri‑vation,OGD)处理大鼠大脑皮质神经细胞建立神经损伤模型,探究miR-150-5p对OGD 诱导的大鼠大脑皮质神经细胞损伤的影响及其机制是否与DDR1相关,为相关脑疾病治疗提供新的生物标志物和靶点。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级孕16~18 d SD 大鼠购自上海斯莱克实验动物有限公司,生产许可证号:SCXK(沪)2012-0002。
1.1.2 主要试剂与仪器 Neurobasal 培养基、B27、高糖DMEM、无糖DMEM 培养基购自美国Gibco 公司;胎牛血清购自Hyclone 公司;荧光定量试剂盒购自美国 Progema 公司;RIPA 蛋白裂解液、BCA 试剂盒购自江苏碧云天公司;MTT 试剂盒购自美国Sig‑ma 公司;乳酸脱氢酶(lactic dehydrogenase,LDH)试剂盒购自南京建成生物工程研究所;膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)、碘化丙啶(PI)试剂盒、双荧光素酶报告基因检测试剂盒购自北京So‑larbio 公司;CO2孵育箱、Thermo FC 酶标仪购自美国Thermo 公司;FACSCanto Ⅱ流式细胞仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 大鼠皮质神经细胞分离培养 无菌条件下分离大鼠大脑皮层组织,剪成1~2 mm3组织块,0.25%胰蛋白酶消化15 min,加入含10%胎牛血清的高糖DMEM 培养基终止消化,离心得细胞沉淀,重悬,过200 目筛,离心,置于神经元专用培养基(98%Neurobasal+2%B27),轻轻吹打制成细胞悬液,接种于预先包被过L-多聚赖氨酸的6 孔板中,37℃、5%CO2培养。
1.2.2 OGD模型建立与细胞分组 取培养5 d的原代大脑皮层神经元,弃培养基,加入无糖DMEM培养基(无糖DMEM 预先放入缺氧培养箱中去除培养基中的氧气),置于缺氧培养箱(37℃、95%N2、5%CO2)进行OGD 培养90 min,换为神经元专用培养基继续培养,正常对照(Con)组不做任何OGD 处理。将miRNC、miR-150-5p、anti-miR-NC、anti-miR-150-5p 转染至皮层神经细胞,记为miR-NC组、miR-150-5p组、an‑ti-miR-NC 组、anti-miR-150-5p 组;将 miR-NC、miR-150-5p、si-NC、si-DDR1 转染至皮层神经细胞后进行OGD 处理,记为 OGD+miR-NC 组、OGD+miR-150-5p组、OGD+si-NC 组、OGD+si-DDR1 组;将 miR-150-5p分别与pcDNA、pcDNA-DDR1 共转染至皮层神经细胞后再进行OGD 处理,记为OGD+miR-150-5p+pcD‑NA组、OGD+miR-150-5p+pcDNA-DDR1组。
1.2.3 RT-qPCR 检测 miR-150-5p、DDR1 mRNA 表达 提取细胞总RNA,反转录为cDNA,按荧光定量说明进行PCR反应,各样品设3个重复,反应条件为95℃ 30 s,60℃ 40 s;72℃ 30 s,共40 个循环;60℃ 延长 5 min,2−ΔΔCt法计算。miR-150-5p 和 DDR1 分别以U6 和 GAPDH 为 内 参 ,miR-150-5p F:5'-CGCTCTCTCCCAACCCTTGTACC-3',R:5'-GTGCAGGGTCCGAGGT-3';U6 F:5'-CGCTTCGGCAGCACATATACTA-3',R:5'-CGCTTCACGAATTTGCGTGTCA-3';DDR F:5'-ACTTTGGCATGAGCCGGAAC-3',R:5'-ACGTCACTCGCAGTCGTGAAC-3';GAPDH F:5'-TGCACCACCAACTGCTTAGC-3',R:5'-GGCATGGACTGTGGTCATGAG-3',引物由上海生工生物工程公司合成。
1.2.4 Western blot 法检测 DDR1、Bcl-2、Bax 蛋白表达 提取各组细胞总蛋白,BCA 试剂盒进行蛋白定量,配胶,上样,SDS-PAGE 转膜,封闭液封闭90 min,加入一抗4℃孵育过夜,加入二抗室温孵育2 h,底物反应、显影、定影,扫描仪扫描胶片,Image软件分析各目的条带灰度值,以GAPDH 为内参,分析各组目的蛋白表达。
1.2.5 MTT 检测细胞存活率 收集细胞,加入MTT 孵育 4 h,吸取上清,加入 DMSO,摇匀,酶标仪测量吸光度(OD)。细胞存活率(%)=OD实验组/OD空白对照组×100%。
1.2.6 LDH释放率检测 收集培养基上清和细胞,根据说明书进行LDH释放量检测。LDH释放率(%)=LDH上清/(LDH上清+LDH细胞)×100%。
1.2.7 细胞凋亡率检测 收集细胞,预冷PBS 漂洗,加入结合缓冲液重悬,加入Annexin V-FITC和PI混匀后避光孵育10 min,流式细胞仪检测细胞凋亡率。每组设3个复孔,实验重复3次。
1.2.8 双荧光素酶报告实验验证miR-150-5p 和DDR1 靶向关系 构建含miR-150-5p 结合位点的DDR1 野生型载体和突变型载体,分别与miR-NC、miR-150-5p共转染至皮层神经细胞中,转染48 h,根据说明书检测荧光素酶活性。
1.3 统计学分析 采用SPSS20.0软件进行统计学分析,数据以表示,两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 miR-150-5p 和 DDR1 在 OGD 诱导的大鼠皮质神经细胞中的表达 与对照组相比,OGD 组大鼠皮质神经细胞中miR-150-5p 表达降低,DDR1 mRNA和蛋白表达升高(P<0.05,图1、表1)。
表1 miR-150-5p 和DDR1 在OGD 诱导的大鼠皮质神经细胞中的表达(,n=9)Tab.1 Expressions of miR-150-5p and DDR1 in OGD-in⁃duced rat cortical neural cells(,n=9)

表1 miR-150-5p 和DDR1 在OGD 诱导的大鼠皮质神经细胞中的表达(,n=9)Tab.1 Expressions of miR-150-5p and DDR1 in OGD-in⁃duced rat cortical neural cells(,n=9)
Note:Compared with Con group,1)P<0.05.
DDR1 protein 0.56±0.05 0.92±0.081)11.448 0.000 Groups Con OGD t P miR-150-5p 1.00±0.08 0.43±0.041)19.118 0.000 DDR1 mRNA 1.01±0.09 3.42±0.341)20.557 0.000
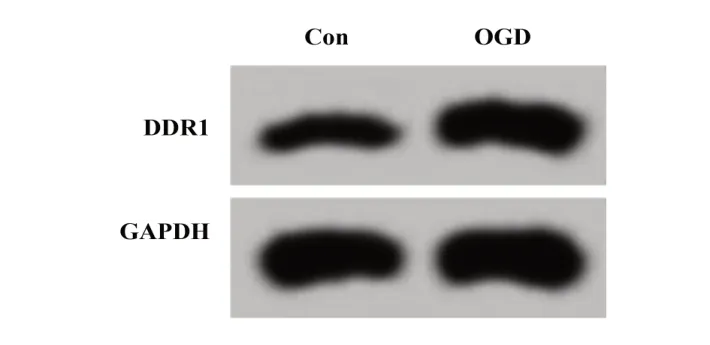
图1 DDR1蛋白表达Fig.1 Expression of DDR1 protein
2.2 miR-150-5p 过表达对OGD 诱导的大鼠皮质神经细胞存活率和LDH 释放的影响 与对照组相比,OGD 组miR-150-5p 表达降低,细胞存活率降低,LDH 释放率升高(P<0.05);与 OGD+miR-NC 组相比,OGD+miR-150-5p 组 miR-150-5p 表达升高,细胞存活率升高,LDH释放率降低(P<0.05,表2)。
表2 miR-150-5p 过表达对OGD 诱导的大鼠皮质神经细胞存活率和LDH释放的影响(,n=9)Tab.2 Effect of miR-150-5p overexpression on survival rate and LDH release of rat cortical neurons in⁃duced by OGD(,n=9)
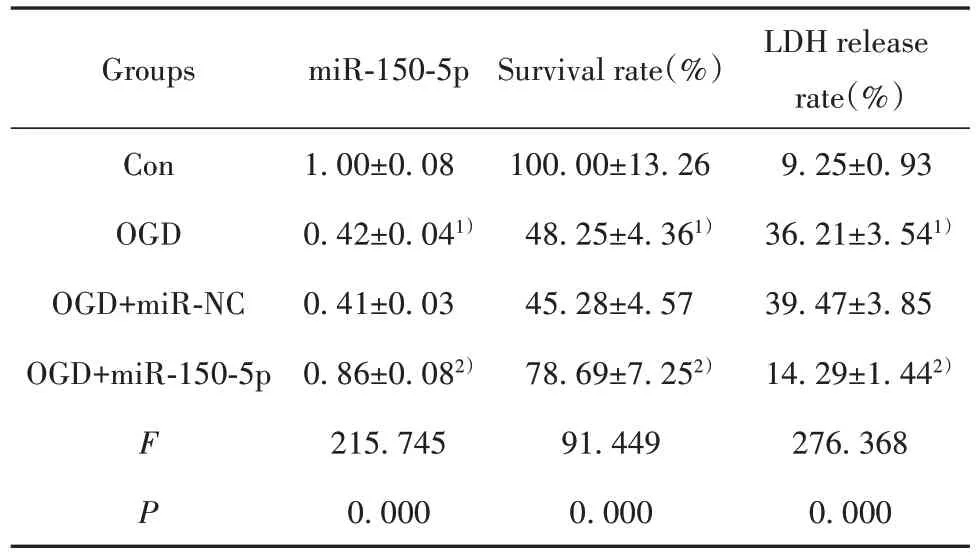
表2 miR-150-5p 过表达对OGD 诱导的大鼠皮质神经细胞存活率和LDH释放的影响(,n=9)Tab.2 Effect of miR-150-5p overexpression on survival rate and LDH release of rat cortical neurons in⁃duced by OGD(,n=9)
Note:Compared with Con group,1)P<0.05;compared with OGD+miRNC group,2)P<0.05.
miR-150-5p Groups Survival rate(%)1.00±0.08 0.42±0.041)0.41±0.03 0.86±0.082)215.745 0.000 Con OGD OGD+miR-NC OGD+miR-150-5p F P 100.00±13.26 48.25±4.361)45.28±4.57 78.69±7.252)91.449 0.000 LDH release rate(%)9.25±0.93 36.21±3.541)39.47±3.85 14.29±1.442)276.368 0.000
2.3 miR-150-5p 过表达对OGD 诱导的大鼠皮质神经细胞凋亡的影响 与对照组相比,OGD 组细胞凋亡率升高,Bcl-2 表达降低,Bax 表达升高(P<0.05);与 OGD+miR-NC 组相比,OGD+miR-150-5p 组细胞凋亡率降低,Bcl-2 表达升高,Bax 表达降低(P<0.05,图2、表3)。

图2 miR-150-5p 过表达对OGD 诱导的大鼠皮质神经细胞凋亡的影响Fig.2 Effect of miR-150-5p overexpression on OGD-in⁃duced apoptosis of rat cortical neurons
表3 miR-150-5p 过表达对OGD 诱导的大鼠皮质神经细胞凋亡的影响(,n=9)Tab.3 Effect of miR-150-5p overexpression on OGD-in⁃duced apoptosis of rat cortical neurons(,n=9)
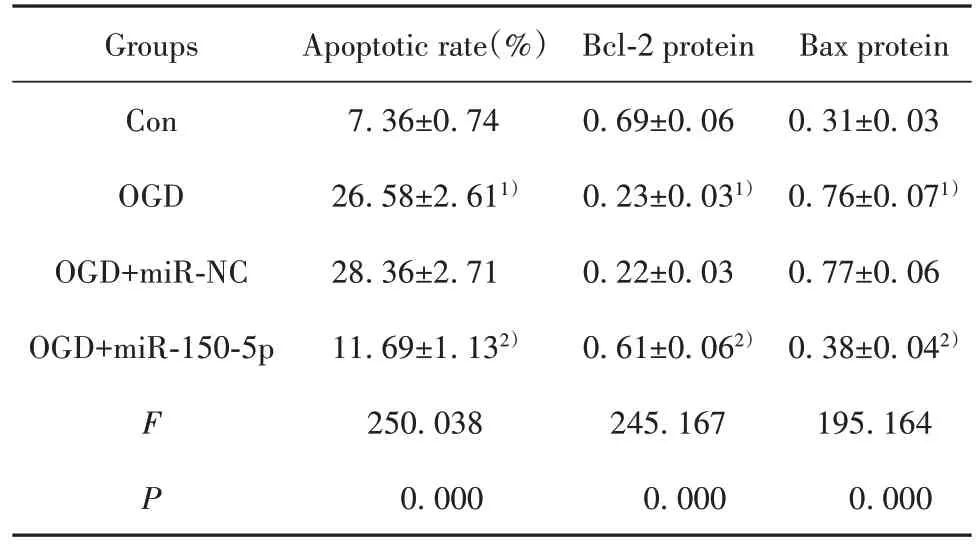
表3 miR-150-5p 过表达对OGD 诱导的大鼠皮质神经细胞凋亡的影响(,n=9)Tab.3 Effect of miR-150-5p overexpression on OGD-in⁃duced apoptosis of rat cortical neurons(,n=9)
Note:Compared with Con group,1)P<0.05;compared with OGD+miRNC group,2)P<0.05.
Bax protein 0.31±0.03 0.76±0.071)0.77±0.06 0.38±0.042)195.164 0.000 Groups Con OGD OGD+miR-NC OGD+miR-150-5p F P Apoptotic rate(%)7.36±0.74 26.58±2.611)28.36±2.71 11.69±1.132)250.038 0.000 Bcl-2 protein 0.69±0.06 0.23±0.031)0.22±0.03 0.61±0.062)245.167 0.000
2.4 抑制DDR1 表达对OGD 诱导的大鼠皮质神经细胞损伤的影响 与OGD+si-NC 组相比,OGD+si-DDR1 组 DDR1 表达降低,细胞存活率升高,LDH 释放率降低,细胞凋亡率降低,Bcl-2 表达升高,Bax 表达降低(P<0.05,图3、表4)。
表4 抑制DDR1表达对OGD诱导的大鼠皮质神经细胞损伤的影响(,n=9)Tab.4 Effect of DDR1 expression inhibition on OGD-induced rat cortical neuronal injury(,n=9)
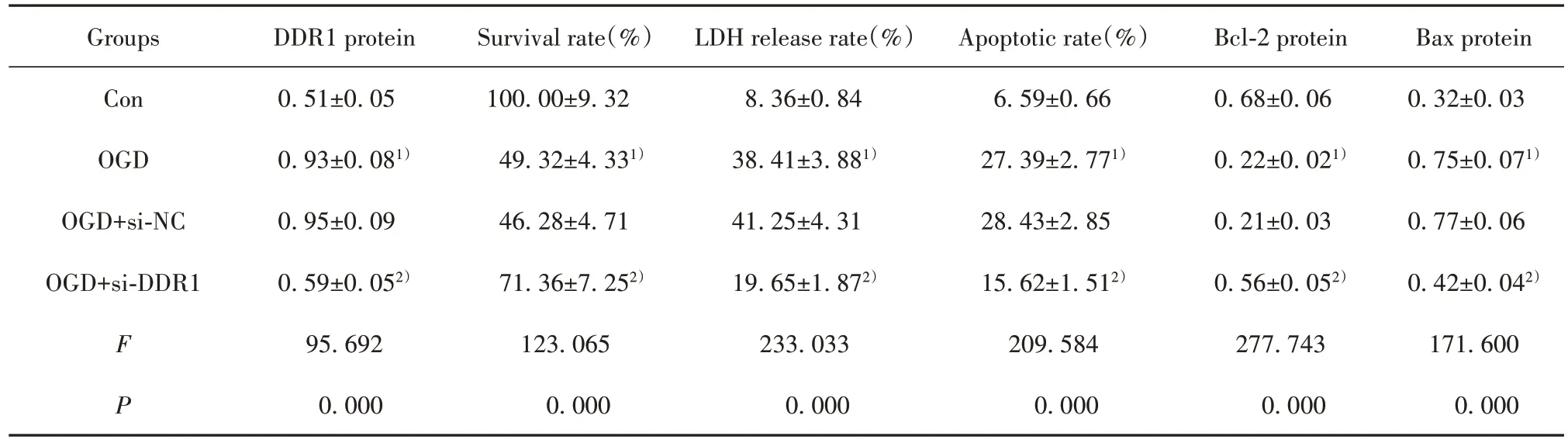
表4 抑制DDR1表达对OGD诱导的大鼠皮质神经细胞损伤的影响(,n=9)Tab.4 Effect of DDR1 expression inhibition on OGD-induced rat cortical neuronal injury(,n=9)
Note:Compared with Con group,1)P<0.05;compared with OGD+si-NC group,2)P<0.05.
Bax protein 0.32±0.03 0.75±0.071)0.77±0.06 0.42±0.042)171.600 0.000 Groups Con OGD OGD+si-NC OGD+si-DDR1 F P DDR1 protein 0.51±0.05 0.93±0.081)0.95±0.09 0.59±0.052)95.692 0.000 Survival rate(%)100.00±9.32 49.32±4.331)46.28±4.71 71.36±7.252)123.065 0.000 LDH release rate(%)8.36±0.84 38.41±3.881)41.25±4.31 19.65±1.872)233.033 0.000 Apoptotic rate(%)6.59±0.66 27.39±2.771)28.43±2.85 15.62±1.512)209.584 0.000 Bcl-2 protein 0.68±0.06 0.22±0.021)0.21±0.03 0.56±0.052)277.743 0.000
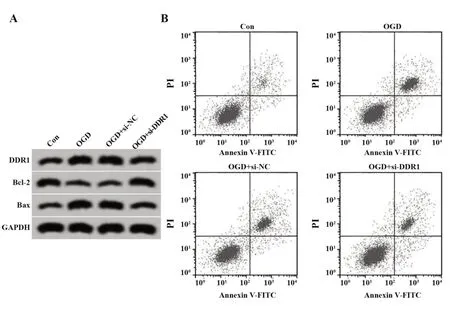
图3 抑制DDR1 表达对OGD 诱导的大鼠皮质神经细胞凋亡的影响Fig.3 Effect of DDR1 expression inhibition on OGD-in⁃duced apoptosis of rat cortical neurons
2.5 miR-150-5p 靶向调控 DDR1 表达 StarBase 预测显示,miR-150-5p 与DDR1 存在结合位点(图4)。荧光素酶报告实验显示,与miR-NC 组相比,miR-150-5p 组中转染DDR1 野生型表达载体的细胞荧光素酶活性显著降低(P<0.05);而转染DDR1 突变型表达载体的细胞荧光素酶活性差异无统计学意义(表 5)。与 miR-NC 组相比,miR-150-5p 组 DDR1 表达显著升高(P<0.05),与anti-miR-NC 组相比,antimiR-150-5p组DDR1表达显著降低(P<0.05,表6)。
表5 双荧光素酶报告实验(,n=9)Tab.5 Double luciferase report experiments(,n=9)
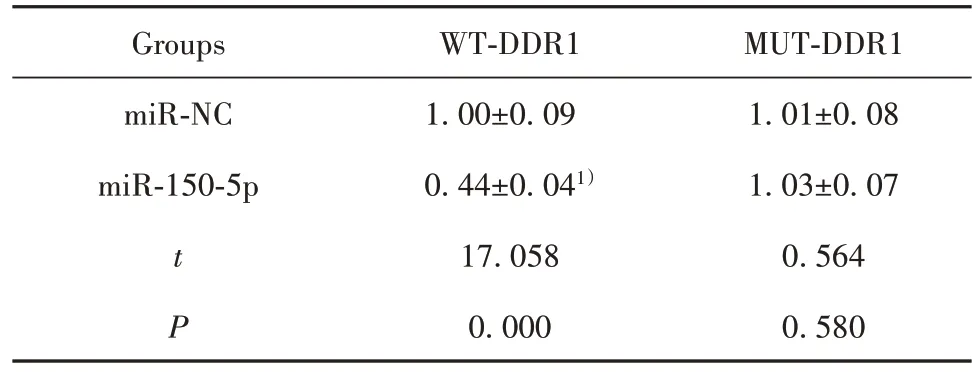
表5 双荧光素酶报告实验(,n=9)Tab.5 Double luciferase report experiments(,n=9)
Note:Compared with miR-NC group,1)P<0.05.
MUT-DDR1 1.01±0.08 1.03±0.07 0.564 0.580 Groups miR-NC miR-150-5p t P WT-DDR1 1.00±0.09 0.44±0.041)17.058 0.000
表6 miR-150-5p调控DDR1蛋白表达(,n=9)Tab.6 miR-150-5p regulates DDR1 protein expression(,n=9)

表6 miR-150-5p调控DDR1蛋白表达(,n=9)Tab.6 miR-150-5p regulates DDR1 protein expression(,n=9)
Note:Compared with miR-NC group,1)P<0.05;compared with antimiR-NC group,2)P<0.05.
DDR1 protein 0.55±0.05 0.22±0.021)0.53±0.04 0.96±0.082)304.404 0.000 Groups miR-NC miR-150-5p anti-miR-NC anti-miR-150-5p F P
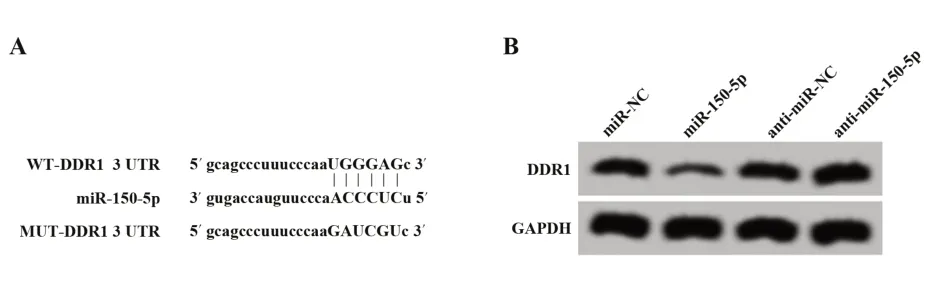
图4 miR-150-5p靶向调控DDR1表达Fig.4 miR-150-5p targets DDR1 expression
2.6 DDR1 过表达逆转miR-150-5p 过表达对OGD诱导的大鼠皮质神经细胞损伤的作用 与OGD+miR-150-5p+pcDNA 组相比,OGD+miR-150-5p+pcD‑NA-DDR1 组DDR1 表达升高,细胞存活率降低,LDH释放率升高,细胞凋亡率升高,Bcl-2表达降低,Bax表达升高(P<0.05,表7、图5)。
表7 DDR1过表达逆转miR-150-5p过表达对OGD诱导的大鼠皮质神经细胞损伤的作用(,n=9)Tab.7 DDR1 overexpression reverses effect of miR-150-5p overexpression on OGD-induced rat cortical neuronal injury(,n=9)
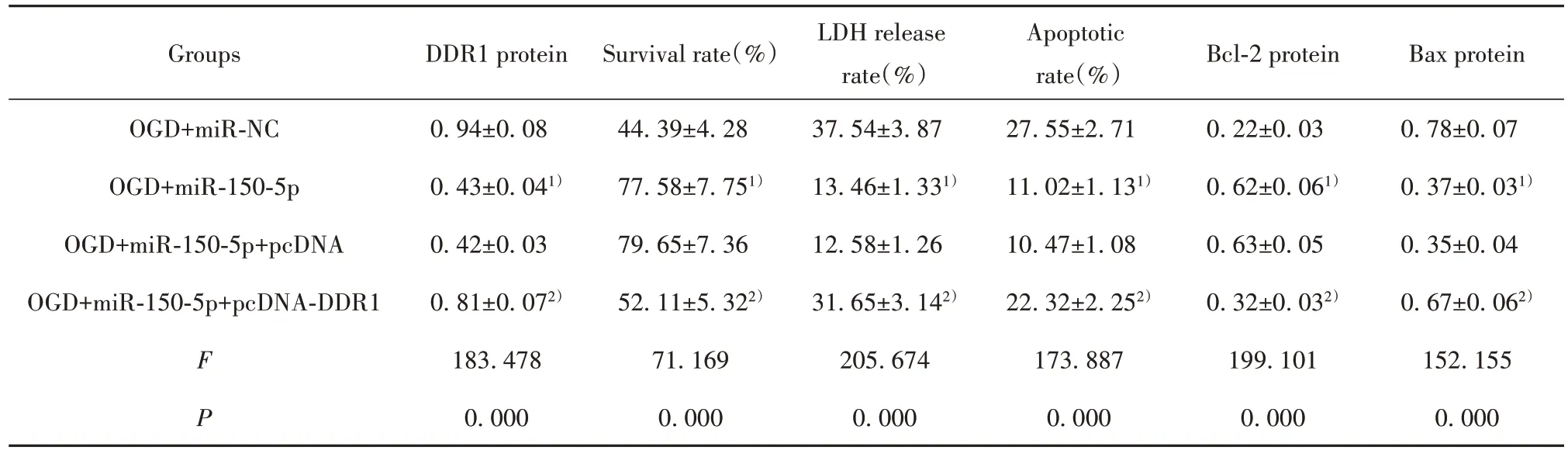
表7 DDR1过表达逆转miR-150-5p过表达对OGD诱导的大鼠皮质神经细胞损伤的作用(,n=9)Tab.7 DDR1 overexpression reverses effect of miR-150-5p overexpression on OGD-induced rat cortical neuronal injury(,n=9)
Note:Compared with OGD+miR-NC group,1)P<0.05;compared with OGD+miR-150-5p+pcDNA group,2)P<0.05.
Groups DDR1 protein Survival rate(%)Bcl-2 protein Bax protein 0.78±0.07 0.37±0.031)0.35±0.04 0.67±0.062)152.155 0.000 OGD+miR-NC OGD+miR-150-5p OGD+miR-150-5p+pcDNA OGD+miR-150-5p+pcDNA-DDR1 F P 0.94±0.08 0.43±0.041)0.42±0.03 0.81±0.072)183.478 0.000 44.39±4.28 77.58±7.751)79.65±7.36 52.11±5.322)71.169 0.000 LDH release rate(%)37.54±3.87 13.46±1.331)12.58±1.26 31.65±3.142)205.674 0.000 Apoptotic rate(%)27.55±2.71 11.02±1.131)10.47±1.08 22.32±2.252)173.887 0.000 0.22±0.03 0.62±0.061)0.63±0.05 0.32±0.032)199.101 0.000
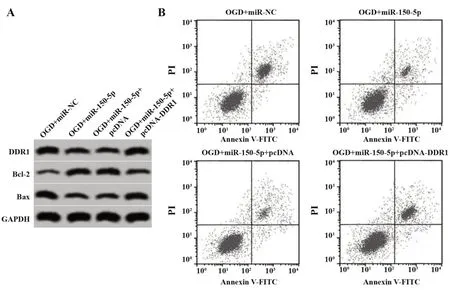
图5 DDR1 过表达逆转miR-150-5p 过表达对OGD 诱导的大鼠皮质神经细胞凋亡的作用Fig.5 DDR1 overexpression reverses effect of miR-150-5p overexpression on OGD-induced rat cortical neuro⁃nal apoptosis
3 讨论
缺血性脑损伤是临床常见疾病,缺血性神经细胞凋亡与脑损伤发生密切相关,研究其作用分子机制对脑损伤防治具有重要意义[9]。氧化应激在缺血缺氧性脑损伤中具有重要作用[10]。本研究采用OGD 法诱导大鼠大脑皮质神经细胞,结果显示,细胞存活率降低,LDH 释放率升高,细胞凋亡率升高,说明OGD 可诱导大脑皮质神经细胞凋亡和氧化应激。研究报道,miR-24 抑制剂可预防缺血性卒中神经元凋亡[11]。miR-let-7c-5p 过表达通过抑制神经炎症和调节小胶质细胞活化,改善创伤性脑损伤诱导的神经功能障碍和脑水肿[12]。说明miRNA 参与调控缺血性卒中及脑神经损伤。较低水平的miR-150-5p 与死亡率独立相关,miR-150-5p 可降低急性缺血性中风后 90 d 内的死亡率风险[13]。miR-150 通过调节细胞凋亡保护小鼠心脏免受缺血性损伤[14]。本研究结果显示,OGD 诱导的皮质神经细胞中miR-150-5p 呈低表达。过表达miR-150-5p,细胞存活率升高,LDH释放率降低,细胞凋亡率降低,Bcl-2表达升高,Bax 水平降低,提示过表达miR-150-5p 可促进细胞存活,抑制LDH 释放和细胞凋亡,可保护OGD诱导的大脑皮质神经细胞损伤。
研究报道,氧糖剥夺损伤的神经元细胞中DDR1 蛋白表达增加[15]。大鼠局灶性脑缺血后DDR1表达升高,DDR1可能在脑缺血再灌注后破坏血脑屏障中起关键作用[16]。miR-199a-5p 通过下调大鼠DDR1预防脑缺血性损伤[17]。高迁移率簇蛋白B1(high mobility group box 1,HMGB1)通过上调DDR1 表达和下调心肌细胞缺氧/复氧损伤后雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)磷酸化促进细胞凋亡和上皮间质转化(epithelialmesenchymal transition,EMT),并诱导自噬[18]。本研究显示,OGD 诱导的皮质神经细胞中DDR1 呈高表达,抑制DDR1表达可促进细胞存活,减少LDH释放和细胞凋亡,且miR-150-5p 靶向调控DDR1,DDR1过表达逆转miR-150-5p 过表达对OGD 诱导的大鼠皮质神经细胞损伤的保护作用。
综上所述,过表达miR-150-5p 可能通过下调DDR1 表达保护OGD 诱导的大鼠皮质神经细胞损伤,为治疗缺血性脑损伤相关疾病提高新思路和靶点。
