淡紫紫孢菌亲环蛋白PlCYP6 互作蛋白的筛选
2021-08-22刘娟朱春晓肖雪琼莫陈汨王高峰肖炎农
刘娟 朱春晓 肖雪琼 莫陈汨 王高峰 肖炎农
(华中农业大学植物科学技术学院,武汉 430070)
蛋白与蛋白之间的相互作用是生物体普遍存在的现象,改变蛋白间的相互作用可能调控蛋白的生物学功能,从而影响机体正常生长发育[1]。因此,研究蛋白间互作关系对于揭示生命过程的调控机制至关重要。目前应用于互作蛋白筛选的技术主要有酵母双杂交(yeast two-hybrid,Y2H)、双分子荧光互 补(bimolecular fluorescent complimentary,BiFC)、pull-down 等[2]。
免疫沉淀联合质谱分析技术(immunoprecipitation combined with mass spectrometry,IP-MS)是 指在非变性条件下进行细胞的裂解从而保持了细胞内蛋白间的相互作用关系不被破坏,当目标蛋白被蛋白琼脂糖珠上共价连接的特异性抗体捕获(免疫沉淀)时,可能同时捕获参与蛋白间互作的伴侣蛋白,通过反复洗涤除去非特异性结合的蛋白质后,采用SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离并通过液相色谱串联质谱分析(liquid chromatographytandem mass spectrometry,LC-MS/MS)进行蛋白种类的鉴定[3]。目前,该技术已广泛应用于研究蛋白间的互作。如Li 等[4]使用该技术鉴定与RBM45 特异性相互作用的蛋白质,并通过免疫印迹和免疫细胞化学验证了选定的PPI,证实RBM45 主要在细胞核中依赖与RNA 的相互作用和许多其他RBP 缔合。Phee等[5]使用免疫沉淀结合蛋白质组学筛选拟南芥中的与植物光敏色素发生直接或间接相互作用的新型潜在互作蛋白,以阐明植物中光信号通路。李耀东等[6]筛选得到与A 型流感病毒M2 结合的多种蛋白,通过质谱分析确定ataxin 10 和3 个真核翻译起始因子为候选互作蛋白。岳金荣等[7]通过制备多克隆抗体进行免疫沉淀,筛选出165 种特有的差异蛋白,通过蛋白质互作网络分析发现,直接与植物盐藻MAPK 相互作用的蛋白有4 种。
亲环蛋白(cyclophilin,简称CYP)属于肽基脯氨酰异构酶超家族[8]。由于其典型的肽基脯氨酰异构酶活性,亲环蛋白被认为存在蛋白质折叠酶活性从而具有分子伴侣蛋白的功能,参与多结构域蛋白复合体的组装[8-10]。亲环蛋白通过蛋白间的相互作用在细胞生物学过程中具有重要作用,如RNA 剪切[11]、转录调控[12-14]和信号转导[15-16]等。研究表明,淡紫紫孢菌具有10 个亲环蛋白,PlCYP6基因表达响应氯化钠、双氧水和刚果红等非生物胁迫过程[17],但其分子调控机理未见报道。
淡紫紫孢菌(Purpureocillium lilacinum)已广泛应用于防治植物线虫[18],是防治线虫真菌中应用前景最好的生防真菌之一[19-20]。淡紫紫孢菌多以孢子粉剂进行田间施用[21],施入田间的淡紫紫孢菌面临包括盐胁迫在内的多种非生物胁迫,不利的环境因素将降低淡紫紫孢菌生防效能[22]。解析淡紫紫孢菌响应非生物胁迫机制为改良和选育环境适应性更高的生防菌株提供理论依据。本研究旨在以淡紫紫孢菌亲环蛋白PlCYP6 为研究对象,采用免疫沉淀联合质谱以及酵母双杂交等技术筛选PlCYP6 候选互作蛋白,为进一步揭示PlCYP6 在淡紫紫孢菌响应盐胁迫分子机制中的功能奠定基础。
1 材料与方法
1.1 材料
用于试验的淡紫紫孢菌菌株36-1、Pl-GCYP6 和Pl-G,以及质粒pKNgR-PlCYP6、pCAMBIA1303-eGFP(改造后载体)和pCAMBIA1303-PlCYP6-eGFP 均保存于本实验室,PGADT7-T 及PGBKT7 载体购于宝日医生物技术(北京)有限公司,大肠杆菌DH5α 感受态及酵母Y2H 菌株购于宝日医生物技术(北京)有限公司。
1.2 方法
1.2.1 构建eGFP/PlCYP6-eGFP表达载体及真核表达 根 据PlCYP6(GenBank:VFPFJ_05085)的CDS 序列并使用软件Primer Premier 5.0 设计序列特异性引物“5-CAAGCACAAGCAAAGATGGCGGGATC GGCGGCCGA-3”及“5-CCCTTGCTCACCATGGGCAT TACGTCAATGTTGAGGA-3”,以载体pKNgR-PlCYP6 为模板,采用高保真酶PrimeSTAR® GXL Premix(TaKaRa)进行PCR 反应扩增PlCYP6(1 884 bp)。参照无缝克隆的方法(试剂盒TreliefTMSoSoo Cloning Kit,TSINGKE),将PlCYP6与载体pCAMBIA1303-eGFP 进行连接,并转化入大肠杆菌DH5α 菌株中。以质粒提取试剂盒AxyPrepTM Plasmid Miniprep Kit(爱思进生物技术有限公司)从DH5α 菌株中提取pCAMBIA1303-eGFP 及pCAMBIA1303-PlCYP6-eGFP 载体质粒。采用PEG-CaCl2介导的分子遗传转化方法[23]将各表达质粒转入淡紫紫孢菌菌株36-1 感受态中。主要试验步骤如下:取淡紫紫孢菌原生质体于冰上静置10 min,分别加入待转化质粒或DNA片段,使用TEC(0.01 mol/L Tris-HCl,0.001 mol/L EDTA,0.05 mol/L二水CaCl2)定容至160 μL,混匀后冰浴20 min;加入160 μL 60% PEG 3350 溶液(Sigma),室温放置15 min。加入1 mL STC 溶液(0.8 mol/L 山梨醇,0.05 mol/L 二水CaCl2,0.01 mol/L Tris-HCl),3 750×g离心6 min,去上清,使用150 μL STC 溶液重悬沉淀,涂布于PDAS 培养基上,28℃ 培养24 h。待培养基上形成菌丝时覆盖含有1.2 mg/ mL 遗传霉素G418(Amersco)的T-TOP 培养基,挑选生长于T-TOP 培养基上的菌落于新的PDA(含1.2 mg/ mL 遗传霉素G418)上。最后,提取挑选菌株的基因组DNA,采用PCR 技术使用引物“5-GCTTCCTCATCCCACTACACA-3”和“5-TTCCGCAGGTGCTTTCAA-3”分 别 扩 增eGFP和PlCYP6∷eGFP目标序列,鉴定表达eGFP和PlCYP6∷eGFP的淡紫紫孢菌目标菌株Pl-G 和Pl-GCYP6。
1.2.2 总蛋白的提取 分别将100 μL 淡紫紫孢菌菌株Pl-GCYP6 和Pl-G 分生孢子悬液(106CFU/mL)加入150 mL PDB 液体培养基,在28℃ 条件下160 r/min 震荡培养2 d。使用4 层无菌擦镜纸过滤收集菌丝,分装于2 mL 的离心管中。每管加入1 mL 1 mol/L 的NaCl 溶液,充分混匀,于28℃ 160 r/min 分别震荡培养15 min、30 min和60 min。以未进行NaCl 溶液震荡培养的相应菌株菌丝为对照。收集各菌丝样品立即进行液氮速冻和充分研磨。将各研磨后的菌丝组织(约1 g)收集于10 mL 的离心管中,加入3 mL RIPA 强裂解液(碧云天生物技术有限公司)及30 μL PMSF(Sigma)。使用振荡器充分混匀,于冰上静置2 h。4℃,12 000×g离心30 min,取上清液。将不同处理时间的总蛋白溶液等比例混合后立即用于免疫沉淀试验。
1.2.3 免疫沉淀 分别取1.2.2 中提取的Pl-GCYP6 和Pl-G总蛋白溶液各4 mL 于10 mL 离心管中,加入5 μg Anti-eGFP Antibody 抗体,使用垂直混合仪于4℃ 条件下40 r/min 孵育过夜。加入1/20 体积的Protein A /G 琼脂糖珠(碧云天生物技术有限公司),继续孵育4 h。1 000×g离心30 s,收集沉淀及上清液。加入1 mL PBS 缓冲液,1 000×g离心30 s,分别收集Protein A /G 琼脂糖珠沉淀及上清液,重复上述离心操作5 次。加入200 μL 1 × loading buffer,沸水浴10 min。取40 μL 用于Western blot 检测,剩余样品送华大基因公司进行蛋白质谱分析。
1.2.4 Western blot 检测 总蛋白溶液或免疫沉淀产物经SDS-PAGE 电泳后电转(30 V,50 min)至硝酸纤维素膜上,使用5% 的脱脂牛奶封闭过夜。加入一抗Anti-eGFP Antibody(1∶2 000),37℃ 孵育1 h,使用TBST 清洗3 次,每次10 min。加入羊抗鼠IgG(1∶200)二抗,37℃孵育1 h,使用TBST 清洗3 次。加入1 mL 显色液ClarityTM Western ECL Substrate(BIO-RAD公司),进行显色并成像。
1.2.5 LC-MS /MS 质谱分析及生物信息学分析 将1.2.3 中免疫沉淀后的蛋白液使用SDS-PAGE 凝胶电泳技术进行分离,切取胶片使用蛋白酶解后除盐、冷冻抽干。将抽干的肽段样品用流动相A(2% CAN,0.1% FA)复溶,20 000×g离心10 min 后,取上清液进样。样品采用Thermo 公司的MLtiMate 3000 UHPLC 进行分离。纳升液相分离末端直接连接质谱仪。经过液相分离的肽段经nanoESI 源离子化后进入到串联质谱仪Q-Exactive HF X(ThermoFisher Scientific,San Jose,CA)进行DDA(Data Dependent Acquisition)模式检测。采用Mascot v2.3.02 软件进行数据处理,数据库为UniProt 蛋白数据库及基于基因组注释的蛋白数据库。使用Percolator 软件对搜索结果预处理并重新打分,并对输出的结果过滤(PSM-level FDR <= 0.01),分别计算每个蛋白的iBAQ 值。基于GO 数据库(http://www.geneontology.org)及KEGG 数 据 库(https://www.genome.jp/kegg/)进行蛋白功能富集分析。
1.2.6 酵母双杂交 依次加入5 μL carrier DNA(TaKaRa)及2种预转化质粒各100 ng 于50 μL 酵母感受态中,混匀后加入500 μL PEG/LiAC(100 μL 50% PEG 3350,100 μL 10 × TE 及 0.1 mol/l LiAC),30℃ 孵育30 min。加入20 μL DMSO,42℃ 水浴15 min。1 000 r/min 离心15 s,使用YPD plus 重悬。1 000 r/min 离心15 s,使用1 mL 0.9% NaCl 重悬。1 000 r/min 离心15 s,使用100 μL 0.9% NaCl 重悬,随后涂布于SD/-Leu/-Trp 酵母缺陷培养基(二缺)(TaKaRa),于含有500 μg/mL Aureobasidin A 及20 mg/mL X-α-Gal 的SD/-Ade/-His/-Leu/-Trp 酵母缺陷培养基(四缺)检测蛋白互作情况。
1.2.7 实时荧光定量PCR 接种100 μL 浓度为1×106CFU/mL 淡紫紫孢菌野生型菌株于150 mL PDB 中培养1 d后使用四层无菌擦镜纸收集菌丝,使用无菌水及1 mol/L NaCl 分别处理菌丝60 min 后提取RNA,制备cDNA 作为模板进行实时荧光定量PCR(qRT-PCR),具体试验步骤参照试剂盒说明书(SsoFastTM EvaGreen Supermix(Bio-Rad,Hercules,CA,USA)),使用Bio-Rad CFX 96 Real Time System 进行反应,反应程序为:94℃ 20 s;94℃ 10 s,60℃ 20 s,45 个循环,以Actin(GenBank:VFPBJ_07912) 作为内参进行校正,使用引物“5-CTGCTGGGTCC- ATCAGAAAG-3”“5-CGAGACAACGCAGTCAAAT- G-3”及引物“5-GCCCTCTGTCCTGGGTCTT-3”“5- ACAGGGAGGCGAGAATGGA-3”,采用2-△△CT分别测定PlCYP6及ADH1基因相对表达量,各试验重复3 次。
2 结果
2.1 获得异源表达eGFP和PlCYP6-eGFP的淡紫紫孢菌菌株
经过遗传霉素G418 的筛选,获得异源表达eGFP和PlCYP6-eGFP的淡紫紫孢菌菌株Pl-G 和Pl-GCYP6。菌丝绿色荧光检测结果显示,在Pl-G 和Pl-GCYP6 菌丝中均可见来自eGFP 的绿色荧光信号,而在淡紫紫孢菌野生型菌丝中无绿色荧光信号(图1-A)。同时,PCR 检测结果显示在Pl-G 和Pl-GCYP6 基因组DNA 中均可检测到异源表达质粒的目标序列(图1-B)。此外,Western blot 检测结果显示在Pl-G 和Pl-GCYP6 的总蛋白中可分别检测到eGFP (约25 kD)和PlCYP6-eGFP(约100 kD)(图1-C)。上述试验结果表明,Pl-G 和Pl-GCYP6 分别为异源表达eGFP和PlCYP6-eGFP的淡紫紫孢菌菌株。
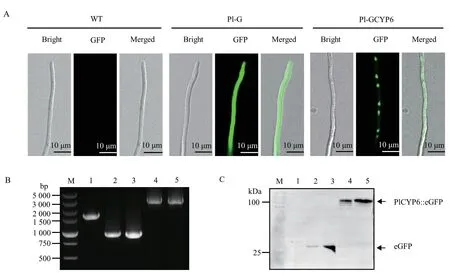
图1 eGFP及PlCYP6∷eGFP在淡紫紫孢菌中的异源表达Fig.1 Heterologous expressions of eGFP and PlCYP6∷eGFP in P. lilacinum
2.2 PlCYP6特异钓取482个淡紫紫孢菌蛋白,推测其功能涉及细胞代谢
SDS-PAGE 凝胶电泳结果显示,从菌株Pl-G 和Pl-GCYP6 中提取的总蛋白条带明亮且清晰(图2-A),这表明各试验组总蛋白提取质量好。免疫沉淀产物经过PBS 清洗后去除了大量的非特异性条带(图2-A)。Western blot 检测结果显示,eGFP 抗体成功靶标到蛋白eGFP 及PlCYP6∷eGFP(图2-B)。这表明上述来自菌株Pl-G 和Pl-GCYP6 的免疫沉淀产物分别包含了eGFP 及PlCYP6∷eGFP。蛋白质谱分析结果表明,在来自Pl-G 和Pl-GCYP6 的免疫沉淀产物中分别鉴定到629 个和1 033 个蛋白,其中482 个为在Pl-GCYP6 菌株中特异钓取蛋白(图3)。GO 功能注释结果表明,此482 个蛋白主要富集在催化酶活性和结合等分子功能条目,以及细胞过程和代谢过程等生物学过程条目(图4-A)。KEGG pathway 分析表明,上述482 个蛋白主要富集在转运和代谢途径,且以碳水化合物、氨基酸和能量代谢为主(图4-B)。依据上述结果推测,PlCYP6 互作蛋白的功能主要涉及细胞代谢。
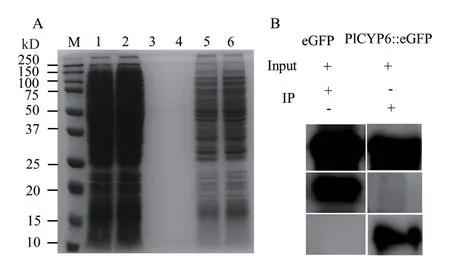
图2 免疫沉淀钓取PlCYP6互作蛋白Fig.2 Immunoprecipitation to catch interacting proteins of PlCYP6
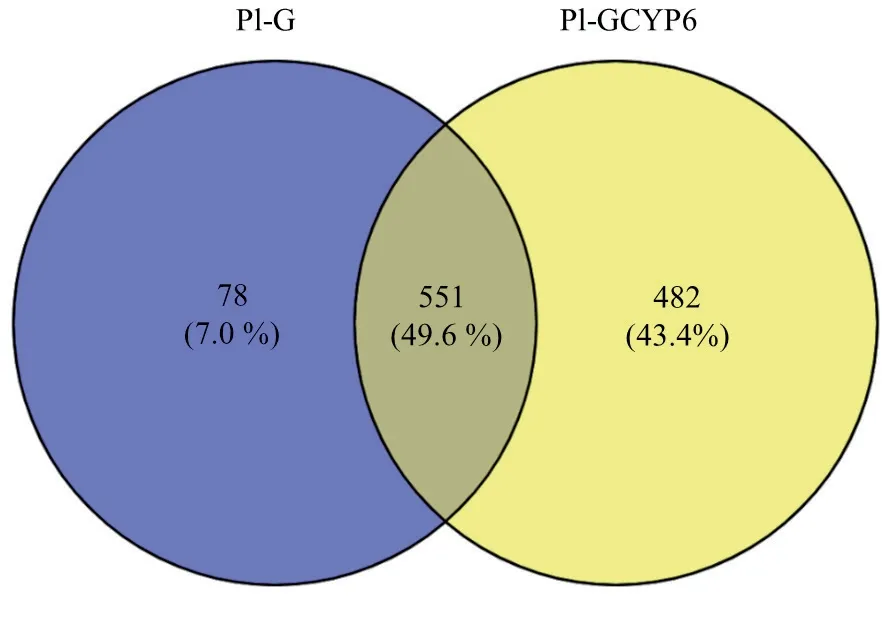
图3 差异蛋白的分布Fig.3 Distribution of differential proteins

图4 候选互作蛋白的GO 功能注释及KEGG pathway 分析Fig.4 GO function annotation and KEGG pathway analysis of candidate interacting proteins
2.3 乙醇脱氢酶1为PlCYP6的候选互作蛋白
根据质谱分析结果从上述482 个蛋白中挑选了蛋白相对丰度最高的两个蛋白乙醇脱氢酶1(alcohol dehydrogenase 1,ADH1,GenBank:VFPBJ_05915)和延伸因子2(elongation factor 2,EF2,GenBank:PCL_12959)进行酵母双杂交分析。试验结果表明,AD 与BD-PlCYP6 及截短后的氨基酸区段均不存在自激活现象(图5-A,B),因此,PGADT7-T(AD)及PGBKT7(BD)载体可以用于酵母双杂交分析。酵母双杂交结果表明PlCYP6 可以与ADH1 发生直接互作(图5-C),但不与EF2 直接互作(数据未展示)。此 外,PlCYP6 片 段PlCYP6(67-160)和PlCYP6(161-471)可以分别与ADH1 直接互作(图5-A,C),其中PlCYP6(67-160)氨基酸区段为PlCYP6 的WD40 repeat 结构域区域(图5-A)。采用qRT-PCR 技术分析了NaCl 胁迫对淡紫紫孢菌中PlCYP6及ADH1表达的影响。试验结果显示,与未进行NaCl 胁迫处理的淡紫紫孢菌相比,使用1 mol/L 的NaCl 胁迫处理60 min后,淡紫紫孢菌中PlCYP6和ADH1均被诱导表达,相对表达量均约为3.5 倍(图6)。据此推测PlCYP6和ADH1同时参与了淡紫紫孢菌的盐胁迫应激反应,这进一步佐证了PlCYP6 与ADH1 互作的可能性。
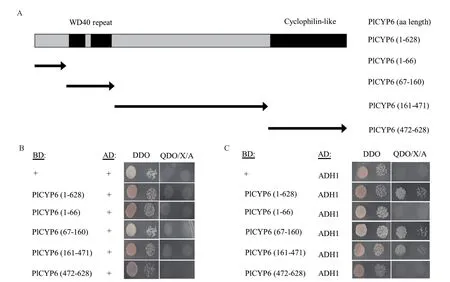
图5 酵母双杂交验证PlCYP6与ADH1蛋白的互作关系Fig.5 Interaction relationship between PlCYP6 and ADH1 protein by yeast two-hybrid
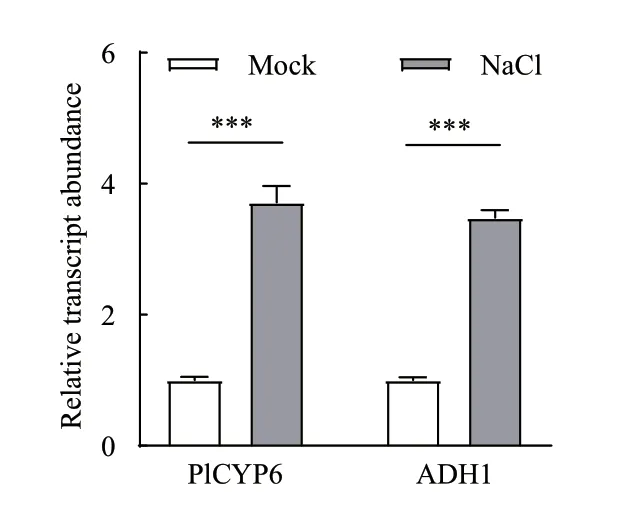
图6 PlCYP6 与ADH1 在盐胁迫中的基因表达量分析Fig.6 Analysis of the gene expression levels of PlCYP6 and ADH1 under salt stress
3 讨论
蛋白间互作是生命体生长发育及响应外界信号等各类生物学过程的基础[24]。因此,互作蛋白筛选鉴定可为阐述靶标蛋白生物学功能提供重要的数据。免疫沉淀联合质谱分析是一种具有适应性广泛、高灵敏性特点的蛋白互作研究方法,它已成功被应用于研究哺乳动物、植物及病毒等生物的各种蛋白过程中,可进行多种类型互作蛋白的筛选如转录因子、细胞核蛋白、细胞质蛋白及细胞膜蛋白等[4-6,25-26]。
在本研究中,我们在淡紫紫孢菌中采用了基于免疫沉淀联合质谱分析技术筛选特定环境条件下的互作蛋白研究体系。通过在淡紫紫孢菌中异源表达靶标蛋白PlCYP6 的融合蛋白编码基因PlCYP6∷eGFP,并以eGFP 标签抗体替代PlCYP6 抗体进行免疫沉淀,从PlCYP6∷eGFP超表达菌株总蛋白中钓取PlCYP6 互作蛋白。与传统的免疫沉淀联合质谱分析筛选互作蛋白相比[3],该方法无需制备PlCYP6 蛋白抗体,这极大地缩短了互作蛋白筛选周期。同时,本研究所采用的eGFP 标签抗体蛋白具有以下优点:适应性广,可以与不同的目标蛋白进行融合表达;可供选择的标签抗体蛋白种类多,可以使用myc、his 和flag 等标签抗体蛋白替代eGFP 标签抗体蛋白,如Li 等[4]使用flag-IP 筛选HEK293 细胞中的RBM45 特异性相互作用的蛋白质;标签抗体容易获得且特异性和稳定性好,可大幅提高捕获互作蛋白的特异性[27]。
质谱分析结果中含有丰富的潜在相互作用体成分,同时也含有大量的背景蛋白质,如对照组中,大量的核糖体蛋白被捕获。这些背景蛋白往往给验证与目标蛋白真正发生互作的蛋白质带来困难。可以采取以下几种办法降低背景蛋白的干扰:(1)设置对照组;(2)IP 过程中洗涤背景蛋白质;(3)根据质谱分析结果选择相对丰度高的蛋白作为候选互作蛋白[28]。本研究以异源表达eGFP的淡紫紫孢菌菌株Pl-G 为对照,以消除由eGFP 捕获的非靶标蛋白,从而筛选出受PlCYP6 特异捕获的蛋白。同时,本研究根据质谱分析结果选择蛋白相对丰度最高的2 个蛋白乙醇脱氢酶1(ADH1)和延伸因子2(EF2)进行酵母双杂交验证。试验结果表明,PlCYP6 与ADH1 存在直接互作。同时,本研究发现PlCYP6与ADH1均受NaCl 胁迫诱导表达,这进一步支持了二者间存在互作的可能性。上述研究结果表明,本研究中PlCYP6 候选互作蛋白筛选策略可行且高效。
对候选互作蛋白进行GO 功能注释及KEGG pathway 分析以研究PlCYP6 响应盐胁迫应激反应参与的调控途径。真菌通过代谢物质如脯氨酸、甘油、糖类等抵御非生物胁迫[29]。在本研究中,候选互作蛋白中大量的蛋白功能注释为“Metabolic pathways”,表明PlCYP6 可能调控淡紫紫孢菌代谢相关基因响应盐胁迫应激过程。盐胁迫应激反应产生氧胁迫,从而导致生物体内醛含量的升高[30]。ADH在生物体内依赖NADH+H+将乙醛转化为乙醇[31]。Yi等[32]报道ADH参与生物的盐胁迫调控过程。推测淡紫紫孢菌中PlCYP6 通过与ADH1 互作降低体内醛含量,进而提高淡紫紫孢菌对盐胁迫的耐受力。PlCYP6 具有一个Cyclophilin-like 结构域和WD40 repeat 结构域。其中,Cyclophilin 结构域为亲环蛋白发挥其功能的主要蛋白结构域,而WD40 repeat 结构域在真核生物中广泛存在,其参与信号转导、转录调控、免疫响应等过程[33],通常作为重要识别区域为蛋白与蛋白相互作用的提供平台[34-35]。研究结果表明PlCYP6 的结构域WD40 repeat 为其与ADH1 发生直接互作的关键区域,这与WD40 repeat 结构域已报道的功能相符。
4 结论
本研究采用免疫沉淀联合质谱技术从淡紫紫孢菌中鉴定到482 个受淡紫紫孢菌PlCYP6 特异捕获的蛋白。酵母双杂交试验证实,其中的ADH1 为PlCYP6 的候选互作蛋白,且PlCYP6 中的WD40 repeat 结构域为二者间互作的关键区域。依据这482 个蛋白的GO 和KEGG 功能注释分析结果推测PlCYP6 互作蛋白功能涉及细胞代谢,且ADH1 与PlCYP6 受NaCl 胁迫诱导表达,这与ADH1 作为PlCYP6 的候选互作蛋白结果相符。
