不同基因型腐烂茎线虫群体杂交后代分子特征比较
2021-08-22倪春辉李惠霞李文豪刘永刚徐雪芬韩变
倪春辉 李惠霞 李文豪 刘永刚 徐雪芬 韩变
(1. 甘肃农业大学植物保护学院 甘肃省农作物病虫害生物防治工程实验室,兰州 730070;2. 甘肃省农业科学院植物保护研究所,兰州 730070)
腐烂茎线虫(Ditylenchus destructor)广泛分布于温带地区:北美、欧洲、地中海(局部)、亚洲(局部),大洋洲、非洲也有少量报道,目前在中国、美国、加拿大、法国、德国和日本等25个国家均有发生和危害[1-2]。在我国,该线虫严重危害甘薯[3]、马铃薯[4-5]和当归[6]等作物,是农业上重要的一种检疫性线虫[7]。研究表明,腐烂茎线虫种内分化严重,不同来源的腐烂茎线虫在基因序列、耐寒性、致病性与形态特征等方面都存在差异,从不同寄主分离的群体虽存在致病力差异,尚不能划分出生理小种[8]。林茂松等[9]发现盐滩地区甘薯中分离的群体耐盐性明显高于低盐的内陆地区。王宏宝等[10]发现不同地理来源群体耐寒性有很大差异,部分群体可在零下70℃存活180多天。丁中等[11]发现河北地区腐烂茎线虫群体对不同药剂的抗药性存在差异,抗药性强的群体对涕灭威的抗性是敏感群体的3-4倍。王宏宝等[8]通过综合分析,提出腐烂茎线虫很可能是一个正处于快速进化过程中的复合种,或者为种内不同生物型,或者是复合种下不同生物型。目前,该线虫主要以ITS-rDNA序列差异来区分不同的基因型,对于致病型或生理小种的划分尚缺乏足够的科学依据。
宛菲等[12]发现我国甘薯腐烂茎线虫群体核糖体DNA的ITS区序列存在明显差异,可以划分为A型和B型两类;于海英等[13]发现在23个群体中,虽然A、B两个类型ITS区序列差异较大,但28S rDNA D2/D3区序列片段长度一致,序列相似度达99%,差异较小。章淑玲等[14]研究发现腐烂茎线虫ITS1-rDNA序列存在长(L)和短(S)两种不同类型,长度差异与上述A、B类型相同,且差异主要表现在ITS1区。2011年,Subbotin等[15]研究指出,已报道的腐烂茎线虫ITS-rDNA序列具有5种长度差异,且ITS1二级结构差异主要出现在H9螺旋区域。根据H9螺旋结构的有无及其差异,将70多个群体划分为A-G 7个基因型。
腐烂茎线虫种内存在明显的分化现象,本研究基于Subbotin等[15]基因型分化的研究,拟对腐烂茎线虫不同基因型群体进行杂交,探索群体间是否存在生殖隔离,群体之间基因交流是否会引发后代遗传变异,以期为该线虫群体分化及致病性变异机制的研究提供理论依据。
1 材料与方法
1.1 材料
供试线虫来源于马铃薯、当归和党参等寄主,采集自甘肃、黑龙江等地,详细信息见表1。来源于当归群体MXA2和来源于党参群体WYA4的ITS二级结构中H9螺旋结构与Subbotin等[15]总结的存在差异,当归群体ZXA1虽不具有H9螺旋结构,但与A基因型ITS1区H7/H8螺旋结构存在差异,此3个群体均不能归于A-G 7个基因型,暂定为N、H和K基因型。线虫繁殖采用以茄镰孢(Fusarium solani)平板培养物为载体和营养来源。
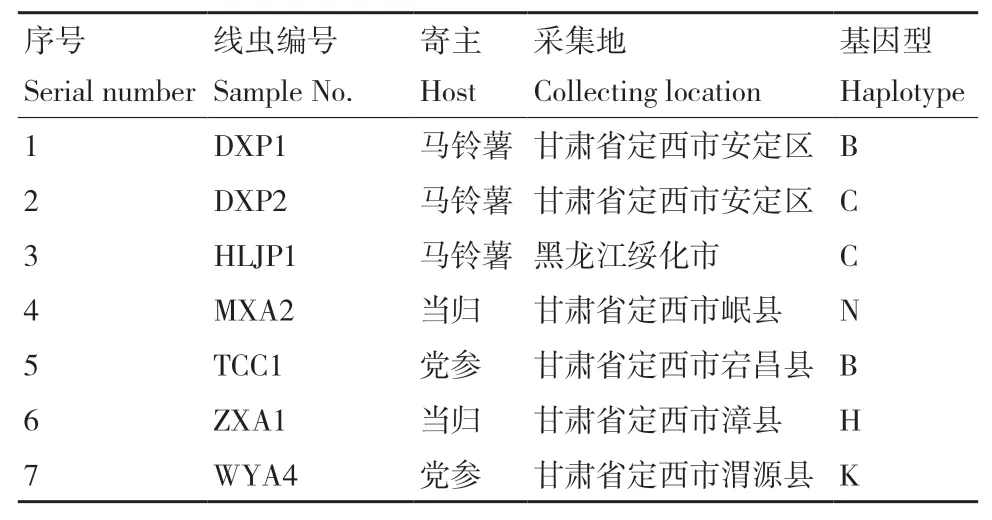
表1 供试腐烂茎线虫群体信息 Table 1 Population information of D. destructor
1.2 方法
1.2.1 腐烂茎线虫不同群体杂交组合 参照王宏宝等[16]和Webster[17]的方法,在长满菌丝的PDA斜面滴一滴无菌水(约5 μL),用自制挑针挑取1条3-4龄幼虫(母本)与另外一群体的5条雄虫(父本),置于水滴中,轻轻放置于培养箱中培养。每个处理重复20管。以群体DXP1自交为对照,试验杂交组合见表2。25℃下黑暗培养60 d后,采用改良贝曼漏斗法分离线虫,统计线虫数量,若线虫数量≤6条(亲本数量),则排除1条雌虫和全为雄虫(不统计),只统计幼虫或者≥2条雌虫。
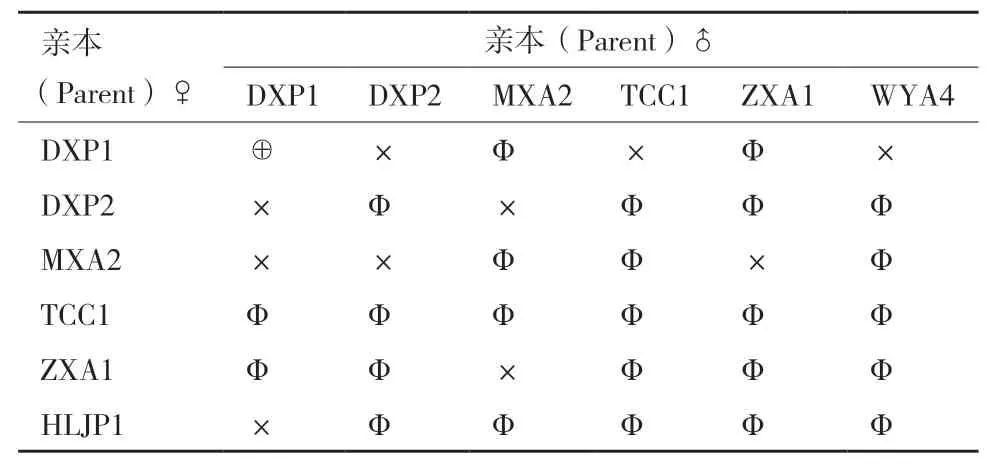
表2 腐烂茎线虫群体杂交组合Table 2 Population hybrids combinations of D. destructor
1.2.2 ITS区PCR扩增与测序 线虫DNA提取参照王江岭等[18]方法略有改动。取单条线虫于无菌水中清洗3次,挑入装有10 μL WLB的200 μL PCR反应管中,离心后浸入液氮1 min,85℃水浴2 min,重复2次,随后加入1 μL蛋白酶K(1 mg/mL),于PCR仪中65℃温育1 h,95℃下10 min使蛋白酶K失活,以14 000 r/min离心5 min,最后于4℃保存备用。
采用线虫ITS区通用引物18S:5'-TTGATTAC- GTCCCTGCCC TTT-3'、26S:5'-TTTCACTCGCCGT- TACTAAGG-3'[19]与TW81:5'-GTTTCCGTAGGTG- AACCTGC-3'、AB28:5'-ATATGCTTAAGTTCAGCGGGT-3'[20],对线虫ITS-rDNA基因进行PCR扩增。反应采用25 μL体系:上下游引物(10 μmol/L)各1 μL,2×San Taq Fast PCR Master Mix(with Blue Dye)12.5 μL(上 海 生 工),DNA模 板3 μL,ddH2O 7.5 μL。扩增程序:94℃ 4 min,94℃ 10 s,55℃ 20 s,72℃ 15 s,38个循环,72℃延伸5 min后于4℃保存备用。扩增产物经电泳检测后送往北京擎科西安分公司测序,使用软件SeqMan拼接测得的序列。
1.2.3 ITS-rDNA序列比对分析 使用软件BioEdit对引物18S/26S与TW81/AB28扩增测序得到序列的进行比对,修正并统计引物TW81/AB28扩增产物的长度。并用软件ClustalX比对分析亲本和F1代序列。参 照Subbotin等[15]方 法,用 在 线 软 件Mfold[21](http://www.unafold. org/mfold/applications/rnafoldingform.php)预测亲本和杂交后代ITS-rDNA序列的RNA二级结构,并用Varna[22]与Photoshop cc2018对结构进行美化与注释,使用软件BioEdit比对H9结构序列。
1.2.4 ITS-RFLP 参考Subbotin等[15]方法,采用DdeI、Hinf I、Tru9 I(MseI)、SduI 4种 内 切 酶,使用在线软件Wbcuter 2.0(http://www.firstmarket.com/cutter/cut2.html)分析所得序列。
1.2.5 ITS-rDNA序列系统发育分析 参照Subbtion等[15]的方法,以BI法构建系统发育树。具体方法如下,用MAFFT软件比对分析后,用DAMBE检测饱和度,用软件MrMTgui连接PAUP与MrModelTest进行模型选择,最后使用Mrbayes以最佳模型构建系统发育树,用FigTree美化发育树。
2 结果
2.1 不同来源腐烂茎线虫杂交结果
不同来源腐烂茎线虫群体11个组合生物学杂交结果显示,群体内自交处理(DXP1×DXP1)显著大于其他处理。基因型内杂交(TCC1×DXP1)与其他杂交处理无显著差异,不同基因型群体杂交9个组合的F1代数量普遍较少。每个处理的20个重复中,只有少数重复发现F1代,且线虫数量较少。B型群体DXP1自交F1代为18条/处理,其他处理线虫数量均≤6条/处理,略小于自交处理。部分处理(WYA4×DXP1;HLJP1×DXP1;MXA2×DPX2;MXA2×DPX2;DXP2×MXA2)仅发现1条/处理(表3)。

表3 腐烂茎线虫群体生物学杂交结果Table 3 Biological hybridization results of D. destructor from different sources
2.2 腐烂茎线虫杂交后代及亲本群体ITS-rDNA序列比对分析
F1代数量较少,采用单条线虫提取DNA,由于测序成功率较低,获得5个杂交组合(DXP1×DXP1;MXA2×ZXA1;DXP2×DXP1;DXP1×DXP2;TCC1×DXP1)F1代ITS-rDNA序 列,长 度 均 为915 bp(表4)。B型自交(DXP1×DXP1)F1与亲本序列相同,B型群体间杂交(TCC1×DXP1)F1与亲本也无碱基差异。其他组合的F1代均与亲本序列不同,差异主要表现在ITS1区。其中处理MXA2×ZXA1的F1代与亲本差异最大,其亲本序列相差164 bp,F1与父本MXA2(N型)序列碱基差异为38 bp,与母本ZXA1(H型)序列碱基差异为83 bp。杂交组合DXP2×DXP1、DXP1×DXP2后代与其亲本DXP2(C型)相差24个碱基,与其亲本DXP1(B型)相差1个碱基。结果表明亲本间碱基数差异越大后代群体变异越大,后代与亲本的碱基数差异越大。

表4 不同来源腐烂茎线虫杂交后代序列比对结果Table 4 Sequence alignment results of hybrid progeny of D. destructor from different sources
亲本与后代ITS1区RNA二级结构预测结果(图1)表明,ITS1二级结构比较保守,结构大致相同,差异主要表现在螺旋H9区。对螺旋H9结构和序列(图2)比对发现,群体MXA2×ZXA1杂交后代与亲本差异最大。F1代与亲本H9结构和序列均存在差异,其父本MXA2(N型)具有H9结构,母本ZXA1(H型)不具有该结构,其后代结构与DXP1(B型)相似,二者H9序列只差1个碱基。群体DXP1×DXP1、TCC1×DXP1与亲 本H9结构和序列均无差异;DXP2×DXP1、DXP1×DXP2结构与DXP2(C型)相似,序列仅仅相差一个碱基。序列比对还发现有些F1代出现了新的变异,部分碱基序列与父本和母本的都不同。
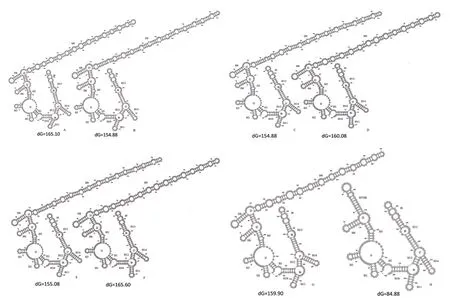
图1 不同来源腐烂茎线虫杂交后代与亲本ITS1二级结构Fig. 1 Putative secondary structures of the ITS1 hybrid progeny and parental for D. destructoer with different origin

图2 腐烂茎线虫杂交后代与亲本ITS1螺旋H9结构差异与序列比对Fig. 2 Variations and alignment of helix H9 of ITS1 between hybrid progeny and parental of D. destructor
2.3 腐烂茎线虫杂交后代及亲本群体核糖体ITSRFLP分析
腐烂茎线虫亲本和杂交后代酶切结果见表5。结果表明,供试群体序列差异主要为长度不同。供试群体可以归为两类,Ⅰ类包括MXA2×ZXA1、TCC1×DXP1、DXP1×DXP1和DXP1, 其 中TCC1×DXP1和DXP1酶切片段数量和长度完全一致,MXA2×ZXA1与其他两个组合片段数量相同,长度存在微小差异。Ⅱ类包括DXP2×DXP1、DXP1×DXP2、ZXA1、MXA2、DXP2,这些群体酶切片段数量相同,DXP2×DXP1、DXP1×DXP2和DXP2片段长度相同,与ZXA1和MXA2片段长度均有差异。这两类差异主要为内切酶SduI、Tru9I (MseI)酶切片段数量差异,Tru9I(MseI)将供试线虫序列I类群体酶切为5个片段,将II类群体酶切为4个片段;SduI将I类群体酶切为4个片段,将II类群体酶切为3个片段。
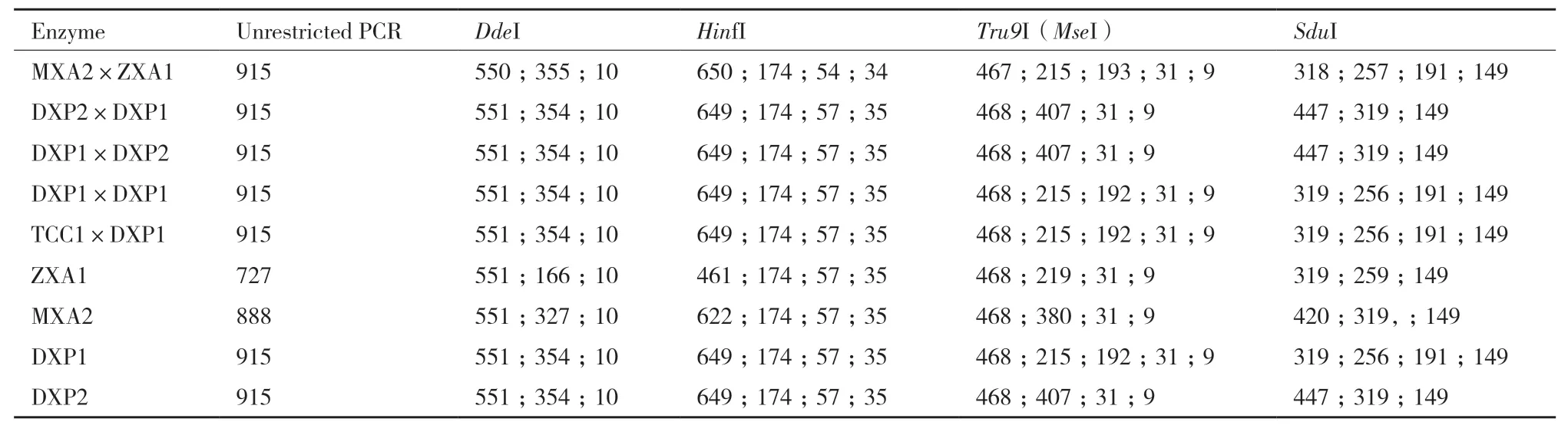
表5 腐烂茎线虫亲本和F1代酶切结果 Table 5 Parental and F1 enzyme digestion results of D. destructor
2.4 腐烂茎线虫杂交后代及亲本群体ITS-rDNA系统发育分析
以食菌茎线虫为外群,采用BI法对测得的亲本与杂交后代共9个群体ITS序列构建系统发育树(图3)。9个群体可以分为两支,DXP2、DXP1×DXP2和DXP2×DXP1聚为一支,亲缘关系较近,其中DXP2与两个F1代群体间存在一定的距离。MXA2、ZXA1、MXA2×ZXA1、TCC1×DXP1和DXP1(DXP1×DXP1)聚为一支,亲缘关系较近,其中MXA2和ZXA1与其他群体存在一定的遗传距离。4个不同来源群体杂交后代中MXA2×ZXA1的F1代、TCC1×DXP1的F1代与亲本聚在一起,DXP1×DXP2的F1代、DXP2×DXP1的F1代 与 亲本一方聚在一起。
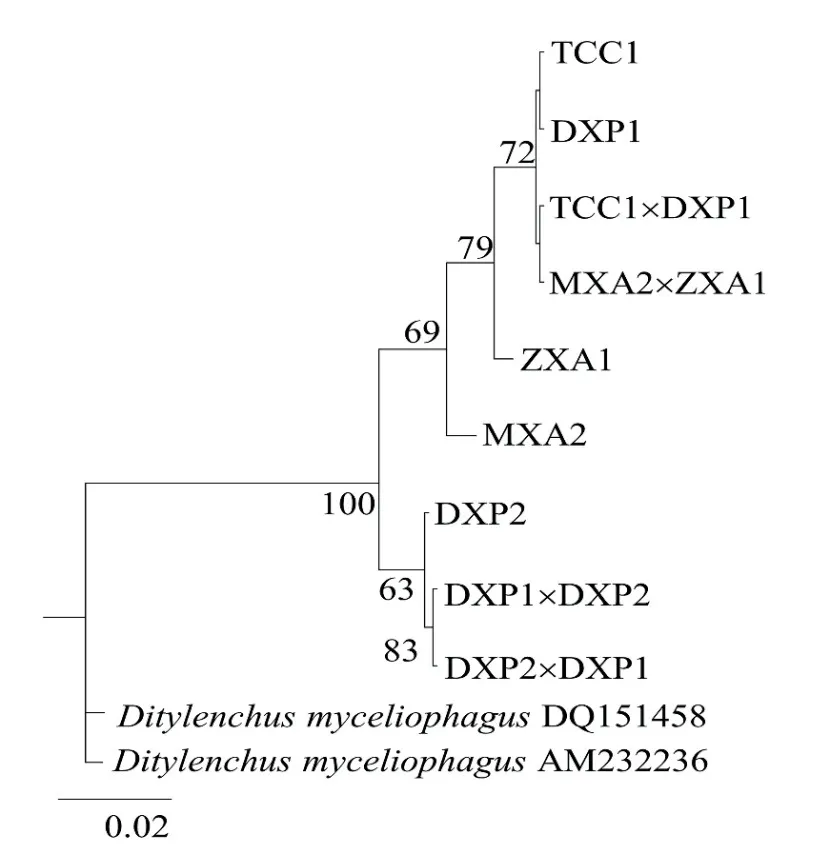
图3 基于腐烂茎线虫ITS-rDNA序列F1和亲本的贝叶斯系统发育树,最佳模型为GTR+GFig. 3 Phylogenetic tree from Bayesian analysis generated from the ITS-rRNA gene sequence dataset for D. destructor parental and F1 using the GTR+G model
3 讨论
关于不同来源腐烂茎线虫生物学杂交研究报道较少,国内只有王宏宝等[16,23-24]开展了相关研究。王宏宝等[16]选用2个不同地理来源的甘薯群体,通过薯片平板杂交、薯条离心管杂交和薯块切片打孔杂交等3种方法的对比发现,薯块切片打孔杂交法优于其他方法,平均后代数为14.33条/皿,20个处理中有6个处理发现F1代。本试验中,在线虫培养过程中,发现来源于当归和党参的腐烂茎线虫群体在甘薯很难繁殖,但所有群体均可在真菌上繁殖,故本试验采用茄镰孢菌为载体和营养来源,选取1条幼虫与5条雄虫进行杂交,以确保F1为杂交后代。由于受到试验操作、线虫自身情况以及线虫活力等因素的制约,不同亲本杂交后代数均比较少。本研究基因型内自交(DXP1)后代数量多于王宏宝等[16]结果,但杂交后代数量除TCC1×DXP1(103条/处理)较多外,其他群体均较少,推测可能是所用线虫群体差异较大所致。
Nei和Kumar等[25]研究表明,空间隔离、自然选择、基因漂变和交配机会等因子会促进种群内遗传分化,增加亚种间的遗传变异。不同地理群体间的空间隔离和基因流动的程度影响生殖隔离、遗传变异和物种形成的潜力[26-27]。黄文坤等[27]发现,腐烂茎线虫群体的遗传距离与地理距离呈正相关,遗传距离随着地理距离的增大而增大。所以,空间隔离对基因交流具有一定的阻碍作用,降低或者阻断基因交流,增强群体近缘交配程度,从而加速了种群内亚居群间的遗传分化。王宏宝等[16,23]对国内来源于甘薯的A(短)和B(长)两类基因型群体进行杂交,发现基因型内群体均能杂交成功,基因型间部分群体存在生殖隔离。酶切结果表明,杂交F1代ITS序列与亲本存在差异,并且发现同一基因型内杂交后代繁殖力和致病力与自交后代存在差异,少数杂交后代致病力和繁殖力大于自交后代,但大多数群体致病力和繁殖力小于对照[24]。
本研究基于Subbotin等[15]的基因型分类,将一些不属于A-G基因型的群体(MXA2、ZXA1和WYA4)与B基因型、C基因型进行杂交,发现B、C基因型正反交后代均接近于C基因型,N(父本)和H(母本)杂交后代与B基因较近,同一基因型内杂交后代无变异。表明不同基因型间群体杂交会产生变异,所有群体变异区域均出现在H9螺旋结构,这与Subbotin等[15]的结果一致,且杂交后代可能会产生不同于亲本的基因型。由于后代数量较少,未能对其杂交后代的形态、繁殖力和致病力变化进行分析,杂交后代基因型变化是否与其它生物学表型相关尚有待进一步探究。
本研究发现腐烂茎线虫杂交F1代数量较少,但未发现生殖隔离,表明不同来源腐烂茎线虫因空间隔离而使群体间亲和度较低。不同基因型杂交后代与亲本ITS序列出现差异,推断群体间的基因交流会加大后代变异程度,从而产生新的基因型群体。腐烂茎线虫种内分化明显,虽然本研究尚未证明基因变化与致病性相关,但王宏宝等[24]研究表明,群体杂交可能产生强致病力的群体。因此,需要加强腐烂茎线虫的检疫,以减少群体间的基因流动。
4 结论
本研究采用1条幼虫与5条雄虫组合进行杂交。结果表明,产生F1代数量普遍较少,B型群体TCC1(父本)和DXP1(母本)杂交后F1代数量为103条/处理,显著大于其他处理。B型群体DXP1自交F1数量为18条/处理,其他F1代线虫数量均≤6条/处理。由于后代数量较少,11个F1代中,只获得5个群体的ITS-rDNA序列,发现同一基因型内杂交和自交所得F1代ITS-rDNA序列与亲本无差异,不同基因型杂交所得F1代与其亲本ITSrDNA序列均存在差异。不同基因型群体间虽亲和度低,产生的F1代数量较少,但未发现生殖隔离。杂交后代的遗传变异主要出现在ITS1区H9螺旋区域,并且亲本之间差异越大,其后代与亲本之间差异也越大。
