植物源与微生物源生物制剂复配防治根结线虫病
2021-08-22舒洁张仁军梁应冲陈雅琼张娟郭建陈穗云
舒洁 张仁军 梁应冲 陈雅琼 张娟 郭建 陈穗云
(1. 云南大学生命科学学院,昆明 650091;2. 云南省作物病害生物防控技术研究中心,昆明 650091;3. 云南省烟草公司昆明市公司,昆明 650051;4. 峨山彝族自治县化念镇农业农村综合服务中心,玉溪 653202;5. 云南省烟草公司红河州公司,弥勒 652399;6. 云南大学生态与环境学院,昆明 650091)
番茄(Solanum lycopersicum)是全球重要经济作物,全世界年产量达1.7 亿t[1]。随着我国番茄种植面积逐渐扩大,番茄根结线虫(Meloidogyrnespp.)病、青枯病、早疫病等病害日趋严重[2-3],尤其根结线虫病在国内番茄种植区中普遍发生[4-5]。根结线虫是一种能侵染多种农作物的杂食性植物病原虫[4],通过在寄主植物根部细胞间隙运动使侵染部位形成大小不一的瘤状凸起,轻发时植株表现为营养不良、生长缓慢,病重时植株停止生长甚至萎蔫死亡,常见寄主植物如番茄、烟草(Nicotiana tabacum)等茄科作物[4]。目前针对根结线虫的传统防治方法有农业防治、化学防治。农业防治如深耕、轮作、培育抗性品种等[5-6],但由于根结线虫寄主范围十分广泛,且国内缺乏高抗作物品种,农业防治的效果并不理想[6]。化学防治是防治田间根结线虫病的常用手段之一,由于使植物带有农残、对环境造成污染,让线虫产生耐药性等负面效应无法消除,如“克百威”、“灭线磷”等化学药剂已陆续被禁止使用[7]。因此,近年来的研究焦点已经放在寻找安全、环保、高效的新防治方法上,如生物防治、基因工程等。
生物防治是利用植物或微生物,通过在土壤中添加植株提取液、微生物发酵液等方式达到防治线虫的目的[8-9]。用天然植物材料防治线虫的作用机理是通过抑制线虫抗氧化酶系活性、影响其神经系统兴奋传导、损伤线虫体壁和消化道等方式[9-10]。目前约有300 余种植物被研究报道具有杀线虫或使线虫致病活性,如用于防治南方根结线虫(Meloidogyne incongnita)的千里光(Senecio scandens);防治爪哇根结线虫(Meloidogyne javanica)的印楝(Azadirachta indica)等[10]。Kazuhiko等人首次发现苦参(Sophora flavescens)中提取的苦参碱具有杀线虫活性[11-12],但其杀虫作用具体靶点尚未探明[13]。印楝素因其具有广谱杀虫活性且对环境低污染的优点被广泛研究,作用机制为胃毒、触杀等,是一种较为环保安全的植物源农药[14-15]。我国利用植物源农药防治线虫的研究起步较晚,尚未找出致死线虫的关键因子。加之植物源活性物质在土壤中易降解,其应用效果不稳定的问题有待研究[16-19]。除植物源杀线剂外,微生物源制剂对根结线虫的防治也有报道。Dong等[20]研究发现淡紫拟青霉(Purpureocillium lilacinum)杀线虫的重要机制是分泌几丁质酶破坏虫体壁和卵囊壁,近年来在烟草(Nicotiana tabacum)[21]、番茄[22]、黄瓜(Cucumis sativus)[23]等作物上均有生防应用实例。穿刺巴氏杆菌(Pasteurria penetrans)、哈茨木霉菌(Trichoderma harzianum)通过侵染并寄生于根结线虫体内,通过分泌代谢产物对根结线虫J2产生毒性作用[24-27]。但是单一微生物菌剂仍然受到土壤环境条件的制约,在应用中防治效果稳定性不佳[28]。
本研究中旨在以生物防治的理念为出发点,通过分离土壤微生物筛选出抑杀根结线虫的生防菌,再将初筛有效抑杀根结线虫的生防菌发酵液和植物源杀线剂进行拮抗试验,以筛选出一种更高效的复配制剂防治根结线虫的方案。经盆栽实验初步验证复配制剂对根结线虫的防治效果,试图探索出适应绿色农业生产需求的一种新方法。
1 材料与方法
1.1 材料
南方根结线虫(M. incongnita)来源为云南省玉溪市峨山县番茄病根;供试菌株SJ5(Pseudomonas psychrotolerans)、SJ17(Chryseobacterium gleum)、SJ19(Bacillus subtilis)从云南省昆明市番茄地土壤中分离,由本实验室保存;使用番茄品种为美的1号番茄,由云南省玉溪市峨山县化念镇番茄种植合作社惠赠;盆栽土壤为泥炭基质土。
供试药剂为41.7%氟吡菌酰胺悬浮剂(拜耳公司北京分公司),20%噻唑膦水乳剂(山东大农药业有限公司),1%苦参印楝素乳油剂(云南绿戎生物产业开发股份有限公司),SJ5、SJ17、SJ19液体菌剂(云南大学发酵,有效活菌数≥3.0 亿个/mL)。试验在云南大学温室大棚于2020 年10 月-2021 年1 月进行。
1.2 方法
1.2.1 根结线虫J2的毒力测定 测试菌种接种于200 mL LB液体培养基(pH 7.4),于28℃,140 r/min进行48 h震荡培养,得到生防菌发酵液,低温条件下6 500 r/min离心3 min后,上清液经无菌滤膜(0.22 μm)除菌获得发酵上清滤液。设置5个处理,每处理5 个皿(直径35 mm),每皿20 uL根结线虫J2悬液(约100 条),每皿添加100 μg/mL利福平,20 μg/mL青霉素,50 μg/mL链霉素;超净工作台中放置12 h后统计校正死亡率,重复3次。
处理1:3 000 μL对照LB液体培养基;处理2:3 000 μL SJ5发酵滤液;处理3:3 000 μL SJ17发酵滤液;处理4:3 000 μL SJ19发酵滤液;处理5:3 000 μL苦参印楝素稀释液(1000 倍);
校正死亡率=(处理组致死率-对照组致死率)/(1-对照组致死率)×100%。
1.2.2 生防菌的分子生物学鉴定 提取生防菌基因组DNA,经PCR扩增16S rRNA基因并测序(北京擎科生物科技有限公司昆明分公司)。测序得到的序列在NCBI Blast中进行对比,于数据库(GenBank)中检索下载近源菌株序列,利用MEGAX软件进行菌株系统发育分析,用邻接法(neighbour-joining)构建系统发育树,检验自举支持率(Bootstrap)重复抽样次数为1 000,根据构建的系统发育树鉴定菌种。
1.2.3 拮抗测试 LB培养基灭菌降温至50℃后加入稀释1 000 倍的1%苦参印楝素,倒板静置。调节生防细菌菌悬液浓度为5×106CFU/mL,吸取50 μL均匀涂布在平板,再分别吸取5 μL另外两株生防菌悬液点板,封膜后置于28℃恒温箱倒置培养24 h,观察有无抑菌圈产生,有抑菌圈代表菌株不能共同生长,无抑菌圈表示两菌株相容,能共同生长。
1.2.4 盆栽试验 选择对根结线虫易感病的番茄作为盆栽材料,盆栽土使用泥炭基质土,用30 d苗龄的番茄苗进行盆栽试验,番茄苗移栽3 d后,设置7个处理,每个处理5盆,试验重复3次。
CK0:不接种线虫,不施用任何杀线虫药剂的阴性对照;CK1:每盆接种根结线虫3 000 条,不施用任何杀线虫药剂的阳性对照;T1:每盆接种根结线虫3 000 条,施用200 mL氟吡菌酰胺稀释液(1 000 倍);T2:每盆接种根结线虫3 000 条,施用200 mL噻唑膦稀释液(1 000 倍);T3:每盆接种根结线虫3 000 条,施用200 mL苦参印楝素稀释液(1 000 倍);T4:每盆接种根结线虫3 000 条,各施用20 mL三种液体菌剂,15 d后重复1次;T5:每盆接种根结线虫3 000 条,各施用20 mL三种液体菌剂,100 mL苦参印楝素稀释液(1 000 倍),15 d后重复1次。
根结线虫病级指数[19]:0 级,根系未被侵染,无根结,健康完整;1 级,有极少数根结,根结占根系体积10%以下;3 级,少量根结,根结占根系体积的11%-25%;5 级,根结明显,根结占根系体积26%-50%;7 级,根系相连,根结占全根系的51%-75%;9 级,多数主根和侧根结瘿并呈畸形,甚至腐烂,根结占全根系的75%以上。
根结指数[3]=∑(各级病株数×各级严重度)/(调查总株数×最高等级数9)×100
相对防效(%)[3]=(对照组根结指数-处理组根结指数)/对照组根结指数×100
2 结果
2.1 SJ5、SJ17、SJ19生防菌的鉴定
2.1.1 菌体形态 SJ5菌株呈粉白色,圆形,表面明 亮,微透明;SJ17菌株呈金黄色,圆形,表面明亮,不透明;SJ19菌株呈乳白色,圆形,表面明亮,不透明(图1)。
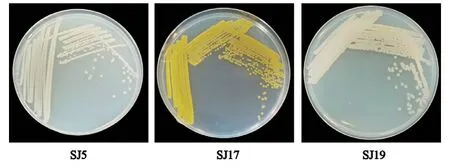
图1 SJ5、SJ17、SJ19菌体形态Fig.1 Morphology of strain SJ5,SJ17,and SJ19
2.1.2 分子生物学鉴定 根据菌株SJ5、SJ17、SJ19的16S rDNA测序序列通过NCBI进行同源性比对并检索下载近源物种序列,用标准菌株序列构建系统发育树。如图2-图4所示,菌株SJ5与耐冷假单胞菌 (Pseudomonas psychrotolerans)聚为一支,序列同源性为100%;SJ17菌株与粘金黄杆菌(Chryseobacterium gleum)聚为一支,序列同源性为100%;SJ19菌株与枯草芽孢杆菌(Bacillus subtilis)聚为一支,序列同源性为100%;因此SJ5、SJ17、SJ19分别被鉴定为耐冷假单胞菌、黏金黄杆菌、枯草芽孢杆菌。
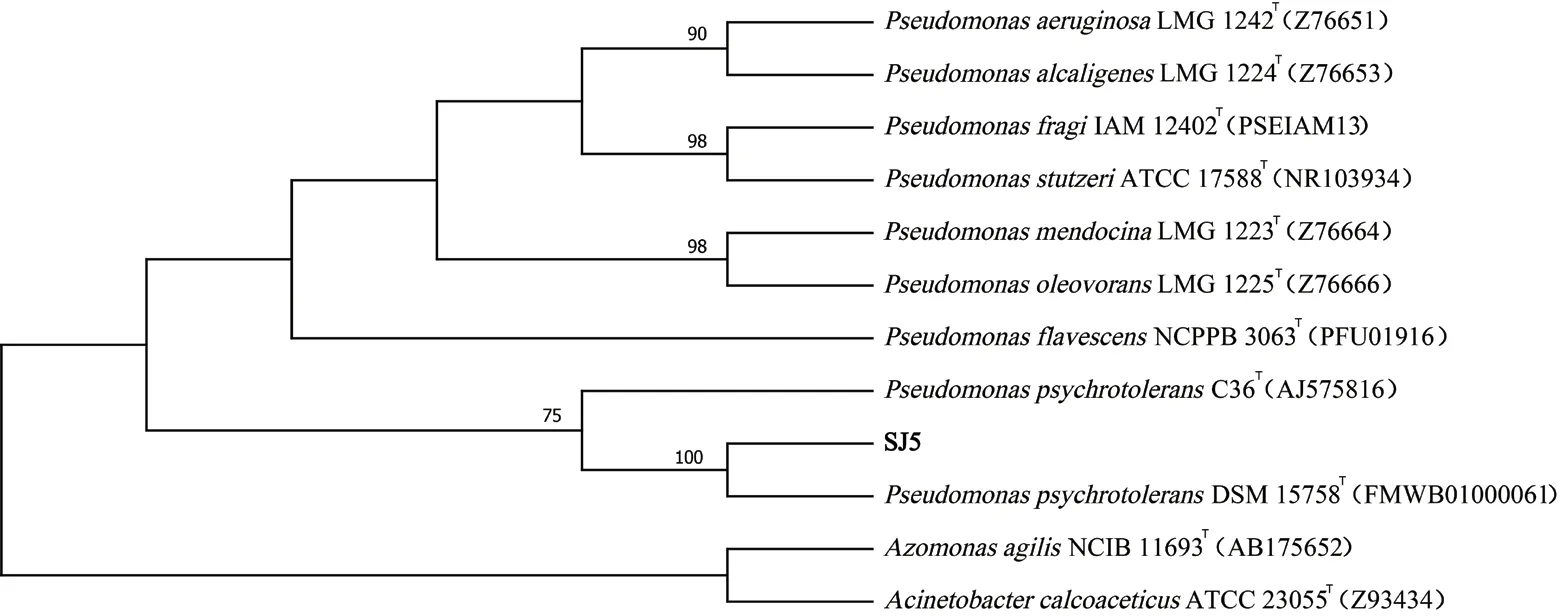
图2 菌株SJ5系统发育树Fig.2 Phylogenetic tree of SJ5
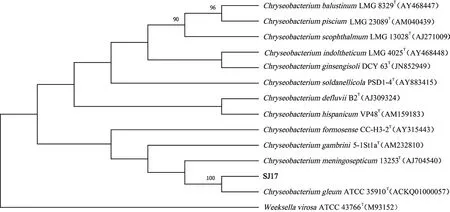
图3 菌株SJ17系统发育树Fig.3 Phylogenetic tree of SJ17

图4 菌株SJ19系统发育树Fig.4 Phylogenetic tree of SJ19
2.2 线虫J2的毒力测定
普通光学显微镜下观察统计处理12 h的J2死亡情况(图5),对照①处理后的南方根结线虫J2在12 h内无死亡现象。苦参印楝素处理12 h后线虫的校正死亡率达70.81%,而生防菌SJ5、SJ17、SJ19发酵上清滤液处理后12 h线虫大量死亡,生防菌SJ5、SJ17、SJ19对J2校正死亡率分别达89.23%、87.95%、88.97%(图6)。
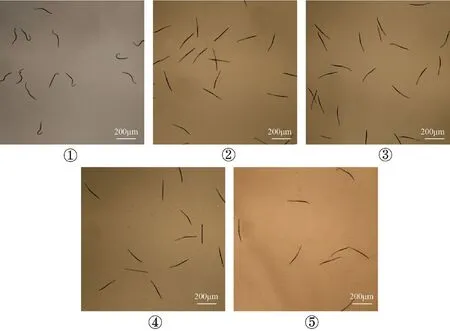
图5 显微镜下观察线虫毒力测定Fig.5 Virulence determination of nematodes under microscope
2.3 生防菌株以及生防菌与植物源制剂之间相 容性
生防菌株SJ5、SJ17、SJ19均能在含有苦参印楝素的LB培养基上生长,且共同培养的菌株之间均未产生抑菌圈(图7)。
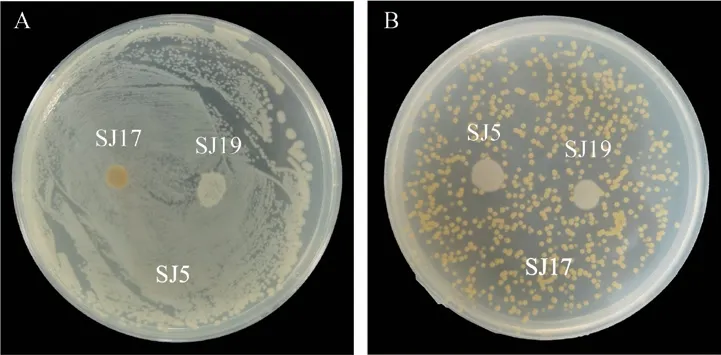
图7 相容性测定Fig.7 Compatible test results
2.4 不同处理对番茄根结线虫的防治效果
盆栽45 d后,对照组CK1被根结线虫侵害严重,根短且布满根结,处理组T5根部发育状态较好,根结数量少且不明显(图8)。不同药剂处理的番茄根结线虫根结指数与对照组相比显著降低(图9)。氟吡菌酰胺(T1)和噻唑膦(T2)处理组防治效果较高,达到71.24%和69.73%,二者无显著性差异。生防菌与苦参印楝素复配制剂处理组T5防效为67.75%,与化学药剂处理组T1、T2无显著性差异;苦参印楝素处理组T3防效最低,为46.40%。
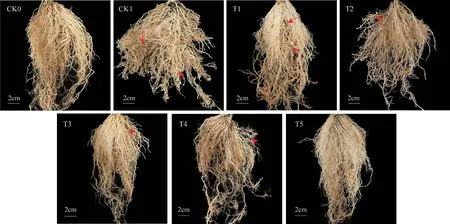
图8 不同处理对番茄根系的影响(45 d)Fig.8 Effects of different treatments on tomato root system(45 d)
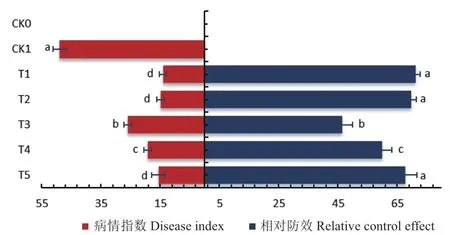
图9 不同处理对番茄根结线虫病的防治效果(45 d)Fig.9 Control effects of different treatments on tomato root-knot nematode disease(45 d)
2.5 不同处理对番茄植株长势的影响
番茄移栽后45 d,统计株高、茎围、植株鲜质量和干质量(图10)。生防菌与苦参印楝素复配制剂处理组T5株高、苗鲜重、苗干重、根鲜重与其他处理组存在显著差异,且显著高于空白处理组CK0。茎围、根干重各组无显著性差异。

图10 不同处理对番茄植株长势的影响(45 d)Fig.10 Agronomic traits of tomato plants under different treatments(45 d)
3 讨论
植物线虫病每年致全球损失至少1 570 亿美元,目前市场上的防治线虫产品仍以化学药剂为主,噻唑膦和棉隆等常见化学药剂在市场容量中占比共达73.52%[29]。化学农药的大量使用导致土壤恶化、作物产量与品质下降、病害加重,对生态环境和食品安全造成了严重威胁[30]。通过近几年“两减”战略的有力推行,2020 年底我国顺利完成化肥农药减量提效预期目标[31],进一步扩大研发安全高效、环境友好的生物制剂势必更能满足人民对绿色、高端农产品的需求。
生物防治资源开发近年来取得了较大进展,一些研究表明生防菌复合使用能够促进植物生长并提高防效[32-37]。Mendoza等[35]人研究发现无毒镰刀菌(Fusarium oxysporum)和坚强芽孢杆菌(Bacillus.firmus)联合使用可有效降低香蕉穿孔线虫(Radopholus similis)的种群密度。Siddiqui等[36]提出,与单独使用一种菌剂相比,荧光假单胞菌(Pseudomonas fluorescens)与哈茨木霉(Trichodermaharzianum)协同作用能够提高生防菌的防效。不同微生物在土壤环境中发挥不同功能,混合微生物功能更加丰富,对病害防控的效果更好[27]。生物防治手段在绿色农业生产中发挥了越来越重要的作用,然而生物防治效果不稳定是目前制约国内外生物防治应用与产业化发展的重要因素[37],主要原因是微生物对土壤环境的适应性不稳定,植物源农药相比化学药剂更易被自然环境分解,随着作物生长,药效会逐渐减弱[37]。
目前关于植物源与微生物源制剂联合防治根结线虫病鲜有报道,复配制剂防治根结线虫的机制复杂,其中必须要考虑的因素是制剂之间的相容性[38]。本研究中测试的3株生防菌与苦参印楝素共生长时未发生拮抗作用,证明本研究复配方案中选择的两种生物制剂相容性良好。复配防治按照应用方式可以分为:混合发酵、分别发酵后混合施加、分别发酵后间隔一定时间施加等[39-40]。已有研究表明微生物制剂复配时,分别发酵后混合施加的效果优于其他施用方式[41],故本研究在参考传统复配方案的基础上,本研究采用生防菌分别发酵后的发酵滤液与苦参印楝素混合施加灌根的优化复配方案,结果表明施用发酵48 h的3种生防菌滤液(发酵液中有效活菌数≥3.0 亿个/mL)与苦参印楝素稀释液(1 000 倍)复配制剂处理的防效比单独使用植物源制剂和单独使用生防菌剂的处理组分别显著提高了18.61%和7.79%。
自然环境中植物寄生线虫生防菌资源丰富[42]。本研究中的3株生防菌均分离自番茄根际土壤,更有利于应用时在土壤中定殖。Liu等[43]发现了耐冷假单胞菌具有能够提高宿主植物养分吸收并帮助宿主固氮的有益特性。Bhise等[44]研究证明粘金黄杆菌能够在盐胁迫土壤中生存,并能够促进植物生长。枯草芽孢杆菌能够产生嗜铁素,嗜铁素不仅是促生长因子,还能防治病害[45],Ramyabharathi[46]、Mazzuchelli[47]、Abd等[48]通过试验证明枯草芽孢杆菌能够用于对非洲菊(Gerbera jamesonii)、甘蔗(Saccharum officinarum)等作物根结线虫病的防控,且效果较好。本研究首次发现耐冷假单胞菌发酵滤液和粘金黄杆菌发酵滤液具有抑杀根结线虫J2的作用。盆栽试验数据表明,3株生防菌发酵滤液与苦参印楝素复配施加后在控制根结线虫病情的同时还能促进番茄植株生长,具体体现在株高、苗鲜重、苗干重、根鲜重与空白对照组相比均有显著提高。
目前生物防治根结线虫病的研究主要集中在单一菌株的防病促生作用,复配研究较少。本研究将微生物制剂与植物源制剂复配进行生物防治,初步发现复配制剂对于番茄根结线虫病防效更佳、且对番茄植株有显著促生长作用的结果,为番茄根结线虫病的防治提供了更丰富的生物资源。在番茄根结线虫病害防治中,随着人们对生物防治资源的不断挖掘和更多新型药剂的研发,化学农药减量将成必然趋势。利用微生物与植物源制剂之间的协同作用提高对番茄根结线虫病的防治效率,适应于新型药剂的开发趋势,一方面使生物防治效果更加稳定,另一方面可显著减少农药用量,具有较强的应用潜力和广阔的发展前景。目前对本研究使用的复配制剂杀虫的活性成分与大田环境下的作用时效尚不清楚,因此将杀虫机理与大田应用作为今后的研究重点。
4 结论
本研究从土壤分离出耐冷假单胞菌(P. psychrotolerans)、粘金黄杆菌(C. gleum)和枯草芽孢杆菌(B. subtilis)3株生防细菌,通过室内毒力测试显示了12 h内对根结线虫的较高毒力;采用平板抑菌圈法证明生防菌与植物源制剂之间无拮抗作用。盆栽试验初步验证,发酵48 h的3种生防菌发酵液(有效活菌数≥3.0 亿个/mL)与苦参印楝素稀释液(1 000 倍)复配制剂处理组对根结线虫病的防效达67.75%,与化学农药(氟吡菌酰胺、噻唑膦)处理组相比防效无显著性差异,且番茄株高、茎围、苗和根部的生物量均显著性增加,试验结论初步发现复配方案具有防治番茄根结线虫病害应用潜力。
