基因组选择背景下奶牛体外受精的40 年
2021-08-18蔡高占张汝美王亚琴黄国锋李俊婷刘小涛姚文龙李建斌仲跻峰
蔡高占,张汝美,王亚琴,黄国锋,李俊婷,刘小涛,姚文龙,周 浩,李建斌,仲跻峰*
1 山东省农业科学院畜牧兽医研究所,山东济南 250100
2 宁波市农业村局,浙江宁波 315033
3 余姚市陆埠镇农业农村办公室,浙江余姚 315420
4 宁波市鄞州区农业农村局,浙江宁波 315100
5 宁波市牛奶集团有限公司,浙江宁波 315033
6 宁波市鄞州瞻岐鹰山牛场,浙江宁波 315100
0 引言
人类第一个试管婴儿诞生于40 年前,该技术后来应用于奶牛等其他物种。最初,对奶牛进行IVF也是用于不孕症的治疗。尽管IVF技术在治疗病理性不孕上取得一些成功,但该方法的发展和应用主要集中在改善遗传选择和减少世代间隔方面。这些方法的商业应用得益于40 年的研究,主要是用屠宰场获得的卵母细胞和冷冻精液(精子),形成了一个非常强大的模型,可用于奶牛和人类的临床应用。目前针对不同物种的IVF已经发表了几篇优秀的综述,主要集中在技术的早期阶段、奶牛产业方面的应用以及奶牛使用IVF技术的相关问题[1]。本文总结了过去40 年奶牛IVF的重要步骤、存在的误区以及取得的进展(图1)。
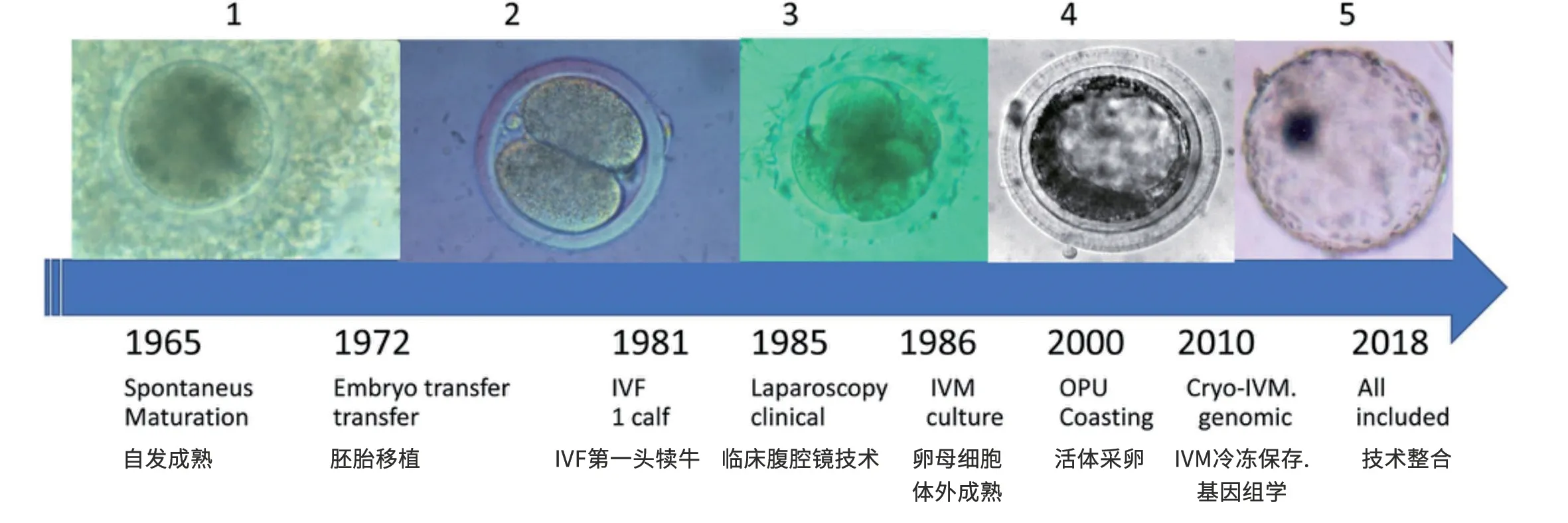
图1 奶牛IVF发展史
1 最初的挑战(1980—1990年)
尽管生殖生物学家从20世纪50年代开始对啮齿类动物进行IVF试验,但1978年世界首例试管婴儿Louise Brown的诞生还是引起了人们极大兴趣,同时也加大了对奶牛等其他大型哺乳动物IVF的研究力度。Robert Edwards[2]在一篇文章中对20世纪促进IVF发展的杰出工作进行了详细的回顾,他是60年代观察奶牛和其他哺乳动物未成熟卵母细胞的先驱,并因对IVF发展做出的贡献于2010年获得诺贝尔生理医学奖。
因为人类第一个试管婴儿出生的程序方案中涉及到成熟卵子的回收,所以最初的努力也集中在通过剖腹手术和腹腔镜从奶牛身上获得成熟卵子。Benjamin Brackett小组[3]通过腹中部手术来获得卵母细胞并将胚胎移植到输卵管中,成功培育出了世界上第一个试管犊牛。用腹腔镜回收卵母细胞,然后将兔子输卵管中孵育7 天后的囊胚转移到子宫,这一研究花了4 年多的时间。使用腹腔镜回收卵母细胞为使用IVF治疗不孕症提供了可能,并为该技术在临床上的应用开辟了道路。
最初的(1980—1990年)10 年里,腹腔镜是临床应用IVF治疗奶牛不孕的首选技术,后来被超声所取代。肝素对奶牛精子体外获能具有刺激作用,有助于提高受精率和成功率[4],这也部分解释了腹腔镜回收卵母细胞会取得巨大成功的原因,因为在奶牛上使用的是60 cm腹腔镜,为了防止卵母细胞在腹腔镜中凝结,需要在针状冲洗液中使用抗凝剂。肝素作用的发现是偶然的,直到两年后当John Parrish[5]发表研究成果时,人们才明白这一点。肝素虽然不是真正存在于输卵管中,但可以模仿一些卵泡液成分,比如蛋白多糖。而在卵母细胞方面的挑战是寻找最佳培养条件,Robert Edwards[6]已经证明了卵母细胞在体外能够自动恢复减数分裂。事实上,大多数实验室仍使用Neal First实验室开发的添加有血清、促卵泡激素(FSH)和雌二醇的TCM-199进行卵母细胞体外成熟(In Vitro Maturation,IVM),用Tyrode-Lactate培养基进行精子洗涤和精子/卵子共孵育。而胚胎培养基在起初的10 年里被改进过多次,至今仍然在持续改善,其挑战是,胚胎在输卵管中发育的最初几天以及胚胎代谢对基因组激活前后过渡的适应。事实上,奶牛IVF的最初成功是通过胚胎在家兔或绵羊输卵管中的短暂孵化而获得的。最终,输卵管细胞的共培养取代输卵管的孵育是奶牛胚胎通过8-细胞阻滞的要求。因此,在从单细胞胚胎到囊胚的发育过程中,培养基的组成在胚胎基因组激活时发生了改变,这是一种与人类一样的顺序和方法,在这一过程中,培养基的组成发生了2~3 次改变[7]。理想培养基最优组分的逐步完善始于对输卵管环境的分析和合成输卵管液(SOF)的制备(SOF被迅速采用),补充血清或牛血清白蛋白(BSA),最终还是补充了特定的氨基酸,使单细胞胚胎能够在合成或半合成BSA培养基条件下发育到囊胚。尽管在血清存在的情况下,单一培养取得了一些成功,但仍然令人困惑的是,在某种程度上奶牛的独特之处在于对群体培养的要求。虽然一些机械条件诸如微流体、非常小的培养液滴或使用微井方法来减少自分泌因子的分散,但这些因子还没有被确认。
2 IVM的成就(1990—2000年)
因为极少有关于用活体卵母细胞进行IVF的报道,所以使用屠宰场的卵巢获得卵母细胞,成为一个非常活跃的研究领域。众所周知,卵母细胞成熟过程与卵泡不同,后者比前者更容易在体外繁殖。爱尔兰的I.Gordon团队[8]和美国Neal First[9]在测试卵母细胞的培养条件方面是最活跃的。在大多数培养条件下,卵母细胞的核成熟是完全自动的;24 h内,II期卵母细胞的成熟率超过85%。因此,早在20世纪80年代末,利用屠宰场材料,一次试验获得数百个胚胎是完全有可能的。
与其他物种相比,奶牛和猪的卵母细胞来源几乎是不受限制的,这有助于开发更好的技术和培养条件。其他物种的进展就比较慢,如马或者宠物;马IVF仍然受到精子不能在体外受精而需要向卵母细胞中注射精子的限制[10];而宠物IVF的成功率也受到季节和宠物自身生理特性的影响。
在使用屠宰场卵母细胞生产胚胎时,发现不同的培养基会影响后代的表型。最初,在绵羊身上观察到大量后代综合症,后来在奶牛上,发现还与受精后培养基中的血清有关。该现象在本质上是表观遗传,当胚胎通过克隆产生时,无论是与无核卵母细胞融合的囊胚还是与体细胞核融合的囊胚,该现象都会加剧。这种表型的发生率在现在也很难估计,随着妊娠期的延长,可能是轻微的,也可能是极端的,比如伴有小牛体重异常和胎盘异常造成的死胎。在巴西的一次大型手术中,通过超声引导抽吸卵巢获得卵母细胞,而无需激素刺激供体;最近一项基于15 000 个新生犊牛(人工授精作为对照组)的调查显示,IVF的小牛出生体重平均增加了1 kg。
多年来,人们一直怀疑合成的培养基是否是限制卵母细胞发育能力的主要原因,尽管合成培养基可以一直培养到囊胚期。事实上,1990—2000年,除了引进新型孵化器、降低氧分压外,还添加了数百种不同的产品、细胞因子、生长因子、抗氧化剂,但卵母细胞发育到囊胚期的平均成功率一直在30%~40%。这些条件中很少有经过体内转移测试的。
奶牛屠宰时,从其卵巢中抽取所有卵泡获得的卵母细胞-卵丘复合体的形态变化很大,在奶牛体内,卵泡主要在FSH的影响下呈波浪状生长。21 天的发情周期可包括有2~3 个生长波,每个生长波都可形成1 个9 mm以上的优势卵泡。当FSH开始升高时,最大的卵泡可能成为优势卵泡,而较小的卵泡将在FSH的作用下生长几天,然后随着FSH水平下降而开始闭锁过程。这种现象从青春期到死亡,甚至在怀孕期间都有发生。因此,如果在屠宰时随机采集卵巢,大多数卵泡将在3~9 mm之间,并且它们含有可用于IVM-IVF的卵母细胞群。从8 mm卵泡开始,尺寸的影响变得更加重要;但即使卵母细胞来自更大的卵泡,也不能保证成功。由于闭锁过程是渐进的并且需要时间,所以在FSH降低时,卵巢中大约1/3的卵泡将处于FSH依赖生长阶段,1/3将处于平台阶段,另外1/3将在闭锁阶段[11]。这种情况反映在从这些卵泡中恢复的卵丘-卵母细胞复合体的形态上,并与结果部分相关。一个非常致密和明亮的卵丘表明,原始卵泡处在生长阶段或卵母细胞没有完全发育。卵丘的早期扩张与平台期有关,其结果较好,但仍远未达到100%。排卵前卵泡的卵母细胞有时表现出更高的发育潜能,但由于优势卵泡没有全部排卵,大多数在闭锁过程中消失,并且观察到质量参差不齐的现象。
3 动物预处理的改进(2000—2010年)
事实上,在卵泡生长阶段,FSH的刺激显著降低了卵母细胞的发育能力,而抽吸前2~3 天FSH的停止刺激,创造了一个促黄体生成素(LH)提供生长的窗口,使得大于9 mm的卵泡生长为具有很高发育能力的卵母细胞成为可能。随后的试验证明培养基的性能优良,卵母细胞数量合适,囊胚率可达80%以上。令人惊讶的是,在这些试验中还注意到,与屠宰后立即抽取的卵母细胞相比,卵巢在正常体温温度下运输和保存之后,抽取的卵母细胞的发育能力有所提高。这种现象与LH条件的诱导有关,与RNA分子从卵丘转移到卵母细胞有关。这些结果促进开发了一种在卵母细胞抽吸前处理奶牛的新方案。该方案是在FSH刺激下产生一批优势卵泡,并继续刺激直到大多数卵泡达到LH受体出现的阶段,然后模拟体内环境,即卵泡在没有FSH但有基础LH的情况下继续生长和分化。此时,卵泡生长模式从总颗粒细胞和卵泡膜细胞数量增加的高有丝分裂期转变为到液体体积累而膨胀的低有丝分裂期。从IVF后观察到的囊胚率来看,FSH后期与卵母细胞质量的提高有关。然而,根据这些观察结果,尚不清楚FSH在整个排卵过程中是否会保持这种能力,或者如果排卵被阻止,卵母细胞质量是否会随着卵泡进入闭锁而下降[12]。
为了进一步提高对FSH中止对卵母细胞质量影响的理解,Nivet[13]建立了一种刺激方案,以评估滑行时间对囊胚率的影响。方案具体为,6 头奶牛接受相同的刺激,接着进行4 次不同的滑行(在每头奶牛中),然后进行卵母细胞抽吸、IVF和培养。
结果显示,44 h、68 h的滑行时间产生的胚胎多于20 h;92 h滑行时间产生的胚胎少于44 h、68 h的,但结果差异不显著,说明较长的滑行时间优于较短的滑行时间。在这些试验中,一些动物产生的卵母细胞,囊胚率可达到100%。明确地表明,当卵母细胞质量优良时,培养条件并非限制因素。此外,从卵母细胞、卵丘、颗粒细胞三个部分获得组织样品,有助于了解在最终转化过程中所发生的生理变化[14]。
在一篇关于IVF的局限性的论文中,Patrick Lonergan表示,“有相当多的证据表明,原始卵泡对卵母细胞的发育潜力有显著的影响,一旦从卵泡中取出卵母细胞,其发育能力就会受到限制”[15]。因此,在卵母细胞抽吸之前的预处理卵泡仍有很大的改善可能。
4 基因组效应(2010—2020年)
该部分将讨论两个方面的基因组革命:第一,使用转录组和表观遗传学工具对IVF产生的卵泡、卵母细胞和胚胎进行基因组分析;第二,基因组选择对奶牛IVF的影响。
从IVF的早期开始,体外成熟的卵母细胞及体外产生的胚胎同体内相比外观和行为明显不同。比如,与体内胚胎相比,体外产生的胚胎植入能力差,对冷冻保存更敏感。随着基因组学工具的发展,从单个细胞到囊胚阶段分析胚胎的能力为体内和体外比较提供了一个新的角度。另外,微阵列技术或RNAseq技术可以对不同条件下培养的胚胎与体内胚胎进行对照比较。下文提到的大多数研究和所使用的条件在加拿大胚胎基因网络的网站上均有介绍。
Tesfaye通过比较体内和体外交替培养的胚胎的基因表达,分析了每个发育阶段(IVM、受精、早期卵裂、MET桑椹胚和囊胚)的基因表达情况,获得了全面的数据;结果表明,胚胎在4-细胞和桑葚胚阶段对体外条件特别敏感。然后,同一组分析了从体外和体内不同时期的不同组合中获得的囊胚的DNA甲基化,以证明随着体外时间的推移,不同甲基化区域(DMR)逐渐增加。培养条件也会影响转录组,而特定数量的糖、脂类或活性氧的存在会导致基因表达的变化和DNA甲基化[16]。这些工具显然非常敏感,但观察到的差异是可以部分预期的,因为体外环境永远不会与体内完全相似。观察到的变化是适应这种不同环境的一部分,体外生产的胚胎总是与体内生产的胚胎有所不同。
不足为奇的是,IVF对妊娠率的影响很小,尽管与人工授精或体内胚胎移植相比,体外受精胚胎会造成更多的胚胎的和胎儿的损失;最近一些出生后的表型被描述,但更多的是有性生殖的精子和受体,而不是IVF本身。
在所有研究的物种中,通过IVF获得的后代与自然受孕的后代都有些不同。《健康与疾病的发展起源》杂志最近的一期特刊报道了人工生殖技术对包括奶牛在内的许多物种的影响[17]。尽管血清效应在90年代就已经被知晓,而且到目前为止已经有数以百万计的健康犊牛和人类婴儿出生,但是表观遗传效应仍然令人担忧。这也需要进行更多的研究,以便更好地衡量、跟踪和了解对其成年后健康潜在的影响。
5 基因组选择
2010年初开始使用基因组学工具选择最有价值的个体,对特定品种进行快速修饰。虽然基因组选择的目标与表型分析相似,但在囊胚阶段获得信息的能力提高了遗传进展的速度。基因组学选择对构成下一代的动物所需特征的精确识别,使得对这种新的人工繁殖技术的需求迅速增加,用以快速选择和繁殖具有所需特征的动物。最初,选择已验证的公牛(5 年及以上)和已验证的母牛(3 年及以上)进行IVF。但现在,随着出生后不久的基因组分析,公牛的遗传价值立即被知晓,一旦精液能够生产出来,公牛就可以被选为IVF的父本供体,母牛也如此。不同的是,现在可以在性成熟前采集卵母细胞,成功率相对较高。这正在推动全球几个IVF实验室的发展。在过去的(2010—2020年)10 年里,体外受精产生的胚胎数量不断增加,继南美肉牛行业移植了数百万个胚胎之后,现在利用IVF产生的奶牛胚胎正在迅速增长。使用IVF的另一个诱因是可以在体外使用性控精液,这使得一些公牛在每批胚胎中使用更少的精液,从而使其更经济。冷冻IVF胚胎的可能性也为进行胚胎活检如进行基因组分析和选择最佳的移植组合打开了大门。突然之间,所有用于IVF过程优化的工作,都以一个非常有效的程序达到高潮,以更快地提高基因组价值。IVM、性控精液IVF、合成培养基、活检和冷冻保存,每一步都必须几乎完美的完成,才能形成一条高效的通路。由于许多步骤在技术上是复杂的,并且对操作人员或环境非常敏感,因此,其商业化进程仍有挑战。
6 IVF的未来
当然,IVF不会很快从动物选择工具箱中消失,尤其是在前面列出的优点下,比如使用性控精液和在囊胚阶段进行基因组选择。新的方法,如形态动力学、使用基因组或较小的侵入性技术(如游离DNA)进行非整倍体筛选,可能在奶牛上试用,以提高妊娠率。
此前,IVF技术有助于胚胎发育和体细胞核移植的研究,以及用于基因选择和修饰的研究等。现在,可以预见CRISPRCas-9相关技术可以同样使用IVF上,这些技术将允许精确的基因组编辑甚至表观基因组编辑。事实上,在原核阶段获得胚胎的能力对于减少镶嵌现象和提高基因组编辑的成功率十分重要[18]。
7 结论
在过去的40 年里(1980—2020年),奶牛IVF已经从一种治疗不育的试验程序演变成了许多品种的基因组加速器。在培养、冷冻保存、卵母细胞制备和实验室环境方面的进展使数百万只珍贵动物的生产成为可能。一些与某些后代的表型相关的问题仍然需要更多的研究来更好地了解体外培养7 天的影响,奶牛IVF技术已经成熟到与人类具有相似的规模,而且可能会持续几十年。
