TNRC6C-AS1和miR-129-5p对甲状腺癌细胞增殖、迁移和侵袭的影响
2021-08-07李化静任婉丽郝润梅汪世洋白艳霞
李化静,任婉丽,郝润梅,汪世洋,白艳霞,赵 谦
(西安交通大学第一附属医院耳鼻咽喉头颈外科,西安 710061;*通讯作者,E-mail:entzhao@xjtu.edu.cn)
甲状腺癌(thyroid carcinoma, TC)是最常见的内分泌肿瘤,其中包括乳头状甲状腺癌、滤泡性甲状腺癌、间变性甲状腺癌和甲状腺髓样癌;TC的发病率一直居高不下[1]。TC的发生与遗传异常和环境因素有关[2,3]。目前,常见的传统治疗方法有外科手术、放疗和化疗疗法;但由于TC易于转移,传统方法受到局限,故新型分子靶向治疗方法已成为一种有前途的治疗策略而备受关注[4]。因此,寻找潜在的靶点对于更好地治疗TC至关重要。
研究发现,lncRNA的大小范围为200 bp至100 kb的RNA分子[5]。lncRNA参与了许多基因的基因表达的表观遗传调控,并被认为是肿瘤生物学的重要组成部分[6]。研究发现,TNRC6C-AS1移码突变在胃癌和高微卫星不稳定性的大肠癌中很常见,并且在这些癌症中有超过50%观察到TNRC6C-AS1表达缺失[7]。在另一项研究中,TNRC6C-AS1被证明是食管鳞状细胞癌GAEC1癌基因的下游调控基因[8]。这些数据表明,TNRC6C-AS1表达的丧失可能是几种癌症发生的特征。但是,大多数lncRNAs在TC中的功能尚未确定。
miRNAs广泛存在于真核细胞中,其大小约为22个核苷酸[7]。miRNAs可以调控靶基因,进而调控细胞分化、生长、增殖、代谢和凋亡等基本生理过程[9]。在甲状腺癌研究领域,大量的甲状腺癌相关miRNAs被研究和鉴定[10]。其中,miR-129-5p的过表达可以促进TC细胞的凋亡,并被证明其在TC中发挥抑瘤作用[11]。Unc-5netrin受体B(unc-5 netrin receptor B,Unc5b)是netrin-1的依赖性受体,通过与netrin-1结合参与轴突迁移和血管形成,并在肿瘤抑制中发挥重要作用[12]。然而,到目前为止,Unc5b在TC中的作用尚不清楚。故本研究旨在探究lncRNA TNRC6C-AS1在TC中的生物学功能,并揭示它与miR-129-5p和Unc5b的调控关系。
1 材料和方法
1.1 材料和试剂
本研究所使用的细胞系均购自美国典型菌种保藏中心(American Type Culture Collection,ATCC,北京);RPMI-1640培养基、F12K培养基、高糖DMEM培养基、LipofectamineTM3000、TRIZOLTM试剂、PVDF膜均购自美国Invitrogen公司;miR-129-5p模拟物、miR-129-5p抑制剂和sh-Unc5b和CCK-8细胞计数试剂盒购于上海吉玛制药技术有限公司;氯仿、异丙醇、乙醇购于上海生工有限公司;DEPC水购于碧云天生物技术有限公司;PrimeScript®First Strand合成试剂盒购于日本TaKaRa公司;QuantiTect SYBR®Green RT-PCR试剂盒购于德国QIAGEN公司;RIPA细胞裂解液、RNase抑制剂购于美国Thermo Fisher公司;所有一抗和二抗均购自英国Abcam公司;双荧光素酶报告试剂盒购于美国Promega公司;Matrigel购于美国BD公司。
1.2 组织样本
收集2018年1月至2020年6月期间于本院入住的甲状腺癌患者40例,入选所有患者均经甲状腺手术后石蜡切片病理确诊,其中男性患者17例,女性患者23例,平均年龄(48.23±10.25)岁。采用AJCC第七版分化型甲状腺癌分期标准:Ⅰ期患者25例(62.5%),Ⅱ期患者2例(5%),Ⅲ期患者5例(12.5%),Ⅳ期患者8例(20%)。手术中留取40份肿瘤组织样品,以及40份邻近正常对照甲状腺组织样品。取出的组织样品立刻放入液氮中冷冻,2 h后放入-80 ℃保存。患者在手术前没有接受过化疗、放疗或其他治疗。本研究经本院伦理委员会批准。
1.3 细胞培养
本研究中所使用的细胞系包括人甲状腺癌细胞系(NPA87、KAT-5和FTC-133)和正常人甲状腺细胞系HTori3。NPA87、KAT-5、HToris3细胞和FTC-133细胞所使用的培养基为RPMI-1640培养基。所有细胞的培养条件为37 ℃、5% CO2,培养基添加10%胎牛血清(FBS)。
1.4 细胞转染
由上海生物技术有限公司合成lncRNA TNRC6C-AS1和阴性对照的干扰序列(见表1)。根据说明书,将TNRC6C-AS1-wt(AS1-wt)、TNRC6CAS1-mut(AS1-mut)、Unc5b-wt和Unc5b-mut插入到pGL3质粒中,构建重组pGL3质粒。按照以下实验分组使用LipofectamineTM3000将对应产物转染至FTC-133细胞;实验分组为AS1-wt组(转染pGL3-AS1-wt质粒)、AS1-mut组(转染pGL3-AS1-mut质粒)、Unc5b-wt组(转染pGL3-Unc5b-wt质粒)和Unc5b-mut组(转染pGL3-Unc5b-mut质粒)。

表1 引物序列
1.5 qRT-PCR检测甲状腺肿瘤组织及细胞系中TNRC6C-AS1、miR-129-5p和Unc5b的相对表达量
使用Trizol试剂裂解甲状腺癌细胞系(NPA87、KAT-5和FTC-133)及正常细胞HTori3,并以氯仿/异丙醇抽提分离RNA沉淀物;再经过乙醇沉淀,最终得到总RNA。使用RNA prep pure Tissue Kit提取甲状腺肿瘤组织中的RNA。使用PrimeScript RT合成试剂盒将1 μg RNA逆转录合成cDNA,采用SYBR®Green qRT-PCR Master Mix试剂盒进行qRT-PCR。GADPH和U6 snRNA分别作为mRNA和miRNA的内参,用2-ΔΔCt法计算TNRC6C-AS1、miR-129-5p和Unc5b的相对表达量。
1.6 蛋白质印迹检测Unc5b的蛋白表达水平
使用RIPA细胞裂解液裂解细胞;将RIPA细胞裂解液与细胞混合,使用180 W超声仪1 min(超声3 s,停顿4 s),然后将混合物在4 ℃下12 000 r/min离心10 min,收集沉淀蛋白质。提取的蛋白经SDS-PAGE分离后转移到PVDF膜上,然后使用5%脱脂牛奶封闭1 h。采用TBST缓冲液清洗PVDF膜1次,然后与一抗Unc5b(1 ∶1 000)和GADPH(1 ∶1 000)于4 ℃过夜孵育。然后用TBST缓冲液清洗PVDF膜3次,与二抗IgG-HRP(1 ∶1 000)于室温孵育1.5 h。利用谷胱甘肽脱氢酶(GAPDH)作为对照,定量检测蛋白质水平。使用ECL检测系统(Thermo Science)进行Unc5b蛋白条带的可视化。
1.7 CCK-8检测TC细胞的增殖能力
为评估转染12,24,36,48,72,96 h后TC细胞的增殖能力,将细胞接种于96孔板中培养(2×103个细胞/孔),然后用NC或sh-TNRC6C-AS1(sh-AS1组)做转染处理。按照细胞计数试剂盒-8(CCK-8)说明书方法测定细胞数量,使用酶标仪(Thermo Science)在450 nm处测量吸光度(OD)。
1.8 Transwell实验检测TC细胞的侵袭和迁移能力
本研究进行Transwell实验以分析细胞的侵袭和迁移能力。收集FTC133细胞,悬浮于无血清DMEM培养基中。将细胞接种于含或不含Matrigel(100 μl)的无血清培养基(400 μl)Transwell上室(每孔40 μl),下室充入700 μl的完整DMEM培养液作为化学诱导剂。37 ℃孵育48 h后,用棉签将上腔内未侵入的细胞取出,用4%多聚甲醛将侵入的细胞固定在下层。然后用0.1%结晶紫染色10 min,在显微镜下(德国卡尔·蔡司)拍摄并计数侵袭和迁移的细胞数。
1.9 双荧光素酶报告测定miR-129-5p与TNRC6-AS1及Unc5b的结合关系
本实验按照研究分组为:空载体组、miR-129-5p模拟物组(模拟物组)、miR-129-5p抑制剂组(抑制剂组)、sh-TNRC6C-AS1+miR-129-5p抑制剂组(sh-AS1+抑制剂组)、sh-Unc5b组和sh-TNRC6C-AS1组(sh-AS1组)。空载体组仅使用LipofectamineTM3000将空载体质粒pGL3-NC转染FTC-133细胞;模拟物组仅使用LipofectamineTM3000将空载体质粒pGL3-NC和miR-129-5p模拟物共转染FTC-133细胞;抑制剂组仅使用LipofectamineTM3000将空载体质粒pGL3-NC和miR-129-5p抑制剂共转染FTC-133细胞;sh-TNRC6C-AS1+抑制剂组使用LipofectamineTM3000将pGL3-AS1-wt质粒及干扰序列和miR-129-5p抑制剂共转染FTC-133细胞;sh-Unc5b组仅使用LipofectamineTM3000将pGL3-Unc5b-wt质粒及干扰序列共转染FTC-133细胞;sh-AS1组仅使用LipofectamineTM3000将pGL3-AS1-wt质粒及干扰序列共转染FTC-133细胞。转染48 h后,根据试剂盒说明书,通过双荧光素酶报告试剂盒测定报告基因的荧光素酶活性。
1.10 数据分析
采用SPSS18.0统计软件进行统计分析。所有实验重复3次,数据用平均值±标准差表示。采用t检验比较两组间正态分布数据,采用单因素方差分析比较多组数据,对非正态分布数据进行Kruskal Wallis检验。P<0.05为差异有统计学意义。
2 结果
2.1 TNRC6C-AS1基因敲除抑制TC细胞的增殖、迁移和侵袭
与甲状腺癌旁正常组织相比,TNRC6C-AS1在甲状腺肿瘤组织中的表达明显升高(P<0.01,见图1)。与正常甲状腺上皮细胞HTori3相比,TNRC6CAS1在TC细胞(NPA87、KAT-5和FTC-133)中的表达水平也显著升高(P<0.05,见图1)。在FTC-133细胞中,与对照组相比,sh-AS1组中TNRC6C-AS1表达水平显著下调(P<0.01,见图1),FTC-133细胞的增殖、迁移和侵袭能力显著降低(P<0.01,见图2)。

与正常组织比较,**P<0.01;与HTori3细胞比较,#P<0.05,###P<0.001;与空载体组比较,△△△P<0.001图1 TNRC6C-AS1在组织和细胞中表达情况Figure 1 The expression of TNRC6C-AS1 in tissues and cells
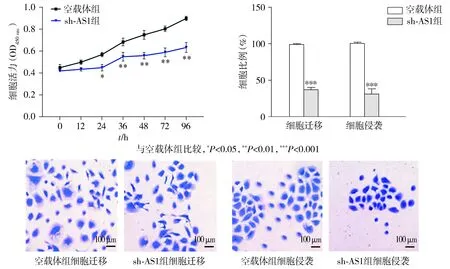
图2 TNRC6C-AS1表达下调抑制FTC133细胞增殖、迁移和侵袭Figure 2 The downregulation of TNRC6C-AS1 expression inhibited the proliferation, migration and invasion of FTC133 cells
2.2 在TC细胞中miR-129-5p与TNRC6CAS1相互作用
根据生物信息学分析,预测miR-129-5p与AS1-wt的3′-UTR结合(见图3A)。在AS1-wt组中,与空载体组相比,模拟物组中共转染FTC-133细胞的荧光素酶活性显著降低(P<0.01);而在AS1-mut组中,模拟物组与空载体组相比差异无统计学意义(P>0.05,见图3B)。与甲状腺癌旁正常组织相比,miR-129-5p在TC组织中的表达显著降低(P<0.01,见图3C);与正常甲状腺上皮细胞HTori3相比,TC细胞系NPA87、KAT-5和FTC-133中miR-129-5p相对表达量显著降低,在FTC-133细胞中差异最显著(P<0.01,见图3D)。与对照组相比,sh-AS1组FTC-133细胞中的miR-129-5p相对表达量显著升高(P<0.01,见图3E)。
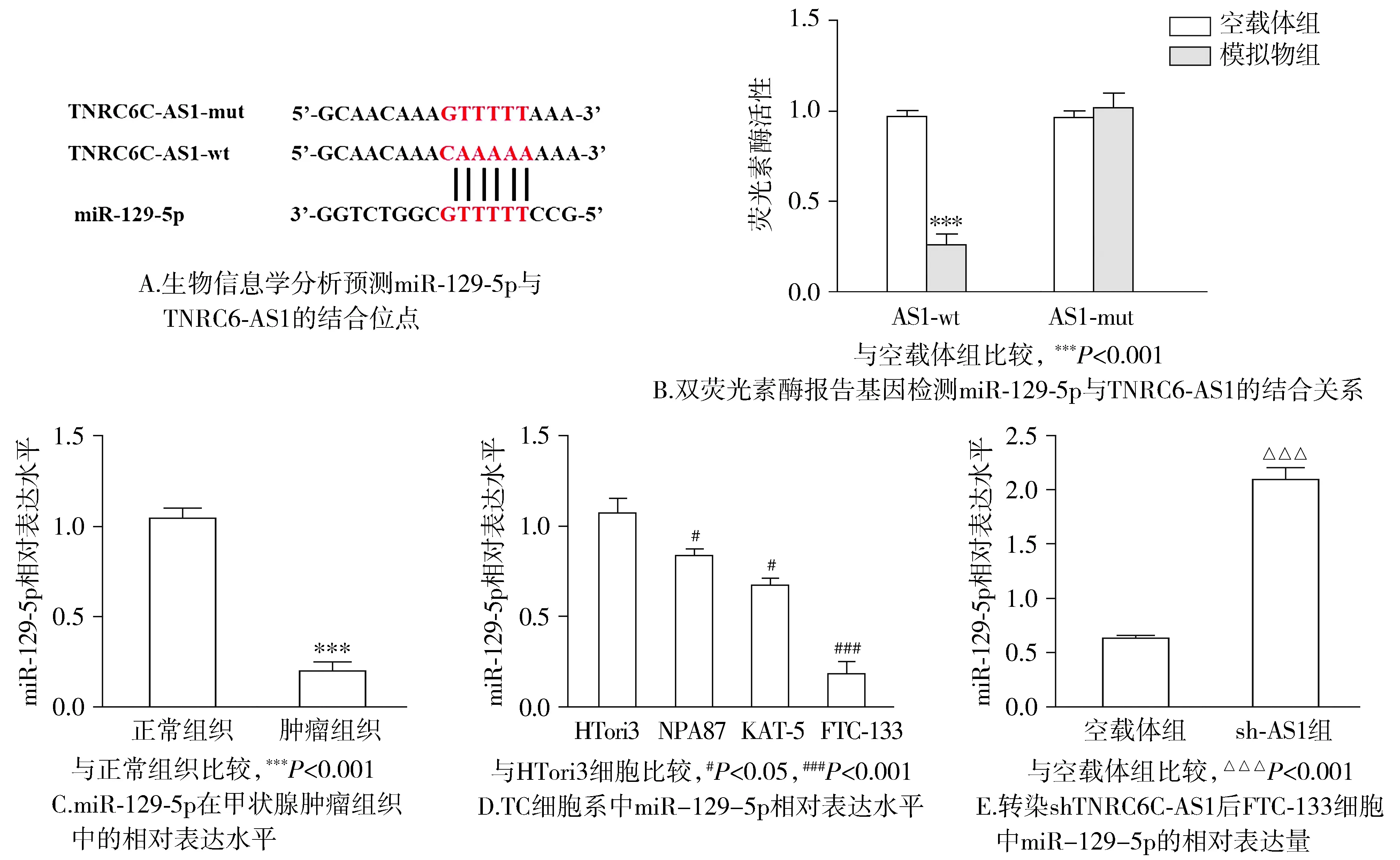
图3 miR-129-5p与TNRC6C-AS1通过直接结合而相互作用Figure 3 miR-129-5p interacts with TNRC6C-AS1 through direct binding
2.3 miR-129-5p下调促进TC细胞增殖、迁移和侵袭
在FTC-133细胞中,与空载体组相比,模拟物组中miR-129-5p的相对表达量显著升高(P<0.01);抑制剂组中miR-129-5p的相对表达量显著降低(P<0.01);sh-AS1+抑制剂组中miR-129-5p的相对表达量无显著变化(P>0.05,见图4)。与空载体组相比,模拟物组细胞增殖、迁移和侵袭能力显著下降(P<0.01);抑制剂组细胞增殖、迁移和侵袭能力显著升高(P<0.01);sh-AS1+抑制剂组的细胞增殖、迁移和侵袭能力无显著变化(P>0.05,见图4,5)。
2.4 miR-129-5p靶向调控Unc5B基因
根据生物信息学分析,预测Unc5b为miR-129-5p的靶基因(见图6A)。在Unc5b-wt中,与空载体组相比,模拟物组中共转染FTC-133细胞的荧光素酶活性显著降低(P<0.01);在Unc5b-mut中,模拟物组与空载体组相比差异无统计学意义(P>0.05,见图6B)。
与甲状腺癌旁正常组织相比,Unc5b在TC组织中的表达显著升高(P<0.01,见图7)。与正常甲状腺上皮细胞HTori3相比,TC细胞系NPA87、KAT-5和FTC-133的Unc5b的相对表达量显著升高(P<0.05,见图7)。Western blotting结果显示,与空载体组相比,模拟物组中Unc5b的相对表达量显著降低(P<0.01),抑制剂组中Unc5b的相对表达量显著升高(P<0.01),sh-AS1组中Unc5b的相对表达量显著降低(P<0.01),sh-AS1+抑制剂组中Unc5b的相对表达量差异无统计学意义(P>0.05,见图7)。与空载体组相比,sh-Unc5b组FTC-133细胞的增殖、迁移和侵袭能力显著降低(P<0.01,见图8)。
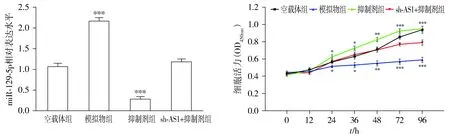
与空载体组比较,*P<0.05,**P<0.01,***P<0.001图4 下调miR-129-5p可促进FTC-133细胞的增殖Figure 4 Downregulation of miR-129-5p promotes the proliferation of FTC-133 cells
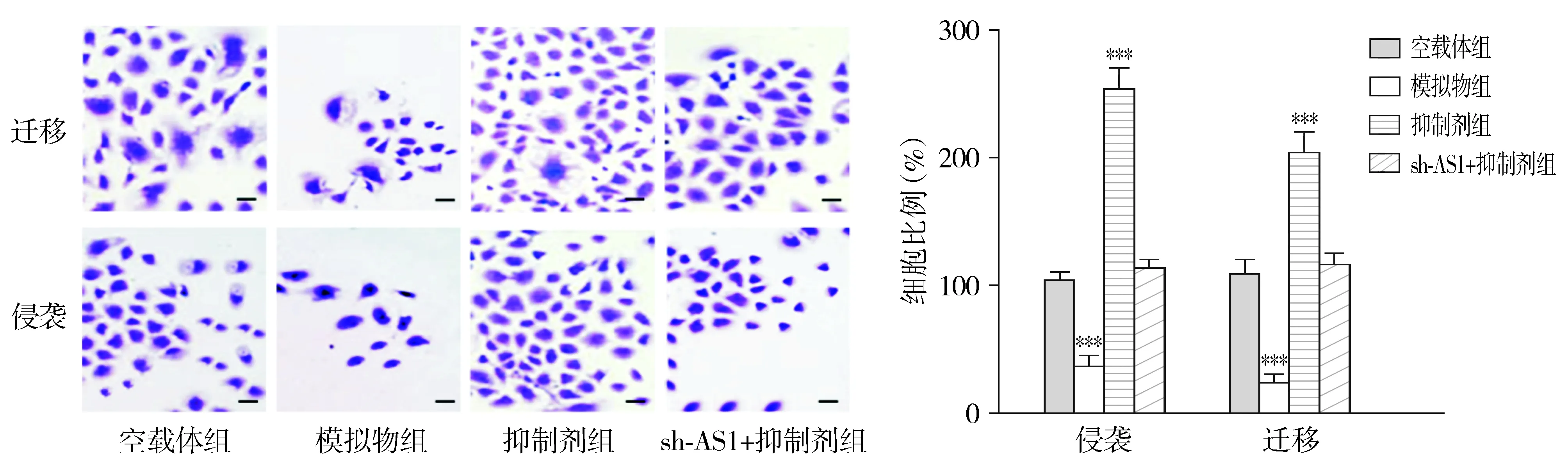
与空载体组比较,***P<0.001图5 下调miR-129-5p可促进FTC-133细胞的迁移和侵袭 (bar=100 μm)Figure 5 Downregulation of miR-129-5p promotes the migration and invasion of FTC-133 cells (bar=100 μm)

A.生物信息学分析预测miR-129-5p与Unc5b的结合位点与空载体组比较,***P<0.001B.双荧光素酶报告基因检测miR-129-5p与Unc5b的关系图6 miR-129-5p与Unc5b的关系Figure 6 Relationship between miR-129-5p and Unc5b
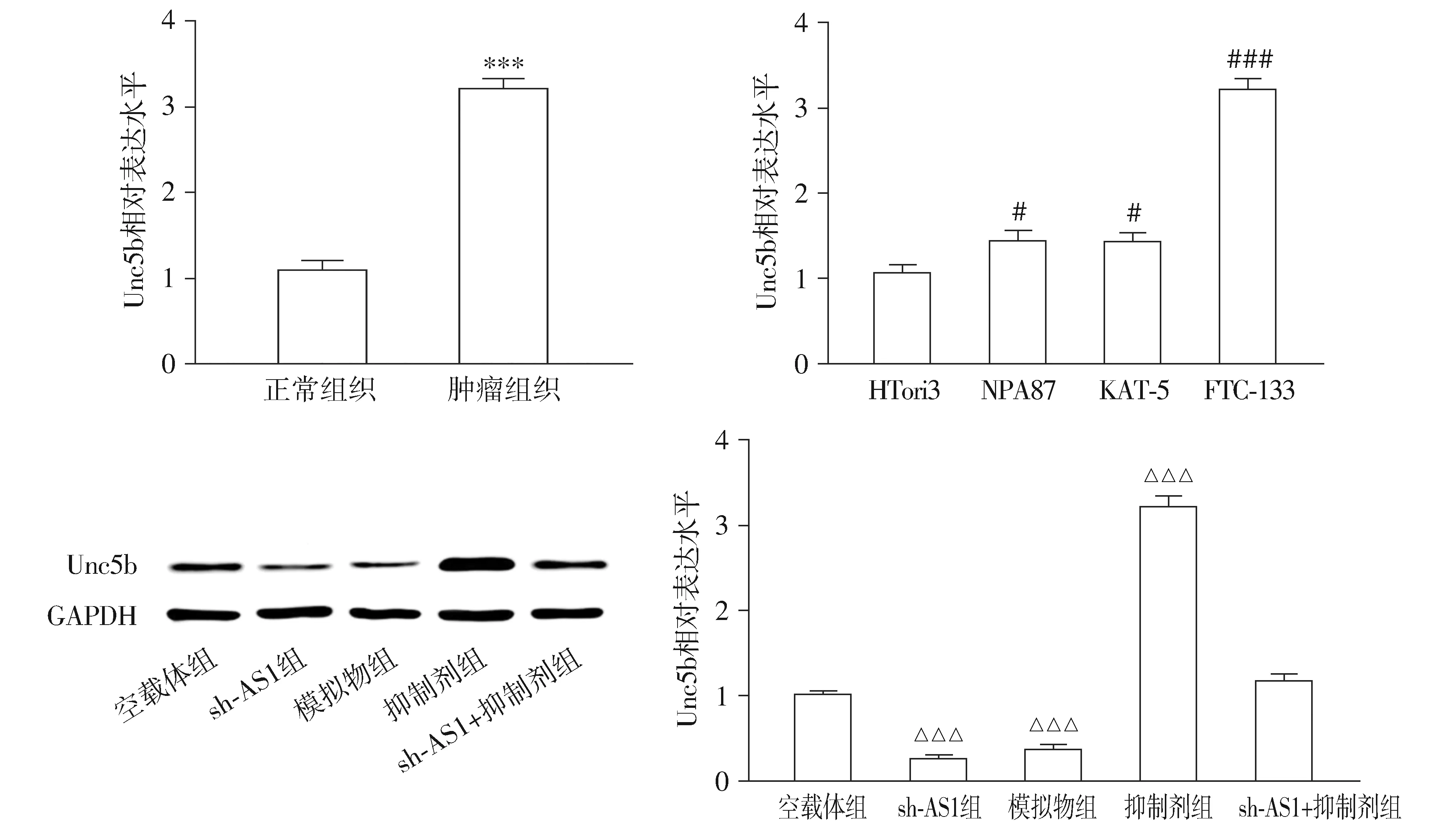
与正常组织比较,***P<0.001;与HTori3比较,#P<0.05,###P<0.001;与空载体组比较,△△△P<0.001图7 Unc5b在甲状腺肿瘤组织和TC细胞系中表达情况Figure 7 The expression of TNRC6C-AS1 in thyroid tumor tissues and TC cell lines
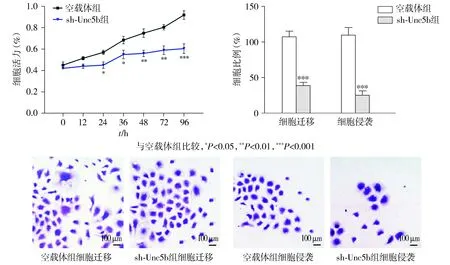
图8 miR-129-5p对FTC-133细胞增殖、迁移和侵袭影响Figure 8 Effects of miR-129-5p on the proliferation, migration and invasion of FTC-133 cells
3 讨论
研究表明,lncRNA对细胞周期等多个阶段的调控起重要作用,如在细胞分化、增殖、迁移、侵袭和凋亡等[6]。与mRNA相比,lncRNA通常在细胞核中,具有组织特异性,在不同物种之间并不高度保守,并且以较低的丰度存在[5]。而lncRNAs在TC中具有与TNRC6C-AS1相似的功能;例如MALAT1在甲状腺乳头状癌和滤泡性甲状腺癌中上调[13-15],其具有致癌作用,并通过调节IQGAP1的表达促进甲状腺癌细胞的增殖和侵袭[16]。同时,MALAT1在介导TC进展中具有潜在作用,MALAT1在低分化和间变性甲状腺癌中显著下调,其过表达与miR-21结合可能调节甲状腺髓样癌的进展[17,18]。TUG1可能通过作为ceRNA竞争性与miR-145起作用而有助于TC细胞的发展,而lncRNA TUG1与TC细胞的肿瘤进展有关[19]。与这些lncRNAs类似,TnRC6C-AS1在TC中也具有肿瘤促进剂的作用。这提示TNRC6C-AS1可作为TC的一种新的生物标志物。
miRNAs是组织特异性基因表达的有效调节因子,其已被证明是反应癌症的一个标志物[20]。大量的miRNAs被发现于TC中[21]。文献报道,miR-129-5p可导致组蛋白去乙酰化酶抑制剂诱导的TC细胞死亡[22]。miR-129-5p/RET可抑制髓样TC细胞的生长、凋亡和迁移[23]。miR-335-5p在甲状腺乳头状癌中的表达水平明显低于其他类型的肿瘤,同时ICAM-1可以促进TC细胞的增殖,而miR-335-5p可以抑制TC细胞的增殖,这可能说明miR-335-5p可以靶向ICAM-1并抑制其表达[24]。miR-146b-5p在正常大鼠卵泡PCCL3细胞中的过度表达降低了SMAD4水平,并对TGF-β介导的细胞周期阻滞产生抵抗,而甲状腺癌基因RET/PTC3和BRAF的激活上调了miR-146b-5p的表达[25]。然而,miR-129-5p在乳头状甲状腺癌的microRNA分析中却表现出无作用[26]。因此,miR-129-5p的功能及其与mRNA、lncRNA等其他因子的相互作用还有待进一步研究。
本研究结果表明,miR-129-5p与TNRC6C-AS1结合并下调其在TC中的表达。这在其他类型的癌症中也有类似的现象,例如在甲状腺癌中,miR-129-5p受到PTCSC3表达的负调控,从而调节肿瘤进展[27]。miR-129-5p还通过TLR9信号通路促进人肺癌细胞在体内和体外的定植,表明其与人肺癌的发生发展密切相关[28]。
另外,Unc5b(miR-129-5p的靶基因)在多种癌症表明具有促癌作用;如在膀胱癌中,Unc5b的过表达抑制了细胞的增殖和迁移,并诱导了G2/M期的细胞周期停滞[29]。另一项研究还表明,与正常膀胱细胞系相比,Unc5b在膀胱癌中的表达被下调,并与膀胱癌复发相关[30]。Unc5b在成人的现有脉管系统中被下调,但在血管生成和肿瘤发生过程中被重新表达,这表明Unc5b是潜在的抗血管生成治疗靶标[31]。在有远处转移的乳腺癌患者中观察到netrin-1和Unc5b的表达上调[32]。在前列腺癌组织和细胞系中Unc5b-AS1的表达均显著增加,这与前列腺癌患者的病理分期和远处转移的发生率显著相关;此外,Unc5b-AS1能够通过调节caspase-9表达来加速前列腺癌的恶性进展[33]。这些结果表明Unc5b可能是这些癌症中的一种抗癌基因。
本研究结果表明,lncRNA TNRC6C-AS1和Unc5b在TC组织和细胞中过表达,而miR-129-5p却低表达。TNRC6C-AS1和Unc5b增强了TC细胞活性,而miR-129-5p抑制TC细胞活性。TNRC6CAS1和Unc5b均能与miR-129-5p直接结合。TNRC6C-AS1表达降低并上调miR-129-5p的表达,进而下调了Unc5b的表达。这些结果表明,TNRC6C-AS1在TC中作为miR-129-5p的CeRNA,在TC的发生发展中起重要作用,提示TNRC6C-AS1和Unc5b可能是TC治疗的潜在靶点。
