牡荆素对肾恶性横纹肌样瘤的潜在治疗研究进展
2021-08-03张黄成昊严兵杨震
张黄成昊 严兵 杨震
牡荆主要生长于南方山区,在云南、四川地区尤为常见。牡荆素(分子式为C21H20O10)是由牡荆叶和牡荆子中提取的天然黄酮类化合物。传统研究认为,牡荆素的主要作用是活血化瘀、理气通脉。用于瘀血阻脉所致的胸痹,症见胸闷憋气、心前区刺痛、心悸健忘、眩晕耳鸣、冠心病心绞痛、高脂血症、心脏动脉供血不足等症候者[1-4],常用于心血管疾病的治疗[1]。目前,牡荆素粗提产物已有成药用于临床医疗[1],其精提产物已在临床试验中。
肾恶性横纹肌样瘤(malignant rhabdoid tumor of kidney, MRTK)是恶性横纹肌样瘤(malignant rhabdoid tumor, MRT)的一种,是发生在肾脏的一种高度侵袭性肿瘤,常发生于婴幼儿,其男性发病率稍高于女性(1.5∶1)[5]。该肿瘤由Beckwith等[6]在1978年首次提出,起初被认为是肾母细胞瘤的一种亚型,1981年Haas等[7]发现了其不同于肾母细胞瘤和肾横纹肌肉瘤的独特性,而将其独立命名。随着研究的深入,学者们发现MRT还包括中枢神经系统起源的非典型畸胎瘤样/横纹肌样瘤及肾外头颅外起源的非中枢神经系统横纹肌样瘤,且MRTK有着与所有MRT共同的特点,即抑癌基因SMARCB1或SMARCA4突变[8]。本文结合MRTK的发生、发展机制来探究牡荆素对其可能的作用机制,以期为临床治疗及研究提供新的思路和理论依据。
一、牡荆素的抗肿瘤作用
近年来的研究发现牡荆素还是防癌抗肿瘤的天然药物成分,Scarpa等[9]报道从黄荆牡荆中得到的黄酮类化合物(如牡荆素)在生物活性测定中对人类癌细胞显示了广泛的细胞毒作用;Abdelhady等[10]的研究也发现,紫花牡荆素在MTT试验中显示对人结肠癌细胞(HCT116)的生长有抑制作用。自此,牡荆素的抗肿瘤作用开始受到人们的关注。
牡荆素在几种体外和体内模型中均显示有显著的抗肿瘤作用(表1),这些报道为牡荆素的抗肿瘤药用价值提供了有力依据。在这些报道中牡荆素发挥抗肿瘤作用的主要途径是通过促进肿瘤细胞凋亡、自噬及抑制多种细胞增殖和迁移的信号传导途径完成的(图1)。
有研究报道,牡荆素通过靶向U937细胞中的细胞凋亡而表现出抗肿瘤活性[13]。牡荆素触发的细胞凋亡通常还伴随着线粒体膜电位和Bcl-2蛋白水平的降低以及Caspase-3和Caspase-9蛋白表达的增加。
在与热应激相关的研究中显示,牡荆素通过上调Hsp90表达并随后激活内质网应激来促进细胞自噬[16]。Hsp90可能参与了牡荆素抗肿瘤作用的相关信号通路。
另外有证据表明,异牡荆苷及牡荆素还可以强烈趋向性结合一种名为转铁蛋白(transferrin, TF)[17]的特殊铁结合糖蛋白[18-19]。由于该蛋白可在癌细胞中高度表达[20-21],因此,我们推测,以TF受体为靶标发挥牡荆素的抗肿瘤作用存在较高潜力[17]。
二、牡荆素可能通过表观遗传学调控HIF-1α的表达进而影响肿瘤的发生及发展
在PC12细胞中还发现了牡荆素通过抑制HIF-1α并减少缺氧诱导的多种基因表达发挥抗肿瘤转移作用。这些基因编码VEGF、GAPDH、胶原蛋白III、醛缩酶A、烯醇酶1、TGF-β1和PDGFα,可导致PC12细胞转移能力和血管生成的减弱[14]。Epstein等[11]对乳腺癌细胞系的研究表明,牡荆素通过抑制HIF-1α途径降低细胞运动性而发挥抗肿瘤作用。P53作为一种主要的抑癌蛋白,在人口腔癌OC2细胞中的研究结果表明,牡荆素通过 P53-PAI1-MMP2级联显著降低了肿瘤细胞活力和细胞迁移[12]。
HIF-1α在1992年由Semenza等[22]首先发现。HIF-1α普遍存在于人和哺乳动物细胞内,常氧(21% O2)下也有表达,但合成的HIF-1α蛋白很快即被细胞内氧依赖性泛素蛋白酶降解途径所降解。所以,HIF-1α只有在缺氧条件下才可稳定表达。癌细胞能够在缺氧环境中生存,而缺氧本身可以激活导致肿瘤进展的适应性细胞反应[23]。许多HIF-1α介导的生物学效应对肿瘤进展有益,包括将代谢转变为糖酵解、诱导血管生成、调节细胞凋亡、诱导迁移等以抵抗低氧环境[23-24]。HIF-1α在肿瘤细胞中主要有两种作用:①HIF-1α触发Src的磷酸化,随后磷酸化STAT3的酪氨酸残基Y705(信号转导和转录激活因子3);②HIF-1α可诱导Bcl-2/BNIP3/BNIP3-like的表达增加,以及促进Beclin-1/Bcl-2复合体解离,通过以上两种机制激活细胞自噬[25]。
已有文献报道牡荆素可以显著抑制HIF-1α的表达[26],而肿瘤致癌基因HIF-1α的表达则受H3K27me3甲基化水平调控。

表1 牡荆素抗肿瘤作用的近期研究
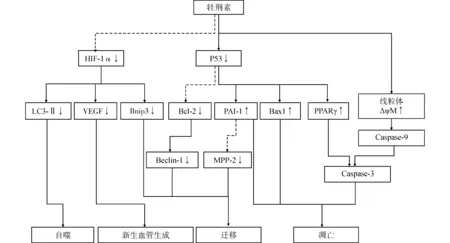
HIF-1α:缺氧诱导因子-1α;LC3-Ⅱ:微管相关蛋白1轻链3自噬体膜型;VEGF:血管内皮生长因子;PAI-1:纤溶酶原激活剂抑制剂-1;PPARγ:过氧化物增殖体激活受体γ;Beclin-1:螺旋肌球蛋白样Bcl-2相互作用蛋白1;MPP-2:膜棕榈酰化蛋白2图1 牡荆素发挥抗肿瘤作用的主要途径
三、牡荆素与H3K27me3甲基化水平的潜在联系
牡荆素可能通过调控下列靶点作用于多种癌症,我们描绘了牡荆素对各种类型恶性肿瘤的分子靶标的作用机理及可能的机制(图2)。

图2 牡荆素在恶性肿瘤中参与的主要下游信号通路
我们归纳这些牡荆素的分子靶标后发现,其大多也受到组蛋白相关修饰,即表观遗传学修饰的影响。例如:Bcl-2[27-29]、P53[27]、Caspases[28]、Bax[29]等均受到组蛋白H3不同位点尤其是H3K27me3甲基化水平的调控。因此,这些证据提示牡荆素对恶性肿瘤发挥作用的具体机制可能是通过调控表观遗传学修饰实现的;同时我们也发现这些靶点与MRTK的主要致病基因的下游基因(包括Bcl-2、P53)具有高度的一致性。
组蛋白H3K27em3的甲基化被认为在MRTK的发生及发展中扮演重要角色[30]。H3K27em3蛋白的甲基化可以抑制多种效应分子的结合[31],其甲基化水平的过度升高会导致包括细胞周期及凋亡等基因调控发生紊乱进而诱导细胞癌变[32]。而H3K27em3的甲基化则受到甲基化转移酶EZH2酶活性的严格调控[25],交换型转换缺陷/蔗糖不发酵型(SWI/SNF)复合物的结构残缺会对其介导的EZH2蛋白表达与酶活性的激活造成影响,进而降低对H3K27em3蛋白甲基化水平的调控[33]。有研究报道SMARCB1表达缺失会严重影响SWI/SNF复合物功能的完整性,造成该复合物功能或结构的残缺[25-26]。
四、SMARCB1/SMARCA4突变诱导的SWI/SNF复合物结构功能缺失参与包括MRTK在内的多种癌症的发生及发展
SMARCB1和SMARCA4基因编码的蛋白INI1与BRG1是参与SWI/SNF复合物的重要成员[34],被认为是肿瘤抑制基因,二者任一表达或功能的缺失都会导致多种肿瘤的发生[35]。SMARCB1或SMARCA4缺失诱导的肿瘤往往被称MRT,在多处组织皆可发生,但以MRTK最为常见,其拥有极高的侵袭性与致命性。文献报道MRT免疫组织化学结果显示SMARCB1或SMARCA4的核表达完全丧失[36],分子实验同样证实绝大多数MRT中等位基因SMARCB1或SMARCA4失活[37]。临床上超过70%的患有MRT的儿童存在远处转移,该病预后极差,单独化疗少有疗效,总生存率仅为5%[38],现阶段以长春新碱、卡铂、放线菌素等为首的传统化疗方案对儿童身体负担过重,急需新的治疗方案。
Renard等[39]认为SMARCB1或SMARCA4表达缺失会严重影响SWI/SNF复合物结构与功能的完整性,造成该复合物功能或结构的残缺。另有研究表明MRT主要通过表观遗传学途径发生,SWI/SNF复合物结构功能的完整性在其中发挥关键作用,组蛋白H3K27的甲基化水平往往受其严格调控[40]。
表观遗传学修饰在多种恶性肿瘤的发生及发展中扮演重要角色,近年来被广泛研究。其主要调节性机制包括DNA修饰、组蛋白修饰(甲基化、乙酰化等修饰)等。儿童MRTK的病因及发病机制较为复杂,至今仍不明确。近年主流的观点认为其与表观遗传修饰密切相关,并已作为儿童MRTK的潜在治疗靶点受到广泛关注[32];随着研究的不断深入,在MRTK中许多对DNA和组蛋白进行修饰的酶的表达与活性变化被发现[41]。
大量研究结果表明H3K27蛋白的甲基化可以抑制多种效应分子与之结合,该蛋白甲基化水平的过度升高会导致包括与细胞周期及细胞凋亡等相关基因的调控发生紊乱,致使包括P16、P21、Bcl-2、Bax、P53等表达异常,进而诱导细胞癌变的发生[29-30,32,42]。
五、结论
综上所述,牡荆素的主要下游靶点与MRTK主要致病因子的下游靶点吻合度极高,这使我们对其在MRTK的治疗效果拥有较高期待;而H3K27me3的甲基化水平变化在其中可能发挥关键作用。HIF-1α不仅作为牡荆素抗肿瘤的一个关键靶标更作为H3K27me3甲基化水平调控的下游蛋白,进一步提示了牡荆素可能通过表观遗传学水平发挥调控作用。目前还没有进一步证据表明牡荆素对MRTK的治疗作用是否确切,但大量文献报道可验证我们的猜想:牡荆素可通过表观遗传学途径来调控HIF-1α的表达,例如改变H3K27me3甲基化水平,进而改善MRTK的发生及发展。MRTK与肾透明细胞肉瘤等儿童罕见肾恶性肿瘤相似[43],传统的治疗手段毒副作用大,预后差[44]。随着牡荆素抗肿瘤作用机制的日益完善,其对MRTK的潜在治疗价值与优势显得愈发突出。
尽管牡荆素已在心血管疾病的治疗中作为辅助用药投入临床,并证实了其安全性及可靠性;但目前临床上尚无将其应用于抗肿瘤治疗疗效的相关报道。本文从MRTK发病机制以及牡荆素对其潜在的抗肿瘤靶点作用两个方面的挖掘分析,阐明牡荆素的潜在抗肿瘤药用价值,为临床MRTK的治疗提供了新的思路。我们认为,如果将牡荆素成功应用于MRTK的治疗,势必会改善目前放化疗不良反应过重、费用昂贵且效果不佳的弊端,最大限度地降低传统放化疗对患者身心健康的影响,提高MRTK患儿的存活率。
