线粒体呼吸链复合物Ⅰ的结构与装配路径
2022-02-26叶飞宇魏亚康王桂凤
叶飞宇, 魏亚康, 王桂凤
(河南农业大学农学院,省部共建小麦玉米作物学国家重点实验室, 郑州 450046)
线粒体是广泛存在于大多数真核细胞的半自主性细胞器,它通过氧化磷酸化合成三磷酸腺苷(adenosine triphosphate, ATP),从而维持生物体的正常生命活动,因此被称为“细胞动力工厂”。1905年,Merechowsky[1]最先提出线粒体“内共生起源”假说;1967年,Sagan[2]推测线粒体是内共生好氧菌产生,而叶绿体则是内共生蓝绿藻(现在称为蓝细菌)获得。目前,系统物种替换和多方法相互验证表明,线粒体起源于包含多种海洋细菌和内共生菌的Alpha变形菌的Ⅱb分支[3]。线粒体功能丧失会导致多种新陈代谢异常疾病,例如雷氏病 (Leigh’s disease)、阿尔兹海默症和癌症等[4]。相较于人类,线粒体在植物生长发育过程中具有重要的作用,例如线粒体缺失会影响信号传递和种子败育等[5]。
线粒体结构形态多样,一般呈球形、杆状或者丝状结构(见Fig.1A,1B)[6]。它由双层膜包被,从外到内依次为:外膜(outer membrane)、膜间隙(intermembrane space)、内膜(inter membrane)和基质(matrix)(见Fig.1C)。线粒体外膜是包围在其外部的一层单位膜,成分与细胞膜类似,结构平整、光滑且具有通透性;而内膜则是向内褶叠形成嵴(cristae),其通透性很低,许多物质不能自由通过而是需要借助特殊的转运系统[7]。

Fig.1 Morphology and structure of mitochondria (A) Three different types of mitochondria in adult mouse cardiac tissues: Subsarcolemmal (SM), intermyofibrillar (IM) and perinuclear (PN), accompanied with myofibrils (m) and nucleus (n). Adapted from reference[6]. (B) Mitochondria of the developing maize endosperm cell. White arrow represents the mitochondrion. (C) A schematic diagram of mitochondrion. It comprises of the outer membrane (OM), intermembrane space (IMS), inter membrane (IM), cristae and matrix
细胞能量分子ATP主要通过在线粒体内膜进行的氧化磷酸化(oxidative phosphorylation, OXPHOS)反应产生。而OXPHOS由细胞核和线粒体基因组共同编码的5个蛋白质复合物组成,它们在内膜建立并利用质子梯度;通过电子传递链(electron transport chain, ETC)将电子从还原型辅酶Ⅰ——烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NADH)转移至O2分子,最终生成H2O和ATP(见Fig.2)[8]。细胞生命活动所需的绝大部分能量都由线粒体电子传递链供给,而该系统从细菌到高等真核生物高度保守[5, 8]。这5种复合物在线粒体电子传递链中扮演着重要的角色,是氧化磷酸化必不可少的部分。任何一个复合物功能受损都会对电子传递链造成影响,从而导致细胞不能正常生长,产生不可逆的后果[4, 5]。此外,线粒体是生物合成的中心,参与核苷酸、脂肪酸、胆固醇、氨基酸、葡萄糖和亚铁血红素的合成[9]。

Fig.2 Schematic diagram of the mitochondrial OXPHOS system The mitochondrial OXPHOS system is located into the inner membrane (IM) connected by the intermembrane space (IMS) and matrix. It includes the proton-pumping enzymes ComplexⅠ (NADH-ubiquinone oxidoreductase), complexⅢ (cytochrome bc1) and Complex Ⅳ (cytochrome c oxidase), which generate a proton gradient (ΔΨ) that thereby drives F1FO-ATP synthase (Complex Ⅴ) to generate ATP. ComplexⅠ is the main entry point for electrons from NADH, whereas Complex Ⅱ is an additional entry point for electrons from the conversion from succinate to fumarate. The generated electrons are firstly used to reduce ubiquinone (Q) to ubiquinol (QH2). QH2 is subsequently used by complex Ⅲ to reduce cytochrome c, and Complex Ⅳ uses cytochrome c to reduce molecular oxygen. The dashed square in ComplexⅠ represents the CA domain specific to plants. Revised from references[5, 8]
1 线粒体复合物Ⅰ的结构
线粒体复合物Ⅰ(NADH-泛醌氧化还原酶)是氧化磷酸化系统(OXPHOS)的第1个也是最大最复杂的复合物,是驱动产生质子梯度并合成ATP所必需的组分[10]。除以单体形式发挥功能外,线粒体复合物Ⅰ还可以与复合物Ⅲ和复合物Ⅳ形成超级复合体,也称为呼吸小体(respirasomes)[5, 11]。这些超级复合物的组成和丰度在不同的物种中差异较大,它们的生物学功能目前仍不清楚。作为超复合物的组成单元,线粒体复合物Ⅰ可以使用温和去污剂解离却不影响其催化活性[12]。
1.1 总体结构
冷冻电镜(cryo-electron microscopy, cryo-EM)分析表明,细菌和真核生物的呼吸链复合物Ⅰ均呈现“L”型结构,由伸入基质的亲水性臂和嵌入内膜的疏水性臂组成[8, 10, 13, 14]。细菌的复合物Ⅰ最简单,由14个严格保守的核心亚基(core subunit)平均分配组成亲水的外周结构域和疏水的膜结构域(见Table 1)。而人类的线粒体复合物Ⅰ由45个亚基组成,除上述14个核心亚基外,还有31个线粒体特异的额外亚基(supernumerary subunit)[15]。与此类似,植物线粒体复合物Ⅰ含有至少45个亚基,还包括植物特有的γ-碳酸酐酶(γ-carbonic anhydrase, γCA)[16, 17]。

Table 1 The core subunits of ComplexⅠ from bacterial, yeast, animals and plants
亲水性外周臂由催化活性迥异的顶端NADH氧化脱氢酶模块(N-module)和基部亲水-疏水连接模块(Q-module)组成,负责将电子分别输入铁硫簇(Fe-S cluster)和传导至泛醌结合位点。与外周臂的氧化还原功能相耦合,疏水性膜臂(质子转移模块,P-module)通过构象变化将质子从线粒体基质矢量转移到内膜[8]。质子运输产生的能量梯度最终被复合物Ⅴ(F1FO-ATP合酶)利用生成ATP。因此,复合物Ⅰ的2个组成臂在功能和进化上相对独立:外周臂催化氧化还原反应,而膜臂催化质子运输。
1.2 亲水性外周臂
嗜热菌的顶端N-module含有3个核心亚基(Nqo1-3),人类对应的3个成员泛醌氧化还原酶Fe-S蛋白1(NADH-ubiquinone oxidoreductase Fe-S protein 1, NDUFS1)、泛醌氧化还原酶黄素蛋白1(NADH-ubiquinone oxidoreductase flavoprotein 1, NDUFV1)和NDUFV2,以及植物的泛醌氧化还原酶Fe-S蛋白1(NADH-ubiquinone oxidoreductase Fe-S protein 1, NDUS1)、泛醌氧化还原酶黄素蛋白1(NADH-ubiquinone oxidoreductase flavoprotein 1, NDUV1)和NDUV2(见Table 1)。辅助因子黄素单核苷酸(flavin mononucleotide, FMN)在Nqo1的作用下进入呼吸链,并作为NADH氧化反应后的电子受体。而Q-module包含4个核心亚基[嗜热菌Nqo4-6和9,人类NDUFS2、NDUFS3、NDUFS7和NDUFS8,以及植物NADH脱氢酶7(NADH dehydrogenase 7,NAD7m)、NAD9m、NDUS7和NDUS8]和铁硫簇辅助因子。与动物不同,NDUFS2和NDUFS3对应的植物亚基NAD7m和NAD9m由线粒体基因组编码。绝大部分铁硫簇在Nqo3指导下形成氧化还原链,从而连接FMN至与膜臂结合处的泛醌结合位点。Nqo6和Nqo4协同进一步将电子转移给泛醌。从进化上,亲水外周臂的氧化还原活性来源于镍铁氢化酶([NiFe] hydrogenases),并产生N-module和Q-module[8]。
1.3 疏水性膜臂
依据泛醌结合位点的位置,P-module进一步分为近端(PP)和远端(PD)结构域。嗜热菌的PP和PD结构域分别由5个(Nqo7、Nqo8、Nqo10、Nqo11和 Nqo14)和2个(Nqo12和Nqo13)组成。相对应地,人类PP和PD成分分别是NADH脱氢酶1(NADH dehydrogenase 1, ND1)-3m、NADH脱氢酶4大亚基(NADH dehydrogenase 4 large subunit, ND4Lm)、ND6m和ND4m、ND5m;植物则为NAD1-3m、NAD4Lm、NAD6m和NAD4m、NAD5m(见Table 1)。而动物和植物的上述7个亚基均由线粒体基因组编码。Nqo12~14均与细菌钠离子/质子逆向转运蛋白(Multiple resistance and pH-related antiporter, Mrp)反向转运复合物亚基MrpA和MrpD同源[8],均含有14个保守的跨膜螺旋(transmembrane helices, TMHs),其中10个高度保守的核心TMH沿膜臂对称分布。这些螺旋能够增加蛋白质的可塑性和电荷,从而有利于呼吸链中电子的运输。Nqo8是P-module中最保守也是复合物Ⅰ中最独特的亚基,位于外周臂和膜臂连接处结合泛醌。因此,Nqo8在电子传递链耦合机制中发挥重要作用。
1.4 植物特有的CA结构域
区别于动物,植物的PP结构域附着了一个朝向基质的球状结构。它由3个与原核生物γ-碳酸酐酶(γ-carbonic anhydrase, CA)同源的蛋白质异源聚合组成,称为CA结构域;它紧密结合在PP结构域中NAD2m/NU2M的表面[16, 17]。目前,植物复合物Ⅰ的CA结构域的生理功能仍不清楚,可能参与CO2从线粒体到叶绿体的转移和再固定[19]。
2 线粒体复合物Ⅰ的装配
2.1 动物线粒体复合物I的装配
作为呼吸链中最大的成员,复合物Ⅰ由多个亚基和装配因子组成的中间产物(intermediates)有序组装而成(见Fig.3A)。近年来,利用复合物蛋白质组分析技术(complexome profiling)成功解析了动物复合物Ⅰ的完整装配路径[11]。此外,除组成亚基外,目前已鉴定出至少20个装配因子参与复合物Ⅰ的生物合成。

Fig.3 The assembly pathway of mitochondrial ComplexⅠ (A) The assembly pathway of human mitochondrial ComplexⅠ. (B) The assembly pathway of Arabidopsis mitochondrial ComplexⅠ. The assembling modules are listed in the middle panel, as N, Q, ND1, ND2, ND4, ND5 and the plant-specific CA domain. Proteins marked in red indicate the characterized assembly factors. ?represents the currently unknown assembly factors. The diagram is summarized according to the references [11, 20]
2.1.1 ND2模块 人类细胞通过氯霉素处理能够诱导线粒体从头(denovo)再生[21]。在早期,先形成包含核心亚基ND2的293 kD中间产物;其中还包括额外亚基NDUFC1、NDUFC2、线粒体复合物Ⅰ装配因子(mitochondrial complex I intermediate assembly, MCIA)复合物[22]及细胞色素C氧化酶装配因子1同源物(cytochrome C oxidase assembly factor 1 homolog, COA1)。除参与装配外,COA1还负责新生(nascent)ND2的翻译[23]。随后,装配因子跨膜蛋白126B (transmembrane protein 126B,TMEM126B)和TMEM186招募ND3形成一个357 kD的复合物。晶体结构表明,ND3、ND4L和ND6形成两层直的螺旋穿过疏水膜臂[24]。与COA1类似,TMEM186则负责新生ND3的翻译[23]。这些亚基也进入上述复合物形成PP-b中间产物[11]。
2.1.2 Q模块 在线粒体重建早期,核心亚基NDUFS2、NDUFS3和额外亚基NDUFA5先形成约89 kD的复合物。在泛醌氧化还原酶复合物装配因子3(NADH:ubiquinone oxidoreductase complex assembly factor 3, NDUFAF3)和NDUFAF4的作用下,NDUFS7和NDUFS8随后加入、并形成稳定的170 kD的完整Q模块[11]。而NDUFAF3、NDUFAF4和NDUFS3三者可以彼此相互作用,并进一步与NDUFS2互相作用[25]。相较于其他亚基,敲除NDUFA5能够极大减少所有成员的丰度[26],表明NDUFA5在Q模块的形成和稳定中发挥重要作用。此外,装配因子NDUFAF5通过对第73位精氨酸残基(Arg-73)的羟基化和甲基化修饰从而稳定NDUFS7[27];而NDUFAF7则介导NDUFS2第85位精氨酸残基(Arg-85)的二甲基化修饰,从而招募NDUFS7进行装配[28]。
2.1.3 ND1模块 在装配因子线粒体内膜结构域蛋白1的转位酶(translocase of inner mitochondrial membrane domain-containing protein 1, TIMMDC1)的作用下,核心亚基ND1与Q模块先形成273 kD的复合物;进一步招募额外亚基NDUFA3、NDUFA8和NDUFA13,形成约283 kD的中间产物,称为Q/PP-a[11]。有趣的是,细胞敲除实验发现,TIMMDC1与ND1模块而非Q模块的成员紧密相关[26]。而在复合物Ⅰ和中间产物并存的稳态下,TIMMDC1则存在于2个分子量为400 kD和440 kD的稳定复合物中,并且敲除TIMMDC1能彻底破坏ND1模块而部分减少ND2模块丰度[29]。因此,TIMMDC1在ND1模块形成过程中发挥关键作用。此外,ND1模块与ND2模块组装形成Q/PP复合物。
2.1.4 ND4模块 在重建早期,额外亚基NDUFB5、NDUFB6、NDUFB10和NDUFB11先形成67 kD的中间产物;在装配因子TMEM70、FAD依赖性氧化还原酶结构域(FAD-dependent oxidoreductase domain containing 1, FOXRED1)和ATP5SL的作用下,核心亚基ND4和额外亚基NDUFB1加入形成230 kD的复合物,称为PD-a[11]。免疫共沉淀分析发现,FOXRED1能够与ND1模块的NDUFB10、NDUFS5、NDUFA10和NDUFA8以及Q模块的NDUFS3和NDUFA5形成复合物[30]。TMEM70能够与NDUFS5和Toll途径进化保守信号介导因子(evolutionarily conserved signalling intermediate in toll-signalling, ECSIT)互相作用[31];其功能丧失会过度积累中间产物Q/PP-a和Q/PP[32]。这表明,TMEM70通过装配或稳定PD-a中间产物,从而参与P模块的装配。而敲除装配因子ATP5SL则造成复合物Ⅰ缺陷,以及N模块和PD复合物亚基急剧减少[26]。此外,ND4模块能够与ND2模块组装形成PP-b/PD-a复合物。
2.1.5 ND5模块 在PD-a中间物生成的同时,核心亚基ND5和额外亚基NDUFAB1、NDUFB7、NDUFB3、NDUFB8、NDUFB9及NDUFB2组成约300 kD的中间产物,称为PD-b[11]。然而,这些亚基的总分子量约为154 kD,仅是上述复合物分子量的一半。因此,推测PD-b复合物会形成二聚体,从而为继续装配ND4/PD-a模块提供支架(scaffold)。而ND5亚基N-端的150个氨基酸能够形成螺旋结构,从而将其锚定于PP模块[24]。值得注意的是,ND5和ND4高度同源,但是ND4的N-端缺失上述螺旋结构。当然,这个300 kD复合物中也可能还包含多个装配因子。但是,目前尚未鉴定到任何参与PD-b模块装配的因子。
2.1.6 N模块 在重建早期,核心亚基NDUFV1和NDUFV2形成72 kD的复合物,而核心亚基NDUFS1和额外亚基NDUFA2则形成88 kD的复合物。随后,这2个复合物结合形成160 kD的中间产物,称为N模块[11]。敲除NDUFA2会造成N模块缺失和复合物Ⅰ活性丧失[26]。而额外亚基NDUFV3、NDUFS4、NDUFS6、NDUFA6、NDUFA7和NDUFA12则在N模块与Q/P复合物装配过程中进入复合物Ⅰ。目前,这些亚基以及N模块如何招募进入的机制仍不清楚。有研究认为,Q/P复合物可能作为支架从而招募N模块[33]。与嗜热菌不同,真核生物的NDUFA12(B17.2)通过复制产生NDUFAF2(B17.2 L)[34]。而NDUFAF2作为装配因子存在于N与Q/P装配的中间产物,但不存在于完整的复合物Ⅰ[35]。在NDUFA12缺失的细胞中,NDUFS4会急剧增加、且NDUFAF2可以替代它整合入复合物Ⅰ全酶[26, 36]。然而,NDUFS4缺失会造成NDUFA12的完全缺失,而NDUFAF2却显著增加[36]。因此,NDUFAF2可能在稳定830 kD复合物Ⅰ装配中间产物(缺失NDUFA12/B17.2和NDUFS4)中发挥重要作用。
2.2 植物线粒体复合物I的装配
与大多数已知的真核生物类似,植物复合物Ⅰ也是线粒体呼吸链中最大的组分,但对其分子机制和装配路径的解析却相对滞后[5, 8, 37]。利用复合物分离结合质谱分析技术已初步揭示了植物复合物I的装配路径[20, 38, 39]。最近,冷冻电镜cryo-EM分析进一步验证并丰富了植物复合物I的结构和装配路径[16, 17]。
2.2.1 N模块 核心亚基NDUV1和NDUV2在未知装配因子作用下形成120 kD的复合物,然后核心亚基NDUS1和额外亚基NDUA2加入并形成170 kD的N模块,同时释放装配因子[20]。与动物不同,NDUS4、NDUS6和NDUA12则加入形成350 kD 的N模块与Q模块组装的亲水性外周臂。植物中也含有装配因子NDUFAF2的直系同源基因(ortholog)(见Table 2),但是其主要以单体形式存在[20]。因此,aNDUFAF2是否参与植物N模块的组装以及其分子功能仍需进一步研究。
2.2.2 Q模块 与动物类似,植物核心亚基NAD7m/NDUFS2、NAD9m/NDUFS3和额外亚基NDUA5先组装形成约80 kD的中间产物。植物中,这2个核心亚基仍然由线粒体基因组编码。这表明,线粒体与其寄主共同进化,且在不同的谱系中独立进化。核心亚基NDUS7能够与NAD7m紧密互相作用[40],进一步装配形成120 kD的中间产物。然而,另1个核心亚基NDUS8如何招募并装配形成Q模块仍不清楚。最终,Q模块与N模块结合形成350 kD的亲水性外周臂。此外,植物中,装配因子NDUFAF3和NDUFAF4的直系同源基因在Q模块中的作用,以及核心亚基NAD7m的翻译后修饰尚待解析。
2.2.3 PP模块 与动物不同,植物特有的γ-碳酸酐酶(γCA)能够形成1个85 kD的中间产物。拟南芥基因组中含有5个成员:3个CAs(CA1、CA2和CA3)和2个CAL(CA1L和CA2L)。蛋白质互相作用和遗传及结构分析表明,它们会形成1个由任意1个CAL和2个CAs组成的异源三聚体[16, 17, 19, 41]。随后,核心亚基NAD2m和额外亚基NDUC2、P2和20.9 kD组装形成200 kD的复合物。进一步,在植物特异的装配因子GLDH的作用下[42],核心亚基NAD3m、NAD4Lm和NAD6m进入形成400 kD的中间产物。最后,核心亚基NAD1m和额外亚基NDUA3、NDUA13结合形成450 kD的PP模块。PP模块接着与350 kD的N/Q装配产物结合,最终形成约800 kD的亚复合物Ⅰ。
奇怪的是,动物中参与PP模块形成的装配因子在植物中几乎完全丢失,仅有NDUFAF1在所有真核生物中保留[20]。因此,植物是否进化出新的PP模块装配的路径,是否有新的装配因子以及NDUFAF1直系同源蛋白质在植物中的作用都是很有趣的生物学问题。
2.2.4 PD模块 PD模块由于鉴定出的装配亚基丰度过低,其形成路径可能不精确[20]。而冷冻电镜cryo-EM分析也很难获得包含PD模块的植物线粒体复合物Ⅰ全酶的晶体[16]。推测PD模块的装配可能通过两步完成。首先,核心亚基NAD4m、NAD5m和额外亚基NDUB2、NDUB3、NDUB4、NDUB10、NDUB11、NDU10、P1形成约270 kD的中间产物;然后,该中间产物二聚化形成400 kD稳定的复合物。这与人类PD-b的二聚化相类似[11],但是其真实的装配路径仍需进一步研究。最后,PD模块与亚复合物Ⅰ组装形成完整的线粒体复合物Ⅰ。
2.3 动植物线粒体复合物I装配的差异
综上所述,动物和植物线粒体复合物Ⅰ的装配都采用模块化、逐步组装的路径。尽管它们绝大部分模块组成相同,但是也存在一些分化[11, 20]。首先,植物的N模块和Q模块组装成完整的亲水性外周臂后再与PP模块结合;而动物的则是亲水性外周臂的Q模块先与PP模块结合,组装的最后阶段结合N模块。其次,动物会形成稳定的Q/P中间产物,而植物未组装的亲水性外周臂亚基可能是由于降解导致不稳定[43]。这表明,植物中缺乏稳定尚未与N模块组装的Q模块的保护机制。这种差异可能是由植物NDUS6与动物NDUFS6相比,缺失N端结构造成的。而动物NDUFS6的N端能够结合NDUFA12,并与Q模块的亚基NDUFA9互相作用,从而介导N模块与Q/P中间产物装配[11]。此外,装配因子NDUFAF2与NDUFA12高度同源,可以竞争性结合NDUFS6[44]。而植物中,NDUS6丧失了与NDUA12的结合能力,所以可能不依赖于NDUFAF2与NDUFA12进行组装。
CA异源三聚体位于膜臂朝向线粒体基质侧,是植物复合物Ⅰ区别于其他物种的最独特标志[45]。CA结构域与膜臂的结合位置与动物NDUFA10在复合物Ⅰ全酶的空间位置相同[17]。CA是一类锌酶,催化CO2水化的可逆反应,参与体内碳固定和pH调节[46]。与古细菌祖先基因单体相比,CA在植物复合物Ⅰ是异源三聚体[47]。结构分析表明,三聚体中含有1个CAL和2个CAs(其中一个是CA1,另一个是CA1或CA2)。它们通过N-端和C-端延伸结构域彼此相连,与植物特异的P2蛋白互相作用从而锚定至膜臂,并通过NAD6m的C-端与CA结合增强稳定性[17]。CAL比CA缺少了2个保守的组氨酸残基活性位点,导致其锌酶活性减弱。因此,植物复合物Ⅰ中,CA结构域是否具有催化活性,或者与蓝藻CcmM类似参与HCO3-的固定运输[48],仍需进一步验证。而CA敲除导致拟南芥种子滞育,但是活性位点突变的CA仍然能够回复突变表型。这表明,CA酶活性与种子发育无关[19]。最近发现,蓝藻光合作用复合物Ⅰ中也存在CA结构域,它能够与质子泵亚基耦合[49]。因此,CA结构域在植物线粒体复合物Ⅰ中也可能发挥质子泵的功能。
此外,植物和酵母保守的PD模块亚基NDU10/NUUM与动物的NDUFC1未见显著同源性。结构分析表明,哺乳动物NDUFC1位于疏水性膜臂NDUFC2的边缘[15],而解脂耶氏酵母在相应的位置不存在亚基[24]。意外的是,绿豆中含有NDUFC1的同源蛋白且位于PP模块[16]。同样,动物的NDUFB1与植物和酵母的20.9 kD/NUXM也无同源性,且前者位于PD模块,而后者位于PP模块;并且20.9 kD的亚基是植物新进化获得的[50]。植物特异的单次跨膜P2亚基能够结合20.9 kD亚基,并与NAD2m和NDUC2共同形成脂质填充型腔(lipid-filled cavity),可能用于装载CA模块[15]。此外,其他植物特异的亚基,例如P1、P3、P4、TIM22-1、TIM22-2和TIM22-4等,如何参与线粒体复合物Ⅰ的装配仍待解析。总之,线粒体与其寄主协同进化,从而获得或丢失亚基和装配因子。
3 线粒体复合物Ⅰ的装配因子
线粒体复合物Ⅰ的生物合成依赖于多个生物学过程,包括蛋白质输入机制、膜插入酶(insertases)、分子伴侣和辅助因子结合蛋白质。特别是亚基组装过程中需要许多精细且特异的蛋白质,称为装配因子。这些对线粒体行使功能至关重要,任何基因功能削弱都可能致死。目前,动物中已经发现至少20个复合物Ⅰ装配因子,而植物中只发现4个(见Table 2)。
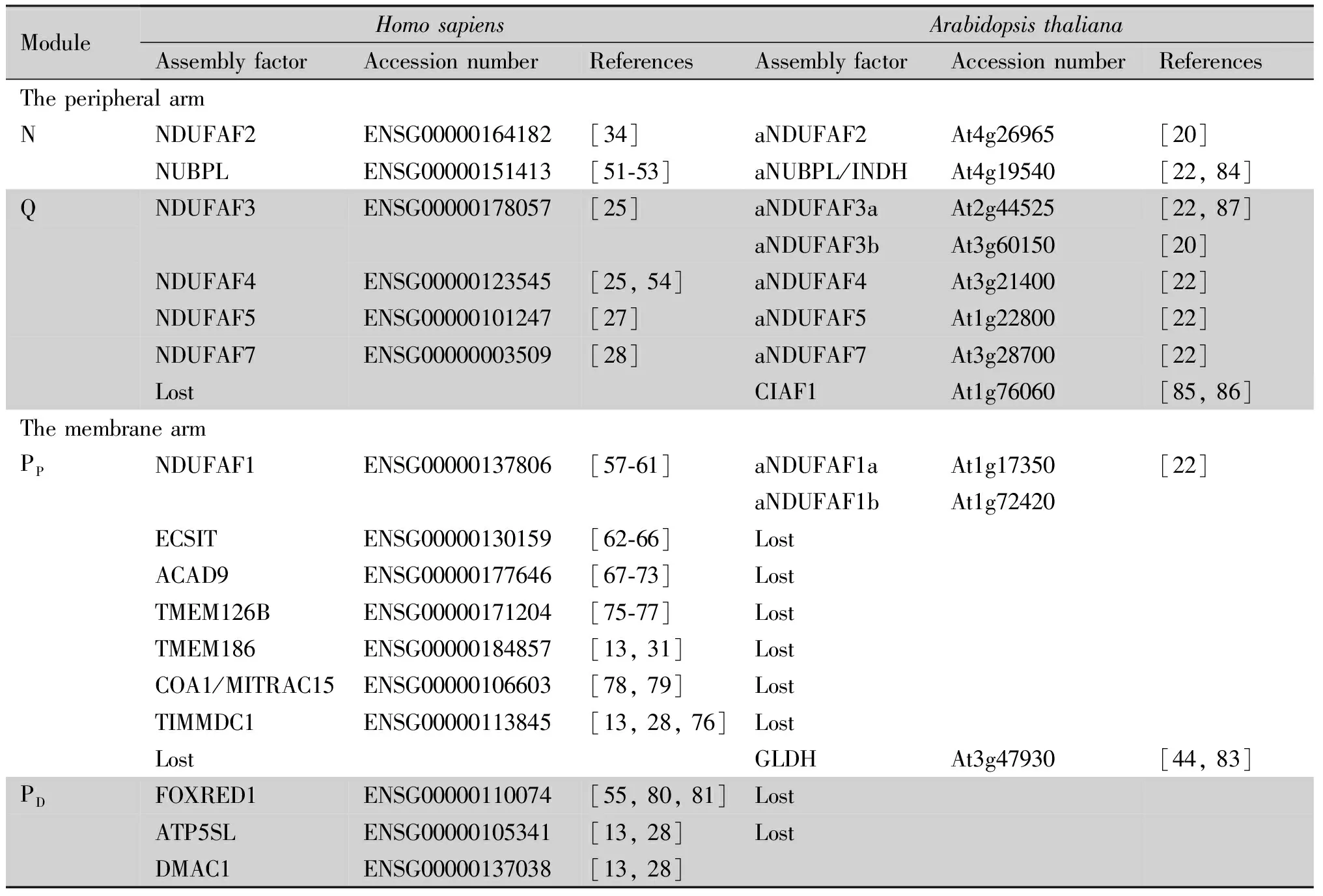
Table 2 Putative assembly factors in animals and plants
3.1 动物线粒体复合物I装配因子
3.1.1 亲水性外周臂 除上述已阐述功能的NDUFAF2、NDUFAF5 和NDUFAF7外,另有一些装配因子(NUBPL、NDUFAF3和NDUFAF4)参与亲水性外周臂的组装。
与解脂耶氏酵母相同,人类的核苷酸结合蛋白(nucleotide binding protein-like, NUBPL)通过CXXC基序与铁硫簇结合,敲除其导致N模块亚基的急剧减少及450 kD膜臂复合物的积累[51, 52];并且NUBPL突变直接造成复合物Ⅰ相关的线粒体疾病[53]。因此,NUBPL很可能在N模块结合Q/P中间产物中发挥功能。
NDUFAF3和NDUFAF4任何一个突变都会造成复合物Ⅰ缺陷而引起的脑肌病、心肌病和新生儿线粒体疾病[25, 54]。其中,人肌肉细胞NDUFAF4突变导致线粒体复合物Ⅰ减少70%,却积累2个可能是装配停滞的中间产物。而NDUFAF3突变也会导致复合物Ⅰ受损、核心亚基NDUFS2或ND1组装的中间产物缺失。因此,NDUFAF3在复合物Ⅰ装配早期发挥作用,并且与NDUFAF4协同将早期装配中间产物锚定于线粒体内膜。
3.1.2 MCⅠA复合物和PP结构域 线粒体复合物Ⅰ装配因子复合物(mitochondrial ComplexⅠ intermediate assembly complex, MCIA complex)由7个核心因子组成,包括NDUFAF1、ECSIT、脂酰基辅酶A脱氢酶9(acyl-CoA dehydrogenase 9, ACAD9)、TMEM126B、TMEM186、COA1以及TIMMDC1。这些装配因子之间相互依赖、相互作用,协同介导线粒体复合物Ⅰ膜臂PP结构域的组装。研究发现,NDUFAF1和ECSIT先与内膜上的TMEM126B结合,随后再与二聚化的ACAD9结合,最后与TIMMDC1结合形成一个完整的复合物,从而起始PP以及与Q的组装。在人类中,MCIA复合物参与线粒体复合物Ⅰ从早期至后期(200~700 kD)的装配进程[22],任何一个装配因子的突变都可能会导致疾病产生。
NDUFAF1 最先,真菌红色面包霉(Neurosporacrassa)中鉴定到1个复合物Ⅰ装配中间产物相关30 kD蛋白质(ComplexⅠ intermediate associated protein of 30 kD, CIA30);CIA30是膜臂合成的必需因子,其突变会导致装配停滞产物的积累[55]。人类的直系同源蛋白NDUFAF1也参与复合物Ⅰ的生物合成。利用温和去垢剂十二烷基-β-D-麦芽糖苷(N-Dodecyl-β-D-maltoside, DDM)处理线粒体,NDUFAF1出现在约600 kD和700 kD的中间产物[56]。而毛地黄皂苷(digitonin)处理发现,NDUFAF1存在于460 kD和830 kD的装配复合物内,其突变造成ND2和460 kD中间产物的缺失[57]。这表明,NDUFAF1在装配和稳定460 kD复合物中发挥重要作用。同时,NDUFAF1是造成人类线粒体疾病的关键致病基因位点之一;其突变导致线粒体复合物Ⅰ装配受阻,并异常累积NADH及线粒体活性氧(mitochondrial reactive oxygen species, mROS)诱发细胞凋亡[56-59]。
ECSIT在先天免疫系统Toll和IL-1途径中,ECSIT作为衔接蛋白质连接TRAF6和MEKK-1激活NF-κB[60]。小鼠中,ECSIT敲除导致胚胎在发育早期死亡[61]。后续研究发现,ECSIT定位于线粒体,且与装配因子NDUFAF1和核心亚基NDUFS3互相作用,形成500~850 kD的复合物;抑制ECSIT急剧削弱复合物Ⅰ装配、破坏其功能[26, 29, 62]。在巨噬细胞中,敲除ECSIT造成生物能量代谢转变、复合物Ⅰ缺失,并诱发线粒体降解和mROS积累;ECSIT通过与线粒体质控系统成员互相作用调控线粒体自噬[63]。最近研究发现,ECSIT通过调控神经元的mROS和线粒体自噬抑制阿尔茨海默病(Alzheimer’s disease)[64]。
ACAD9 根据序列的保守性,脂酰辅酶A脱氢酶9(acyl-CoA dehydrogenase 9, ACAD9)可能参与线粒体β-氧化路径。ACAD9在心血管、骨骼肌、大脑、肾和肝中表达丰度较高[65];体外生化分析发现,ACAD9特异性催化长链不饱和脂肪酸,参与维持膜的完整性和结构[66]。人类ACAD9缺陷会引发小脑中风、肝功能失活、低血糖、心肌病和慢性神经功能障碍,而且ACAD9与传统的长链脂酰辅酶A脱氢酶生理功能不同、不能相互替代[67]。ACAD9定位于线粒体内膜上、与NDUFAF1和ECSIT互相作用,敲除ACAD9会导致NDUFAF1和ECSIT水平下降,从而影响线粒体复合物Ⅰ的组装[68]。ACAD9是一个FAD结合蛋白质,而补充核黄素可以显著减轻ACAD9缺陷患者的症状[69]。有趣的是,ACAD9具有催化长链不饱和脂肪酸的活性,但是该酶活性是否与复合物Ⅰ的功能相关仍存在较大争议[70, 71]。
TMEM126B线粒体跨膜蛋白TMEM126B与装配因子NDUFAF1、ECSIT和ACAD9共迁移,形成复合物Ⅰ装配所需的MCIA复合物[22]。在哺乳动物基因组中,TMEM126B与另一线粒体内膜蛋白质TMEM126A相邻,可能是由基因复制产生[72]。而TMEM126B仅存在于哺乳动物中,是新进化的复合物Ⅰ装配因子[73]。TMEM126B功能削弱会导致成熟复合物Ⅰ和氧消耗量减少[22, 74]。与其他MCIA成员缺陷相比,TMEM126B突变患者表现出较轻的症状,包括运动不耐受、肌肉无力和肌病[74]。此外,TMEM126B能够与其他装配因子共同与复合物Ⅰ的其他亚基ND1、ND2和Q模块互相作用[75]。
TMEM186 线粒体复合物蛋白组表明,TMEM186能够与MCIA复合物共迁移[11]。NDUFAF1免疫沉淀和质谱联用发现,TMEM186与所有已知MCIA复合物成员共富集[29]。TMEM186插入线粒体内膜,其N-端和C-端伸入基质。敲除TMEM186会适当降低复合物Ⅰ及其超级复合物的丰度和活性、而其他复合物几乎不受影响;同时,NDUFAF1、ECSIT和ACAD9仍然定位于内膜[29]。因此,TMEM186与MCIA复合物的膜定位无关。TMEM186富集于约450 kD复合物,其中富含MCIA装配因子。尽管如此,TMEM186并非复合物Ⅰ组装的必需因子[29]。
COA1/MITRAC15 线粒体细胞色素c氧化酶翻译调控装配中间因子15(mitochondrial translation regulation assembly intermediate of cytochrome c oxidase 15, MITRAC15)是酵母COA1的直系同源蛋白质,其参与线粒体复合物Ⅳ的装配[76, 77]。然而,除了复合物Ⅳ的亚基外,COA1还能与线粒体复合物Ⅰ亚基NDUFB8免疫共富集,并且抑制其表达能够特异性降低这两个复合物的功能[11, 77]。因此,COA1可能在复合物Ⅰ和Ⅳ的装配中发挥双重功能。最近研究发现,COA1与TMEM186共富集,敲除COA1导致复合物Ⅰ丰度降低50%、但不影响复合物Ⅳ及其他复合物[29]。COA1还能够与NDUFAF1、ECSIT和ACAD9共富集,能够整合并稳定450 kD含有MCIA的中间产物以及ND2模块[29]。
TIMMDC1 氨基酸同位素标记结合质谱实验发现,TIMMDC1(C3ORF1)和TMEM126B共存于复合物Ⅰ装配中间产物[74]。TIMMDC1和额外亚基NDUFA11同源,属于Tim17-23家族,可能参与复合物Ⅰ嵌入内膜[31]。在复合物Ⅰ早期组装阶段,TIMMDC1能够与许多ND1和Q模块的亚基互相作用[11]。细胞系敲除相关性分析表明,TIMMDC1与ND1模块亚基NDUFA3、NDUFA8和NDUFA13高度相关而非Q模块[26]。TIMMDC1与MCIA复合物紧密相关,并参与ND2模块的装配[31]。与已知MCIA复合物成员不同,TIMMDC1功能失活不会影响任何其他成员的丰度[29]。因此,TIMMDC1参与ND1模块的生物合成,而MCIA复合物参与ND2模块的装配。
3.1.3 PD结构域 与PP结构域相比,目前已鉴定负责PD结构域装配的因子仍十分有限,仅包括FOXRED1、ATP5SL和DMAC1。
与假单胞菌(Pseudomonasaeruginosa)DauA同源,FOXRED1属于依赖于FAD的氧化还原酶,广泛存在于古细菌、细菌和真核生物中[78]。FOXRED1突变会导致人类复合物Ⅰ缺陷的线粒体疾病,它与ND1、ND2和ND4模块的亚基互相作用[30, 53]。小鼠敲除FOXRED1也同样造成复合物Ⅰ缺陷的症状,可以作为研究雷氏病(Leigh’s disease)的动物模型[79]。
敲除ATP5SL或DMAC1特异性造成复合物Ⅰ缺陷和其亚基丰度急剧减少[26]。免疫沉淀和质谱联用发现,ATP5SL和DMAC1分别与ND4和ND5模块的亚基互相作用。线粒体复合物蛋白组表明,它们与ND4模块的亚基组成特异230 kD中间产物[11]。尽管已有证据表明,ATP5SL和DMAC1参与PD结构域的组装,但是它们分别还是协同负责ND4和ND5模块的装配仍不清楚。
3.2 植物线粒体复合物I装配因子
相较于动物,同源基因鉴定发现,植物中含有保守的N和Q模块的装配因子,而负责P模块装配的因子几乎全部丢失(见Table 2)。目前,植物中已鉴定复合物Ⅰ装配因子仅有4个。
3.2.1 GLDH 植物中,L-半乳糖酸-1,4-内酯脱氢酶(L-galactono-1,4-lactone dehydrogenase,GLDH)是催化抗坏血酸生物合成的最后一步。GLDH定位于线粒体内膜,能够通过电子传递链将电子转移给细胞色素c[80]。GLDH在线粒体中参与形成3个具有酶活性、分子量分别为420 kD、470 kD和850 kD的复合物[81]。其中,850 kD的复合物是含有亲水性外周臂的装配较完整的复合物Ⅰ;而470 kD的复合物是复合物Ⅰ的疏水性膜臂。GLDH敲除导致复合物Ⅰ缺失、200 kD中间产物的积累而400 kD和450 kD的复合物丢失,表明GLDH负责复合物Ⅰ膜臂的装配[42]。此外,GLDH与B14.5b和15 kD亚基互相作用,阻止植物特有的P1进入PP,GLDH解离后其再与PD组装[17]。
3.2.2 铁硫蛋白INDH 植物NADH脱氢酶所需的铁硫蛋白(iron-sulfur protein required for NADH dehydrogenase, INDH)与解脂耶氏酵母IND1以及人类NUBPL直系同源,是进化上高度保守的铁硫蛋白[82]。INDH功能丧失导致复合物Ⅰ缺失及650 kD复合物的积累。indh突变体孢子体缺陷会影响雌雄配子体发生,突变体种子可以在蔗糖培养基中萌发但生长迟缓。INDH缺失会造成线粒体翻译效率急剧下降,特别是线粒体编码的核心亚基NAD6m和NAD7m。因此,与酵母和人类相比,植物INDH可能具有参与线粒体复合物Ⅰ装配和线粒体翻译调控的双重功能。
3.2.3 复合物Ⅰ装配因子1(CIAF1) 拟南芥复合物Ⅰ装配因子CIAF1属于线粒体亮氨酸-酪氨酸-精氨酸(a Leu, Tyr, and Arg motif, LYR)结构域蛋白质,该家族广泛分布于酵母、动物和植物[83]。其中,拟南芥LYR成员B14和B22以及酵母和人类的LYRM4/ISD11是复合物Ⅰ的额外亚基,参与铁硫簇的生物合成[20, 84]。CIAF1功能丧失导致复合物Ⅰ和超级复合物Ⅰ+Ⅲ缺乏、复合物Ⅰ装配停滞在650 kD和800 kD的中间产物。此外,CIAF1特异与23 kD基质蛋白质苏氨酸-酪氨酸-赖氨酸-酪氨酸1(a Thr, Tyr, Lys, and Tyr motif, TYKY1)互作参与亲水性外周臂的装配。
3.2.4 衣藻NDUFAF3 在衣藻(Chlamydomonasreinhardtii)光合作用系统Ⅱ效率降低的突变体pgrl1背景下,通过插入突变筛选获得了3个线粒体复合物Ⅰ受损的突变体[85]。其中,突变体M2是由于人类线粒体复合物Ⅰ装配因子NDUFAF3的直系同源蛋白质cNDUFAF3功能失活导致。与人类类似,衣藻cNDUFAF3影响Q模块而非N模块亚基的丰度。
3.3 线粒体复合物I装配路径的进化
尽管目前已鉴定功能的植物线粒体复合物Ⅰ装配因子仍较少,但是通过与动物直系同源基因分析获得了多个潜在的保守装配因子(见Table 2)。然而,这些因子几乎都是参与亲水外周臂N和Q模块而非疏水膜臂的装配。除广泛保守来源于最后真核生物共同祖先(last eukaryotic common ancestor,LECA)的NDUFAF1外,其他参与膜臂PP模块装配的因子都仅存在于蜷丝生物(Filozoa)或者后生动物亚界(Metazoa)[73]。表明这些装配因子在进化上有更新的起源,出现在植物界(viridiplantae)分支之后。然而,有些复合物Ⅰ亚基仅出现在植物、真菌和变形虫中,但在动物中缺失[50],它们可能是祖先亚基。以PP模块为例,植物装配中间产物包含多个祖先亚基,而后生动物中含有多个新起源的成员,表明植物PP模块的装配可能通过原始祖先路径完成。相比之下,在进化过程中,后生动物丢失了祖先亚基,从而需要新的装配因子参与组装PP模块。
综合上述复合物Ⅰ亚基的生化与遗传功能、系统进化分支信息,植物可能沿用了古老祖先的装配路径,而动物则通过获得新的亚基或者装配因子进化出新的装配路径[11, 20]。亲水外周臂的亚基和所需的装配因子在真核生物中绝大部分保守。在真核生物繁衍辐散之后,哺乳动物亲水外周臂仅增加了额外亚基NDUFV3[86, 87]。而亲水外周臂相关的装配因子都来源于真核生物辐散之前(见Table 2)[73]。然而,疏水膜臂在进化中存在诸多变化。例如,后生动物中新获得了额外亚基NDUFB1、NDUFC1、NDUFA10和NDUFB6,同时丢失了CA、20.9 kD/NUXM和NDU10/NUUM亚基,从而其装配机制也发生了全新变化。与此类似,植物线粒体复合物Ⅲ的组装也采用了祖先的装配路径,而动物则进化出了新的装配机制[88, 89]。这表明,动物在进化过程中可能面临更多新的环境选择压力,从而直接或间接加速了其与线粒体的共进化,而植物线粒体则更多保留了原始祖先的特征。
4 问题与展望
真核生物线粒体起源于超过18亿年前的一次内共生事件产生的LECA,并且随着寄主细胞共进化,从而产生形态结构与生物合成的多样性。近年来,随着生化与蛋白质组和结构生物学等先进分析手段的应用,已极大地拓展并加深了对线粒体结构和功能的认识。但是,目前线粒体进化和复合物装配路径的诸多方面仍不清楚,亟待解决。
复合物Ⅰ是线粒体OXPHOS反应产能的第1个、也最大和最复杂的催化酶功能单位。尽管在一些单细胞真核生物进化中伴随着复合物Ⅰ的丢失[90],但是多细胞真核生物复合物Ⅰ的功能削弱将会造成供能不足、生长发育严重受阻。然而,寄生双子叶植物欧洲槲寄生(Viscumalbum)可以在缺失复合物Ⅰ的条件下正常生长,可能是通过呼吸链重新组装的补偿效应实现的[91-93]。因此,线粒体复合物Ⅰ进化研究的关键问题是:在复合物Ⅰ丢失的多细胞真核生物中,除交替氧化酶途径和呼吸链重排外,是否存在其他新的能量补偿途径,缺失复合物Ⅰ的呼吸链是否具有非传统产能以外的代谢功能;在呼吸链正常的真核生物中,是否存在这些重排超级复合物,以及它们与含有复合物Ⅰ的超级复合物之间的关系,在复合物Ⅰ受损时它们是否具有补偿效应。其次,与动物相比,植物线粒体复合物Ⅰ晶体结构的完整性和分辨率仍需进一步提高,并且植物复合物Ⅰ相关超级复合物的晶体结构解析,将为植物线粒体复合物Ⅰ的功能研究提供重要分子基础。其次,植物复合物Ⅰ的装配路径及相应的装配因子仍知之甚少,以及其装配路径是否与动物保守、装配因子的生物学功能及其进化是后续研究的重点。最后,线粒体复合物Ⅰ的亚基由核与线粒体共同编码,组装过程中的协同调控所需的顺行与逆行信号感知与传导也是重要的研究内容。这些问题的解决,都将为未来如何改造和利用线粒体呼吸链分子机器,并高效生物产能提供理论依据。
