机器人辅助腹腔镜根治性膀胱切除加体腔内原位回肠新膀胱术初步经验(附10例报告)
2021-08-03李凡刘征李恒卢宇超王珅管维王少刚
李凡 刘征 李恒 卢宇超 王珅 管维 王少刚
随着泌尿外科手术技术的不断进步,根治性膀胱切除术经历了开放手术、腹腔镜手术和机器人辅助手术3个历史阶段。近年来,机器人辅助腹腔镜根治性膀胱切除(robotic assisted radical cystectomy, RARC)技术逐渐成熟,并在国内外多个中心广泛开展[1]。但作为该手术另一个重要的组成部分,机器人辅助实施全腔镜下尿流改道或原位新膀胱术仍具有较大的挑战[1-2]。目前,国内仅有少数中心完成有限的手术量。我院泌尿外科自2019年6月至2020年8月,成功实施10例RARC+体腔内回肠原位新膀胱术,现将初步经验报告如下。
对象与方法
一、一般资料
本组10例患者均为男性。年龄39~67岁,中位年龄57岁。患者术前至少在一次经尿道膀胱肿瘤电切术后病理诊断为高级别浸润性尿路上皮癌。其中T1期患者1例,T2期患者7例,T3期患者2例。术前美国麻醉医师协会(ASA)评分2分9例,3分1例。术前行新辅助化疗患者3例。
二、手术步骤
1.术前准备:患者手术前3 d开始进半流质饮食,术前1 d清流食,口服复方聚乙二醇电解质散缓泻,术前晚清洁灌肠。手术当天穿戴防血栓袜。麻醉开始前半小时静脉滴注三代头孢抗生素预防感染。
2.手术通道建立:患者全身麻醉后,留置16Fr导尿管排空膀胱内尿液。取30°头低脚高膀胱截石位。采用达芬奇机器人Si手术系统,通过脐部建立气腹,气腹压保持在12 mmHg。在脐上3 cm置入12 mm Trocar,作为观察通道。置入内窥镜后直视下,在脐下缘水平距离观察孔8 cm处,左右分别置入8 mm机器人操作臂通道(1臂和2臂),在右侧距离机器人操作1臂8 cm处,约腋前线置入机器人操作通道(3臂)。在左侧距离机器人操作2臂8 cm处,约腋前线部位置入12 mm Trocar作为辅助通道1,在观察孔与1臂连线中点近头侧5 cm处置入另一12 mm Trocar作为辅助通道2(图1)。机器人主机由患者两腿之间推入,连接各机械臂后,观察孔置入内窥镜,1臂置入单极电剪,2臂置入双极马里兰钳,3臂置入抓钳,手术开始。
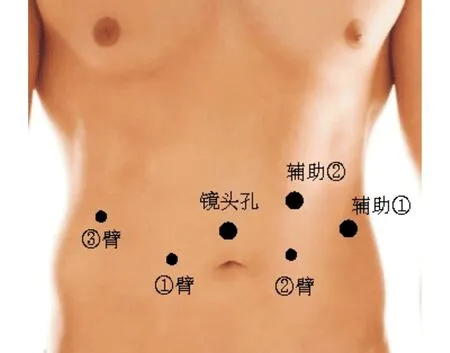
图1 手术通道的建立和各Trocar的位置设定示意图
3.盆腔淋巴结清扫:寻找输尿管跨髂总动脉部位,剪开腹膜及双侧髂总动脉表面的血管鞘直至骨盆入口处。分离出输尿管,清除髂总血管、骼内外血管和闭孔神经血管周围的淋巴脂肪组织。外侧界至腰大肌表面的生殖股神经生殖支,内侧界为输尿管,上界到达至髂总动脉,下界至骨盆内侧面。在清理淋巴结时,需注意对淋巴管的根部进行Hem-o-lok或可吸收夹结扎以防术后出现淋巴漏。在分离右侧输尿管及淋巴结清扫中,我们在乙状结肠背侧向左分离,显露骶前区域,以便在膀胱切除后将左侧输尿管经乙状结肠系膜后方移至右侧进行输尿管新膀胱吻合。
4.膀胱切除:显露双侧输尿管后,在输尿管末端用Hem-o-lok夹闭输尿管两端,并离断。在膀胱直肠凹陷两侧输尿管之间,横行切开腹膜,寻找双侧输精管和精囊,沿精囊表面将其完全分离。在双侧精囊交汇部横行切开狄氏筋膜,沿前列腺背侧分离,尽量靠近前列腺尖部。将镜头方向转为30°上,切开覆盖在膀胱表面的腹膜,显露耻骨后间隙。在盆内筋膜返折处切开盆底筋膜,切断耻骨前列腺韧带,用2-0 V-lok倒刺线结扎缝合背深静脉复合体。用Ligasure离断膀胱及前列腺侧韧带。在前列腺尖部分离出尿道,尽可能保留较长的尿道以供与新膀胱吻合。拔除原导尿管,紧贴前列腺尖部以Hem-o-lok封闭近心端尿道,防止含有肿瘤的尿液外漏引起肿瘤盆腔种植。离断尿道后切除膀胱及前列腺组织。经辅助孔置入标本袋,将标本置入其中,封闭标本袋口。将输尿管残端和尿道残端送快速冷冻病理切片检查,报告尿道切缘为阴性的患者才能进一步构建原位膀胱。
5.构建回肠新膀胱:分离机器臂和Trocar后,将患者体位还原至水平,使部分肠道回纳至盆腔。重新连接机械臂和Trocar。将左侧输尿管由乙状结肠系膜后方穿至右侧(图2A)。将膀胱切除后直肠膀胱间隙处残存的腹膜与尿道直肠肌进行缝合,以加强重建后的膀胱后壁,改善尿控能力,并降低尿道新膀胱吻合口的张力(图2B)。寻找阑尾和回肠末端,从距离回肠末端15 cm处起始逐步将近端拖向尿道残端,以牵拉回肠张力最小的部位作为吻合点,切开肠壁一大小约2 cm开口,采用3-0双针倒刺缝线(2B 408 Ethicon)将肠道后壁与尿道残端后壁缝合(图2C),经尿道置入1根新的18Fr导尿管,继续缝合尿道残端与肠道吻合口的前壁,完成尿道与新膀胱的吻合(图2D)。采用Endo-GIA(60,Ethicon)直线闭合切割器截取肠管(图2E)。近端和远端均分别使用1个组织钉仓离断肠管及部分肠系膜,系膜出血部位使用4-0 Vicryl缝线进行“8”字缝合。使用2个Endo-GIA(60,Ethicon)组织钉仓采取侧壁吻合的方式恢复回肠的连续性(图2F)。采用4-0 Vicryl缝线肠道吻合口浆肌层垂直褥式间断缝合,降低肠吻合口漏的发生率(图2G)。

A:将左侧输尿管由骶前区穿行至右侧;B:缝合尿道直肠肌与膀胱直肠陷窝残留的腹膜;C:缝合新膀胱最低点肠壁浆肌层与尿道直肠肌;D:吻合尿道与新膀胱;E:截取回肠新膀胱;F:恢复回肠连续性;G:加固回肠浆肌层;H:截取回肠段去管化;I:重建新膀胱后壁;J:重建新膀胱前壁;K:重建新膀胱颈部;L:去除新膀胱输入端肠道的黏膜;M:吻合双侧输尿管;N:经腹壁将单J管置入新膀胱;O:输尿管内置入单J管;P:吻合输尿管与新膀胱;Q:固定单J管;R:关闭肠系膜裂口图2 机器人辅助腹腔镜下原位回肠新膀胱的构建具体流程
截取肠道近端留取17 cm,远端留取10 cm后将肠道系膜缘对侧剖开,采用4-0 Vicryl缝线缝合浆肌层(图2H),3-0单针倒刺线“L”型连续全层缝合肠管后壁(图2I),反“L”型连续缝合肠管前壁(图2J)。将导尿管气囊内注入20 ml生理盐水固定导尿管,形成新膀胱(图2K)。去除新膀胱输入端肠道的黏膜(图2L)。腔镜下可见输尿管内侧后方疏松的结缔组织内具有输尿管滋养血管分布,即为输尿管系膜。将双侧输尿管系膜缘对侧剖开约1.5 cm,将两侧输尿管后壁连续缝合,形成皮瓣(图2M),经腹壁穿刺置入2根单J管(图2N),将单J管分别置入左右输尿管内(图2O),并以4-0 Vicryl缝线固定单J管,防止其脱出。4-0 Vicryl缝线缝合输尿管末端皮瓣的前壁,并与新膀胱近端开口进行吻合(图2P)。经导尿管注入250 ml美兰生理盐水充盈新膀胱,检查有无渗漏。对于存在渗漏的部位使用4-0 Vicryl缝线“8”字缝合,并行垂直褥式缝合浆肌层修补(图2Q)。关闭肠系膜切缘裂口,防止肠道内疝发生(图2R)。导尿管球囊内注入30 ml生理盐水。撤除Trocar后经机器1臂Trocar通道留置引流管1根,体腔内位于尿道新膀胱吻合口部位。
三、术后处理
患者术后第1天下床活动。从第1天开始每天使用250 ml碳酸氢钠经导尿管冲洗新膀胱2次,每次膀胱冲洗尽量冲出新膀胱内的肠道黏液,直至无明显黏液栓冲出,每日膀胱冲洗持续到拔除导尿管。患者肠道功能恢复前予以全肠外营养。在经过膀胱造影证实无新膀胱外漏后,开始新膀胱功能训练。夹闭患者导尿管。每2 h练习使用腹压排尿1次,并逐渐将时间延长至4 h[3-4]。当每日引流量少于30 ml,拔除盆腔引流管。术后1个月经尿道膀胱造影无尿外渗,可拔除导尿管。术后3个月拔除双侧输尿管单J管。
结 果
10例患者均成功实施RARC+体腔内原位回肠新膀胱术。手术时间330~550 min,中位手术时间540 min。术中出血量150~600 ml,中位出血量500 ml。10例患者中2例患者术中输血。患者术后住院时间10~19 d,中位时间16 d。患者术后临床病理分期T2bN0M08例,T2bN1M01例,T4N0M01例。术后所有患者病理报告中尿道及双侧输尿管切缘均为阴性。术后2例患者病理报告合并前列腺腺癌。术中清扫淋巴结个数13~28枚,中位数17枚。除1例患者报告1枚淋巴结阳性外,其余患者均未发现淋巴结阳性。所有患者术前和术后肾功能均处于正常范围。最初手术的2例患者分别于术后第10天和第4天因营养不良出现回肠吻合口瘘,均需要行开放回肠瘘修补及横结肠造口。2例患者在3个月后行肠道还纳术。随后的8例患者未出现肠吻合口瘘。2例患者出现术后伤口延期愈合,经二期缝合后痊愈。
讨 论
对于机器人手术与开放手术或腹腔镜手术相比,是否存在优势目前尚无定论[5]。这导致了与机器人辅助腹腔镜前列腺根治性切除术相比,RARC的数量增长趋势较缓。目前主流的观点认为,机器人辅助手术与开放或腹腔镜手术相比,在患者的肿瘤预后和生存方面并无显著优势[6-7]。但通过文献复习结合本中心的经验,机器人辅助手术在以下方面显示出一定的优势。
首先,由于整个输尿管和膀胱重建的过程都位于体腔内,无需将输尿管牵引至体外进行吻合重建。因此,机器人辅助手术中所需游离输尿管的长度较短。开放手术或普通腹腔镜手术常需要游离输尿管至跨髂血管水平以上3~5 cm,而机器人辅助手术只需要游离至输尿管跨髂血管水平即可。如果不考虑行扩大或超扩大盆腔淋巴结清扫范围等影响因素,则输尿管所需游离的长度更短[8-9]。因此,机器人辅助手术中输尿管血供保留更好,术后因输尿管缺血导致输尿管新膀胱吻合口狭窄或吻合口瘘的发生率相对较低[10]。本组患者术后随访过程中未发生输尿管与新膀胱吻合口漏尿。
其次,全体腔内手术吻合尿道和新膀胱时,吻合口张力较小,手术视野清晰,更有利于新膀胱及尿道的重建。因此,吻合口因张力过大导致缺血发生狭窄,或因缝合不确切导致术后吻合口漏尿的几率均有所下降[8]。在吻合尿道及构建新膀胱的流程方面,多数中心采用了先吻合尿道和新膀胱肠道,后截取肠管的流程。仅有极少数的中心采用先完成新膀胱构建,最后进行尿道和新膀胱吻合[9]。本组患者中,我们采用了前者的方式,首先进行尿道新膀胱吻合。我们体会到采用这种方式吻合尿道较可靠,而且在重建新膀胱的过程中,能对肠管操作起到一定的牵引作用,为后续操作提供了便利。此外,术中为了进一步降低吻合口张力,我们将患者最初的头低脚高位还原至水平位,使需要吻合的肠管降入盆腔。该步骤在开放或腹腔镜手术中较容易实现,但在机器人辅助手术中需要重新连接机械臂(Re-docking),一定程度上延长了手术时间。最近一项Meta分析指出,在22项病例数量较多的RARC+体腔内原位膀胱术临床研究中,只有5项研究不需要重新设置体位。其余研究均需要术中将头低脚高位还原至平卧位后方能完成构建原位新膀胱[9]。
再次,全腔镜下手术整个过程中无腹腔脏器暴露,体液散失少,肠道功能恢复快[10-11]。本组患者中,除2例患者外,其余均在术后3 d内恢复肠道功能,并开始进清流食。需要指出的是,本组患者中最初2例患者术后发生肠瘘。通过回顾性分析患者的围手术期情况,我们考虑导致患者肠瘘的主要原因是患者术前营养状况较差,术后肠外营养补充不足,进而导致患者肠道功能难以恢复,最终发生肠瘘。因此,除了手术操作细节外,营养支持也是影响患者预后的重要因素[12-14]。在随后的8例患者中,我们通过术前改善营养状况,术后予以积极营养支持,患者肠道功能均能早期恢复正常。
对于原位新膀胱的构建,传统上要求遵照Laplace定律,即对于去管化肠道进行两次折叠,使新膀胱呈“球形”,保证较大的储尿容积和较低的新膀胱内压力,进而防止尿失禁的发生和膀胱输尿管反流引起肾功能受损[10-11,14]。由于在全腔内操作流程较复杂,我们采用了正反“L”型的肠道折叠方法,简化了手术步骤,缩短了手术时间,在减少肠道缝合次数的同时,也降低了新膀胱漏的发生率。在随访期内,尚未发现因新膀胱容量不足引起尿失禁和肾功能损伤。但患者的远期预后尚有待进一步随访观察。本组患者在输尿管新膀胱吻合过程中均未采用抗反流技术,术后随访期内未发生输尿管狭窄,也未出现因新膀胱输尿管反流继发肾功能损伤。
目前,国内外各大诊疗指南已将新辅助化疗作为根治性膀胱切除术前推荐的治疗方案。但除一些较大的中心外,国内新辅助化疗尚未广泛开展。本组患者中有3例接受了新辅助化疗。新辅助化疗未增加这些患者的手术难度。此外,3例患者术后病理检查均提示切缘为阴性,可见患者可能在肿瘤预后方面获益。因此,我们认为对于拟行根治性膀胱切除加原位膀胱术的高危膀胱癌患者,术前应常规推荐接受新辅助化疗。
本组研究的不足之处在于患者数量较少,这主要是由于主观上我们对该新方法的认知能力及操作水平有待进一步提高,客观上我们需严格把握施行原位新膀胱患者的手术指征,主要包括无肝肾功能损伤、无尿道切缘阳性、非远处转移的患者,且能够配合随访和新膀胱功能训练等[14-16]。严格遵照原位新膀胱的适应证才能使患者获得良好预后的同时,避免各种并发症的发生。另一方面,与以往开放手术相比,本研究中机器人辅助手术时间明显延长。这可能源于该项技术在我中心尚处于开展的起步阶段。随着手术技术流程的成熟和学习曲线的不断延伸,在保证手术质量的前提下,手术时间有望缩短。
本组研究数据初步表明,RARC+体腔内原位回肠新膀胱术在技术上具有可行性和安全性。通过严格把握患者适应证、围手术期全面管理、术中仔细操作,在成熟开展机器人技术的中心能使患者达到较满意的近期预后。对于远期预后尚有待大量研究进一步评估。
