蚕沙解磷菌株SEM-5的分离鉴定及其溶磷作用
2021-08-02李庆荣廖森泰邢东旭肖阳赵超艺杨琼
李庆荣 廖森泰 邢东旭 肖阳 赵超艺 杨琼

摘要:【目的】蠶沙中不仅富含营养物质,还含有大量微生物资源,筛选出蚕沙中的高效解磷菌并对其解磷机理进行探讨,为微生物肥料的开发利用提供资源。【方法】以高温发酵期的蚕沙为材料,通过无机磷筛选培养基定向筛选获得耐高温的解磷菌1株;通过生理生化及分子生物学方法进行分类鉴定;利用钼锑抗比色法和高效液相色谱法进行有效磷和有机酸含量的定量分析;通过SPSS 11.0对相关数据进行统计分析。【结果】从高温堆肥发酵过程中的蚕沙中筛选获得1株白色圆形菌落的菌株,菌体长杆状、革兰氏染色阳性;通过基因组测序获得其全长基因组大小为5324477 bp,GC含量为37.73%,37个Scaffolds,73个Contigs,注释基因5628个、tRNA 48个及rRNA 1个;基因组序列比对分析鉴定为巨大芽孢杆菌,命名为SEM-5。该菌株具有较强的耐受盐(NaCl浓度≤10%)碱(pH 5~10)及高温(60 ℃)能力;对不同无机磷的解磷效果不同,其中对钙盐来源的无机磷溶解效率显著高于磷酸铝和磷酸铁(P<0.05,下同)。对不同发酵时间SEM-5菌株发酵液的有效磷浓度、有机酸含量和发酵液pH等进行检测及相关分析,结果表明不同发酵时间的SEM-5菌株发酵液中有效磷浓度与不同有机酸的相关性不同;在0~14 d的发酵过程中,有效磷浓度与乙酸和酒石酸含量呈极显著正相关(P<0.01,下同),与乳酸、琥珀酸和丙酸含量呈显著正相关;与发酵液pH和草酸含量分别呈极显著和显著负相关,与苹果酸和柠檬酸含量则无显著相关性(P>0.05)。【结论】分离自蚕沙的巨大芽孢杆菌(SEM-5菌株)具有很好的环境适应性,耐盐碱和高温,且能高效地溶解释放钙盐中的磷元素,具有良好的微生物肥料开发应用潜力。
关键词: 蚕沙;巨大芽孢杆菌;解磷菌;分离鉴定;有机酸
中图分类号: S879.9 文献标志码: A 文章编号:2095-1191(2021)03-0797-09
Isolation and identification of phosphate-solubilizing strain SEM-5 from silkworm excrement and its phosphorus dissolution function
LI Qing-rong1,2, LIAO Sen-tai1, XING Dong-xu1,2, XIAO Yang1,
ZHAO Chao-yi1*, YANG Qiong1,2*
(1The Sericulture and Agri-food Research Institute,Guangdong Academy of Agricultural Sciences, Guangzhou 510610,China; 2Key Laboratory of Urban Agriculture in South China, Ministry of Agriculture and Rural Affairs,
Guangzhou 510610, China)
Abstract:【Objective】Silkworm excrement is not only rich in nutrients,but also a variety of functional microorga-nisms. In this study,in order to provide resources for the development and utilization of microbial fertilizer,some high efficient phosphate dissolving bacteriawere screened and its phosphate dissolving mechanism was discussed preliminarily. 【Method】A high temperature resistant strain with high efficiency of inorganic phosphorus hydrolysis was screened from the silkworm excrement through the inorganic phosphorus screening medium,and classified using the methods of physio-logy,biochemistry and molecular biology; the soluble phosphorus and the organic acid contents were quantitatively determined by the methods of the molybdenum antimony anti colorimetry and the high performance liquid chromatography(HPLC),respectively. The relevant data was statistical analyzed by the SPSS statistics software. 【Result】A strain was screened from silkworm excrement during high temperature composting fermentation. The strain was white round colony,rod-shaped and gram positive. Full-length genome sequence was obtained by genome sequencing. The genome size was 5324477 bp, GC content was 37.73%,37 Scaffolds,73 Contigs, a total of 5628 genes were predicted along with 48 tRNAs and one rRNA. It was classified as Bacillus megaterium,named SEM-5,which had a marked function of dissolving inorganic phosphorus and strong tolerance of salt(NaCl concentration≤10%),alkali(pH 5-10) and high temperature(60). The result showed that the dissolving inorganic phosphorus ability of the strain on different sources was diffe-rent. The dissolution efficiency of inorganic phosphorus from calcium salt was significantly higher than that of aluminum phosphate and iron phosphate(P<0.05, the same below). The data of available phosphorus concentration,organic acid and pH of SEM-5 strain fermentation broth in different fermentation times were detected and analyzed,and correlation analysis showed that the correlation between the concentration of soluble phosphorus and different organic acids was different in different fermentation times. The concentration of soluble phosphorus in fermentation broth had an extremely significant positive correlation with the content of acetic acid and tartaric acid (P<0.01, the same below),and had a significant positive correlation with the content of lactic acid,succinic acid,propionic acid in fermentation broth, and had a extremely significant negative,significant negative correlation with pH of the fermentation broth and the content of oxalic acid,respectively,but had no significant difference with malic acid and citric acid contents(P>0.05), from the beginning to day14 of the fermentation. 【Conclusion】B. megaterium isolated from silkworm excrement(strain SEM-5) has good environmental adaptability,including tolerance to salt,alkali and high temperature,and exhibits a good dissolving and releasing ability for inorganic phosphorus from insoluble calcium source. It has a good application potential and development value of microbial fertilizer.
Key words: silkworm excrement; Bacillus megaterium; phosphate-solubilizing bacteria; isolation and identification; organic acid
Foundation item: Key-area Research and Development Project of Guangdong(2018B020206001); General Project of Guangzhou Science Research(201904010086); Team Building Project of Guangdong Academy of Agricultural Scien-ces in the 13th Five-Year Plan Period(201801xx)
0 引言
【研究意义】磷是植物生长发育所必需的大量元素,也是植物体内核酸、蛋白质和酶等多种重要化合物的组成元素,在光合作用、能量转移、信号转导、呼吸代谢及大分子生物合成等主要代谢过程中均具有重要作用(Rodríguez and Fraga,1999;Elser,2012;Anand et al.,2016;Wu et al.,2019)。我国大部分的土壤都缺乏足够的可供作物吸收利用的有效磷(向万胜等,2004)。土壤磷素供给不足是制约作物生长发育的主要原因之一。活化土壤中的难溶性磷和增强土壤有效磷的供给能力一直是人们关注的重要问题,确保对农业可持续发展具有重要意义。已有研究表明,在合适的理化因素和微生物的作用下,土壤中的难溶性磷、钾等矿物质可被释放出来,提升土壤肥力,促进植物吸收营养物质(Alori et al.,2017;Gouda et al.,2018)。有效利用微生物对土壤矿物质进行分解,已成为提高土壤肥力有效化利用的重要途径之一,但不同微生物对不同矿物质的降解效率有所差异,因此有目的地分离鉴定高效溶磷菌株,可为微生物肥料的开发利用提供资源,对当前农业生产过程中降低化肥使用量并提高化肥利用效率具有重要意义。【前人研究进展】微生物与土壤磷之间的关系研究始于20世纪初,Sackett等(1908)发现一些细菌可将不溶的天然磷矿石溶解利用,这类可将土壤中难以利用的磷酸盐分解为植物能吸收的有效磷的微生物被称为解磷微生物。我国对解磷微生物的研究始于20世纪50年代(冯月红等,2003),至今越来越多的微生物菌株被发现具有溶解释放矿物质磷的潜力。已报道的解磷菌包括解磷细菌、解磷真菌和解磷放线菌等,主要来源于不同作物根际土壤(王浩等,2014;魏伟等,2014;柯春亮等,2015;邢芳芳等,2016;徐欢等,2016),也有分离自药渣、酒糟等废弃物(王明欢等,2020;张芮瑞等,2020)。在土壤中,解磷细菌占解磷微生物总量的1%~50%,主要有芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、土壤杆菌属(Agrobcterium)、微球菌属(Micrococcus)、固氮菌属(Azotobacter)、根瘤菌属(Bradyrhizobium)、欧文氏菌属(Erwinia)和沙雷氏菌属(Serratia)等(Rodríguez et al.,2001;Vyas and Gulati,2009;Liu et al.,2012;Nosrati et al.,2014;Behera et al.,2017)。解磷微生物的解磷过程十分复杂,机制多样(Zhu et al.,2018),主要包括:(1)微生物产生有机酸解磷,有机酸解磷是最主要的解磷方式,一方面有机酸的分泌可降低pH,另一方面有机酸通过与金属离子的螯合作用而促进磷酸根被释放(Cunningham and Kuia-ck,1992;Kim et al.,1997),但不同解磷菌株分泌释放的有机酸种类与数量存在差异,解磷能力也不同(秦利均等,2019)。(2)微生物代谢释放CO2和H+,降低其生长环境的pH,从而促使不溶性磷被溶出,朱培淼等(2007)研究发现发酵液pH降低与解磷菌的解磷能力相关性很高。(3)微生物代谢分泌相关酶的酶解作用,酶解也是相当重要的一个解磷机制,细胞分泌出的酸性磷酸酶、碱性磷酸酶及植酸酶等可加速有机化合物分解,从而促进有机磷释放。此外,Ghani等(1994)报道认为H2S等的产生,也会促进磷酸根释放。【本研究切入点】蚕沙是养蚕过程中的主要废弃物,不仅富含营养物质,还含有丰富的微生物菌群,包括大量解磷、解钾、固氮、拮抗及降解有机物等功能的菌株,显示出明显的微生物多样性(Li et al.,2018),但目前关于蚕沙中微生物的研究利用较少。【擬解决的关键问题】以堆肥发酵的蚕沙为材料,通过微生物培育技术筛选并分离蚕沙中的高效解磷菌株,对其生理生化特性及其溶磷作用进行探讨,解析影响菌株溶磷效率的因素,旨在为微生物肥料的开发利用提供资源。
1 材料与方法
1. 1 试验材料
蚕沙原料由广东省农业科学院蚕业与农产品加工研究所在家蚕品种资源繁育过程中收集,经好氧堆肥发酵腐熟。蚕沙样品即为好氧堆肥发酵的高温期样品。巨大芽孢杆菌(Bacillus megaterium,编号GW-1-0201-1305-04)购自广州市微元生物科技有限公司。草酸、酒石酸、苹果酸、乳酸、乙酸、柠檬酸、琥珀酸和丙酸标准品均购自上海麦克林生化科技有限公司。细菌基因组提取试剂盒(TaKaRa,货号:DV810A)购自宝生物工程(大连)有限公司。主要仪器设备:LC-100高效液相色谱仪(上海伍丰科学仪器有限公司)和反相色谱柱(月旭AQ-C18,250 mm×4.6 mm,5 μm)。
无机磷选择性培养基:葡萄糖10.0 g,Ca3(PO4)2 5.0 g,(NH4)2SO4 0.5 g、NaCl 0.2 g,KCl 0.2 g,MgSO4·7H2O 0.1 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,酵母粉0.5 g,蒸馏水1000 mL,pH 6.8~7.2。
NA培养基:牛肉膏3.0 g,蛋白胨5.0 g,NaCl 5.0 g,琼脂粉18 g,蒸馏水1000 mL,pH 7.2~7.4。
NB培养基:牛肉膏3.0 g,蛋白胨5.0 g,NaCl 5.0 g,蒸馏水1000 mL,pH 7.2~7.4。
1. 2 菌株分离
蚕沙样品参照Li等(2018)的方法进行稀释。各取100 μL不同级稀释液涂板在无机磷选择性培养基上,37 ℃恒温倒置培养3~5 d。挑选长势良好的单个菌落,在NA培养基上继续划线分离纯化2代。纯化后的菌株保存在NA斜面培养基上,4 ℃保存备用。
1. 3 菌株基因组序列测序与分析
将分离得到的菌株分别接种于5 mL NB液体培养基的试管中,37 ℃下200 r/min振荡培养过夜,离心,取沉淀的菌体,根据TaKaRa细菌基因组提取试剂盒操作说明提取菌株的基因组序列,电泳检测完整性及纯度,委托华大基因科技服务有限公司进行全基因组序列测序。测序原始数据下机后,清除掉低质量的数据和接头数据,获得Clean data,并用SOAPdenovo(www.soap.genomics.org.cn)对测序数据进行组装。针对组装结果,分别利用Glimmer、rRNAmmer和tRNAscan进行基因注释、rRNAs和tRNAs序列及其二级结构预测分析与分类预测(Ashburner et al.,2000;Kanehisa et al.,2006;Lagesen et al.,2007)。
1. 4 菌株生长特征鉴定
以NA培养基为基础培养基,调整不同培养温度(30~60 ℃)、培养基pH(4~10)及NaCl浓度(2%~12%),通过测定不同培养时间菌液菌体量(OD600 nm),分析温度、pH和渗透压(NaCl浓度)对分离菌生长的影响。
1. 5 菌株对不同来源无机磷的溶解
分别以磷酸钙、磷酸氢钙、磷酸铝和磷酸铁4种无机磷作为唯一磷源,配制液体无机磷筛选培养基,按1%的比例加入活化液体菌株和对照菌巨大芽孢杆菌(CK),37 ℃下200 r/min振荡培养4 d后取样,6000 r/min离心10 min,取上清液。上清液中的磷浓度采用钼锑抗比色法检测(Rice et al.,1995)。
1. 6 不同发酵时间下菌株发酵液中有效磷及发酵液pH的变化
菌株接种至以磷酸钙为唯一磷源的100 mL液体无机磷培养基中,37 ℃下200 r/min振荡培养,分别于培养0、2、4、6、8、10、12和14 d时取样,6000 r/min离心10 min,取上清液。上清液pH用pH计测定,有效磷浓度用1.5的方法检测。
1. 7 不同发酵时间下菌株发酵液中有机酸浓度测定
利用高效液相色谱(HPLC)法测定菌株不同发酵时间上清液中草酸、酒石酸、苹果酸、乳酸、乙酸、柠檬酸、琥珀酸和丙酸等8种有机酸的含量。
1. 7. 1 标准曲线测定 首先测定草酸、酒石酸、苹果酸、乳酸、乙酸、柠檬酸、琥珀酸和丙酸等8种有机酸的标准曲线。其中,丙酸测定是以乙腈和0.02%磷酸水为流动相,设定流速0.7 mL/min,柱温25 ℃,保留时间15 min,波长210 nm;其他7种有机酸以甲醇和磷酸二氢钠水溶液為流动相,设定流速0.6 mL/min,柱温30 ℃,保留时间20 min,波长214 nm。
1. 7. 2 样品收集与处理 选用磷酸钙为唯一磷源的筛选培养基作为菌株发酵培养基,在不同发酵时间(0、2、4、6,8、10、12和14 d)下取样,离心收集上清液,用0.22 μm针头式过滤器过滤到样品瓶内,按不同有机酸测定方法测定样品溶液中的8种有机酸浓度。
1. 8 统计分析
采用SPSS 11.0对试验数据进行整理、制图及相关分析。
2 结果与分析
2. 1 菌株的分离鉴定结果
对堆肥发酵过程中的蚕沙取样处理后,通过无机磷筛选培养基进行筛选,根据溶磷圈大小、菌株形态等获得1株在无机磷培养基上生长良好、溶磷圈明显的菌株,将其命名为SEM-5。该菌株的菌落呈白色,圆形或椭圆形,表面光滑,菌体长杆状,革兰氏染色结果表明其为革兰氏阳性菌(图1)。
2. 2 SEM-5菌株的基因组序列特征
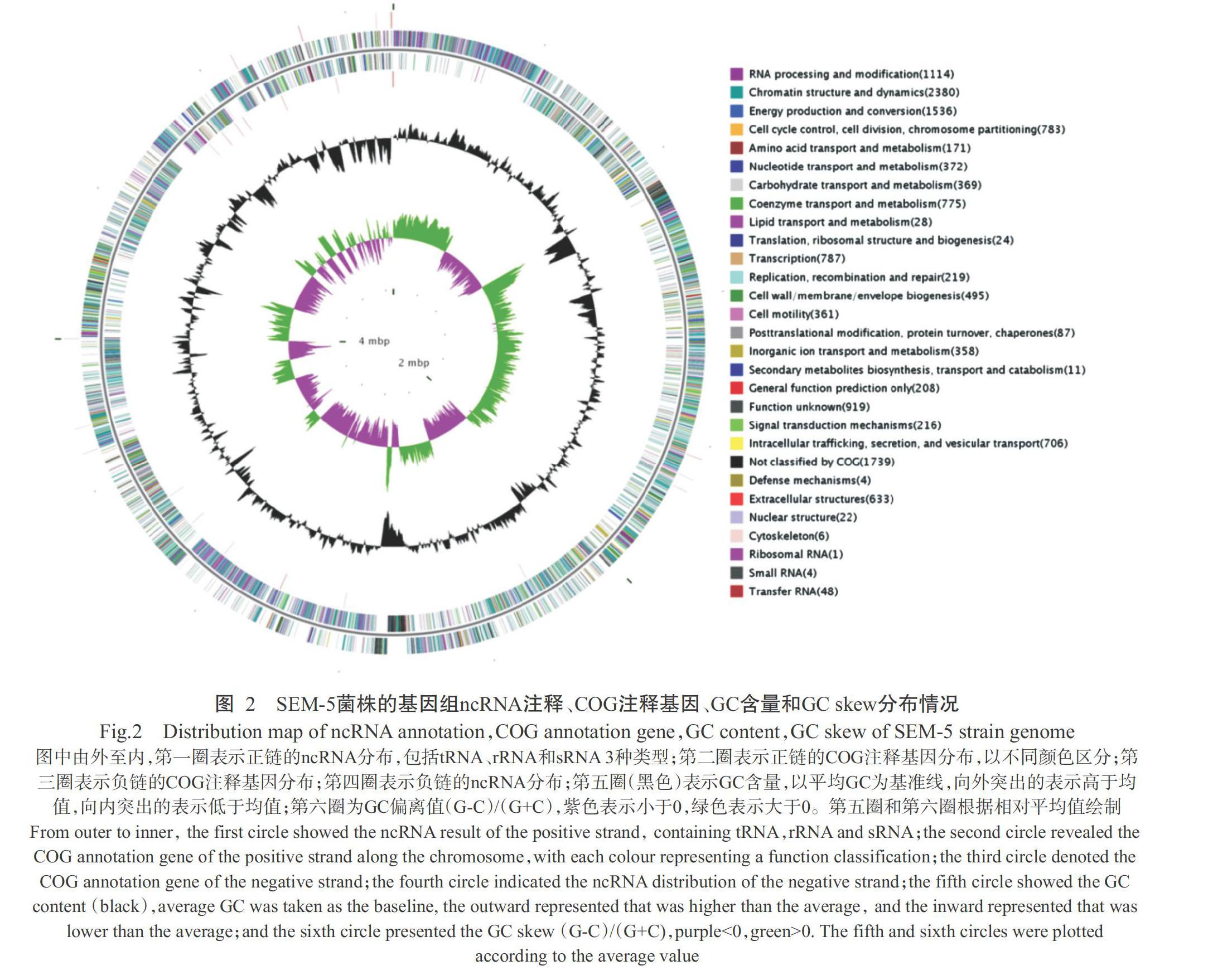
通过Illumina HiSeq 4000平台测序,从SEM-5菌株共测得650 Mb的测序数据。基于测序数据组装得知,SEM-5菌株基因组大小为5324477 bp,GC含量为37.73%,共有37个Scaffolds和73个Contigs。基因组组分分析发现,SEM-5菌株的基因组含有5628个基因、tRNA 48个及rRNA 1个(图2),测序组装分析结果上传至GenBank数据库,提交编码:No. NGUM-00000000。测序组装序列经BLAST比对分析,鉴定该菌株为巨大芽孢杆菌(B. megaterium)。
2. 3 SEM-5菌株的生长特性
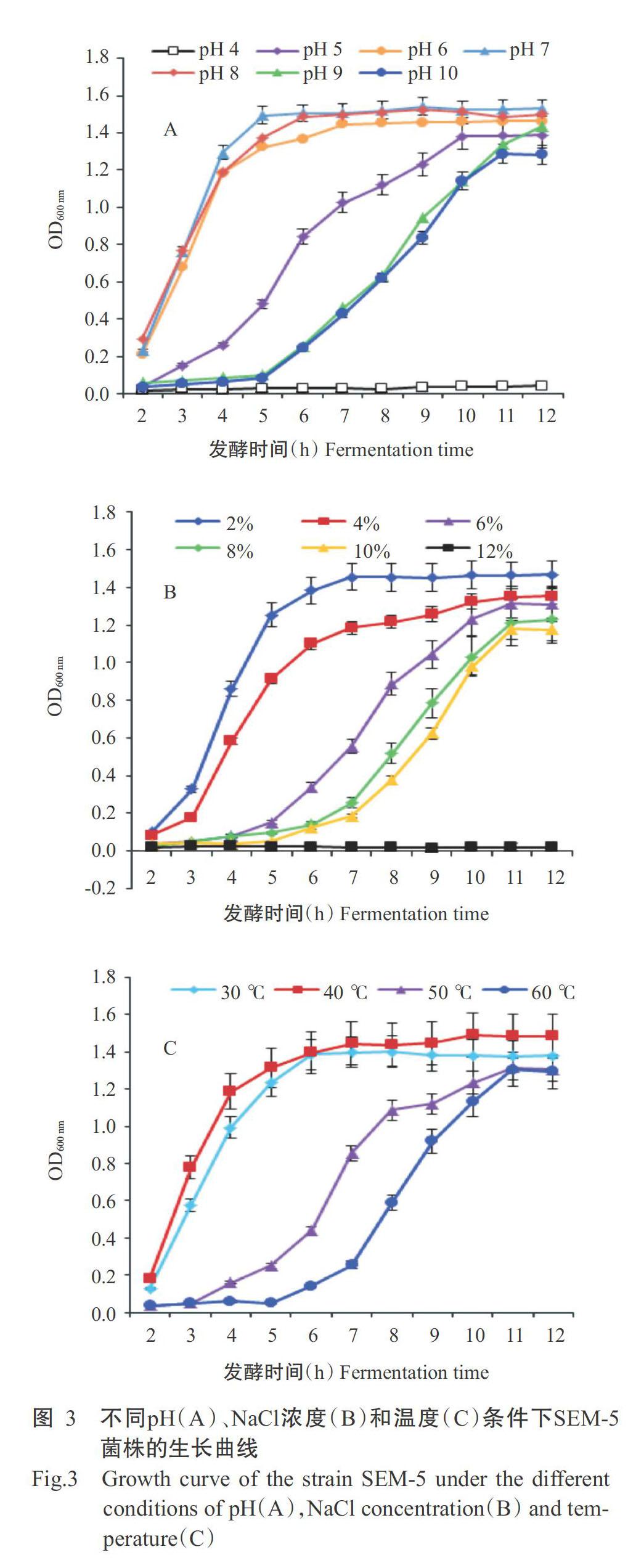
以NA培养基为基础培养基,通过检测不同生长时间OD600 nm的变化,分析不同生长温度、pH及NaCl浓度对SEM-5菌株生长的影响,结果表明该菌株生长适应性很强。SEM-5菌株的最适生长pH范围为6~8,但耐受pH范围在5~10,过酸的环境下(pH 4)菌株难以增殖(图3-A);在检测的NaCl浓度范围内,2%浓度下菌株的增殖速度最快,随着浓度升高,菌株增殖速度降低,直至10%浓度下仍可生长繁殖,但超过该浓度后,菌株难以增殖(图3-B);SEM-5菌株的最适生长温度范围为30~40 ℃,但在60 ℃高温下仍可生长(图3-C)。
2. 4 SEM-5菌株对不同来源无机磷溶解能力的测定结果
由图4可知,SEM-5菌株对磷酸氢钙和磷酸钙的溶解能力较强,培养基上清液中有效磷浓度分别达524.2和235.5 mg/L,对磷酸铝中也有一定的溶解释放能力。以磷酸氢钙和磷酸铝为磷源时SEM-5菌株发酵上清液中的有效磷浓度极显著高于对照菌(P<0.01,下同),以磷酸钙为磷源时其有效磷浓度显著高于对照菌(P<0.05,下同);但在以磷酸铁为唯一磷源的培养基中,SEM-5菌株和对照菌的发酵上清液中有效磷浓度近乎为0。
2. 5 不同发酵时间下SEM-5菌株生长曲线、发酵液pH及其对磷酸钙溶解能力的测定结果
以磷酸钙为磷源,连续发酵SEM-5菌株,一部分样品通过比浊法定时检测OD600 nm,分析发酵液中SEM-5菌株的生长情况,结果发现OD600 nm在发酵第4 d时达最高值,且在第8 d后又有一定程度的升高(图5-A);一部分样品进行离心,测定发酵液中的pH和有效磷浓度,结果发现发酵液pH呈先下降后上升的变化趋势,在发酵第2~4 d时达最低值(pH 5.4),在第6 d开始上升至5.8,维持该pH至第14 d无明显变化(图5-B);在菌株发酵第4 d时发酵液中的有效磷浓度达最高值233.3±13.5 mg/L,之后开始缓慢下降(图5-C)。
2. 6 不同发酵时间下SEM-5菌株發酵液中有机酸含量的变化
利用HPLC法测定不同发酵时间下SEM-5菌株发酵液中8种有机酸的含量,结果(图6)发现各种有机酸分泌量均随发酵时间的变化而变化,其中乙酸和乳酸含量最高,在发酵第4 d分别达1413.57和1196.03 mg/L,并在第8 d降至最低,在发酵液中含量的变化规律与SEM-5菌株发酵生长的OD600 nm相似;琥珀酸、酒石酸、丙酸和苹果酸也有类似的规律,但在发酵液中的含量低于乙酸和乳酸;柠檬酸和草酸在发酵液中的含量变化规律与此不同,基本表现为缓慢升高趋势。
2. 7 SEM-5菌株有效磷释放影响因素相关分析结果
由表1可知,在0~8 d的发酵过程中,SEM-5菌株发酵液中有效磷浓度与柠檬酸、酒石酸含量和OD600 nm呈极显著正相关,与发酵液pH呈极显著负相关,与发酵液中乳酸、琥珀酸和乙酸含量呈显著正相关,与草酸含量呈显著负相关,而苹果酸和丙酸含量与该发酵时间内的有效磷释放无显著相关性(P>0.05,下同)。在8~14 d的发酵过程中,SEM-5菌株发酵液中有效磷浓度与酒石酸和丙酸含量呈显著正相关,与草酸和柠檬酸含量分别呈显著或极显著负相关,但与苹果酸、乳酸、乙酸、琥珀酸含量、pH和OD600 nm无显著相关性。在0~14 d的发酵过程中,SEM-5菌株发酵液中有效磷浓度与酒石酸、乙酸含量及OD600 nm呈极显著正相关,与发酵液pH呈极显著负相关,与乳酸、琥珀酸和丙酸含量及所测有机酸总量呈显著正相关,与苹果酸和柠檬酸含量无显著相关性。
3 讨论
磷是植物生长所需的一种主要营养元素,但土壤中大部分磷不能被植物吸收利用,而严重影响植物生长。解磷菌能将植物难以吸收利用的难溶性或不溶性磷转化为可利用形态,提高土壤中磷素利用效率,可有效减少化学肥料施用。但不同微生物菌株对不同磷源的磷溶解效率差异明显,选择高效的解磷菌株并有针对性地用于不同环境是解磷菌在农业生产上推广应用的重要环节。本研究筛选获得的SEM-5菌株具有很强的释放磷酸钙和磷酸氢钙中磷素的能力,而对磷酸铁中的磷酸释放能力相对较弱。由于我国不同地域的土壤中矿物质磷成分不同,大多数是以钙盐的形式存在,因此,SEM-5菌株在无机磷以钙盐为主要存在形式的区域可能有良好的应用前景。
微生物溶磷机理较复杂,研究显示解无机磷细菌多与分泌有机酸有关(Sane and Mehta,2015)。秦利均等(2019)对溶磷菌的解磷机制进行综述,发现已报道溶磷菌产生的小分子有机酸种类繁多,包括葡萄糖酸、草酸、乳酸、乙酸、丙酸、琥珀酸、苹果酸和柠檬酸等,且微生物菌种不同,其产酸的种类与含量及溶磷能力也各不相同,其中芽孢杆菌类解磷菌主要产生乙酸、柠檬酸、苹果酸、奎宁酸和葡萄糖酸等。本研究对SEM-5菌株分泌的8种小分子有机酸进行检测及相关分析,结果发现不同发酵时间的SEM-5菌株发酵液中有效磷浓度与不同有机酸的相关性不同,进一步证实解无机磷细菌分泌有机酸与无机磷溶解的复杂关系。发酵液中的柠檬酸含量在14 d发酵过程中呈缓慢上升趋势,发酵液中有效磷则呈先上升后缓慢下降的变化趋势,因此分段分析后发现,在0~8 d的发酵过程中柠檬酸含量与发酵液中有效磷浓度呈极显著正相关,在8~14 d的发酵过程中则呈极显著负相关,而在0~14 d的发酵过程中显示无显著相关性;丙酸则相反,在0~8 d的发酵过程中其含量与发酵液中有效磷浓度无显著相关性,但在8~14 d和0~14 d的发酵过程中呈显著正相关。综合分析整个发酵过程(0~14 d)发现,酒石酸和乙酸对发酵液中有效磷的释放可能贡献最大,呈极显著正相关。此外,葡萄糖酸和奎宁酸未在SEM-5菌株发酵液中检测到,与秦利均等(2019)总结的芽孢杆菌类菌株分泌的有机酸略有不同,但也充分说明微生物菌株解磷机理的复杂性,即使是同样的酸解原理,也会因菌株种类不同而存在差异,与Deubel等(2000)的研究结果一致。此外,因SEM-5菌株在发酵过程中产生大量的有机酸,发酵液pH呈酸性,与有效磷浓度呈极显著负相关,与赵小蓉等(2003)、李海云等(2018)的研究结果一致。
4 结论
SEM-5菌株具有很好的环境适应性,耐盐碱和高温,且能高效溶解释放钙盐中的磷元素,具有良好的微生物肥料开发应用潜力。
参考文献:
冯月红,姚拓,龙瑞军. 2003. 土壤解磷菌研究进展[J]. 草原与草坪,(1):3-7. doi:10.13817/j.cnki.cyycp.2003.01.001. [Feng Y H,Yao T,Long R J. 2003. Research progress of phosphate-dissolving microorganisms in plant rhizosphere[J]. Grassland and Turf,(1):3-7.]
柯春亮,陈宇丰,周登博,黄绵佳,张锡炎,高祝芬. 2015. 香蕉根际土壤解磷细菌的筛选、鉴定及解磷能力[J]. 微生物学通报,42(6):1032-1042. doi:10.13344/j.microbiol.china.140684. [Ke C L,Chen Y F,Zhou D B,Huang M J,Zhang X Y,Gao Z F. 2015. Isolation,identification and phosphate solubilization analysis of phosphate-solubilizing bacteria derived from banana rhizosphere soil[J]. Microbiology China,42(6):1032-1042.]
李海云,姚拓,张榕,张洁,李智燕,荣良燕,路晓雯,杨晓蕾,夏东慧,罗慧琴. 2018. 红三叶根际溶磷菌株分泌有机酸与溶磷能力的相关性研究[J]. 草业学报,27(12):113-121. doi:10.11686/cyxb2018066. [Li H Y,Yao T,Zhang R,Zhang J,Li Z Y,Rong L Y,Lu X W,Yang X L,Xia D H,Luo H Q. 2018. Relationship between organic acids secreted from rhizosphere phosphate-solubilizing bacteria in Trifolium pratense and phosphate-solubilizing ability[J]. Acta Prataculturae Sinica,27(12):113-121.]
秦利均,杨永柱,杨星勇. 2019. 土壤溶磷微生物溶磷、解磷机制研究进展[J]. 生命科学研究,23(1):59-64. doi:10.16605/ j.cnki.1007-7847.2019.01.009. [Qin L J,Yang Y Z,Yang X Y. 2019. Advances in mechanisms of soil solubilization and dissolution by phosphate solubilizing microorganisms[J]. Life Science Research,23(1):59-64.]
王浩,姜妍,刘伟,李远明,于佳,王绍东. 2014. 大豆根际高效溶磷菌株的分离及溶磷能力分析[J]. 大豆科学,33(3):404-407. [Wang H,Jiang Y,Liu W,Li Y M,Yu J,Wang S D. 2014. Isolation and analysis on ability of phosphate dissolving bacteria in rhizosphere of soybean[J]. Soybean Science,33(3):404-407.]
王明欢,张小娜,林冰,邓锦辉,张英. 2020. 中药药渣中固氮菌、解磷菌、解钾菌的筛选[J]. 中成药,42(2):531-533. doi:10.3969/j.issn.1001-1528.2020.02.053. [Wang M H,Zhang X N,Lin B,Deng J H,Zhang Y. 2020. Screening of nitrogen-fixing bacteria,phosphorus dissolving bacteria and potassium dissolving bacteria in the residue[J]. Chinese Traditional Patent Medicine,42(2):531-533.]
魏伟,吴小芹,乔欢. 2014. 马尾松根际高效解磷真菌的筛选鉴定及其促生效应[J]. 林業科学,50(9):82-88. doi:10. 11707/j.1001-7488.20140911. [Wei W,Wu X Q,Qiao H. 2014. Screening and identification of phosphate-solubili-zing fungi of Pinus massoniana rhizosphere and its application[J]. Scientia Silvae Sinicae,50(9):82-88.]
向万胜,黄敏,李学垣. 2004. 土壤磷素的化学组分及其植物有效性[J]. 植物营养与肥料学报,10(6):663-670. doi:10. 3321/j.issn:1008-505X.2004.06.021. [Xiang W S,Huang M,Li X Y. 2004. Progress on fractioning of soil phosphorous and availability of various phosphorous fractions to crops in soil[J]. Plant Nutrition and Fertilizer Science,10(6):663-670.]
邢芳芳,高明夫,禚优优,胡兆平,李新柱. 2016. 大麦根际高效溶磷菌的筛选、鉴定及促生效果研究[J]. 华北农学报,31(S1):252-257. [Xing F F,Gao M F,Zhuo Y Y,Hu Z P,Li X Z. 2016. Screening and identification of phosphate solubilizing bacteria in Hordeum vulgare rhizosphere and its growth promoting effect[J]. Acta Agriculturae Boreali-Sinica,31(S1):252-257.]
徐歡,俞新玲,林勇明,吴承祯,谢安强,陈灿,李键,洪滔. 2016. 桉树根际土壤解磷细菌的分离、筛选及其解磷效果[J]. 福建农林大学学报(自然科学版),45(5):529-535. doi:10.13323/j.cnki.j.fafu(nat.sci.).2016.05.009. [Xu H,Yu X L,Lin Y M,Wu C Z,Xie A Q,Chen C,Li J,Hong T. 2016. Isolation,screening of phosphate solubilizing capacity of phosphate solubilizing bacteria in Eucalyptus species[J]. Journal of Fujian Agriculture and Fo-restry University(Natural Science Edition),45(5):529-535.]
张芮瑞,邱树毅,周少奇,王雪郦. 2020. 丢糟和磷矿粉高温堆肥中耐高温解磷菌的筛选及性能分析[J]. 生物技术通报,36(5):110-119. doi:10.13560/j.cnki.biotech.bull.1985. 2019-1150. [Zhang R R,Qiu S Y,Zhou S Q,Wang X L. 2020. Screening and performance analysis of high-temperature phosphate-solubilizing microorgams in high temperature compost with phosphate rock and discarded vinasse lost grains[J]. Biotechnology Bulletin,36(5):110-119.]
赵小蓉,林启美,李保国. 2003. 微生物溶解磷矿粉能力与pH及分泌有机酸的关系[J]. 微生物学杂志,23(3):5-7. doi:10.3969/j.issn.1005-7021.2003.03.002. [Zhao X R,Lin Q M,Li B G. 2003. The relationship between rock phosphate solubilization and pH and organic acid production of microorganisms[J]. Journal of Microbiology,23(3):5-7.]
朱培淼,杨兴明,徐阳春,欧阳红,沈其荣. 2007. 高效解磷细菌的筛选及其对玉米苗期生长的促进作用[J]. 应用生态学报,18(1):107-112. [Zhu P M,Yang X M,Xu Y C,Ouyang H,Shen Q R. 2007. High effective phosphate-solubilizing bacteria:Their isolation and promoting effect on corn seedling growth[J]. Chinese Journal of Applied Ecology,18(1):107-112.]
Alori E T,Glick B R,Babalola O O. 2017. Microbial phosphorus solubilization and its potential for use in sustaina-ble agriculture[J]. Frontiers in Microbiology,8:971. doi:10.3389/fmicb.2017.00971.
Anand K,Kumari B,MallickM A. 2016. Phosphate solubili-zing microbes:An effective and alternative approach as biofertilizers[J]. International Journal of Pharmacy and Pharmaceutical Sciences,8(2):37-40.
Ashburner M,Ball C A,Blake J A,Botstein D,Butler H,Cherry J M,Davis A P,Dolinski K,Dwight S S,Eppig J T,Harris M A,Hill D P,Issel-Tarver L,Kasarskis A,Lewis S,Matese J C,Richardson J E,Ringwald M,Rubin G M,Sherlock G. 2000. Gene ontology:Tool for the unification of biology[J]. Nature Genetics,25(1):25-29.
Behera B C,Yadav H,Singh S K,Mishra R R,Sethi B K,Dutta S K,Thatoi H N. 2017. Phosphate solubilization and acid phosphatase activity of Serratia sp. isolated from mangrove soil of Mahanadi river delta,Odisha,India[J]. Journal of Genetic Engineering and Biotechnology,15(1):169-178. doi:10.1016/j.jgeb.2017.01.003.
Cunningham J E,Kuiack C. 1992. Production of citric and oxa-lic acids and solubilization of calcium phosphate by Penicillium bilaii[J]. Applied and Environmental Microbio-logy,58(5):1451-1458. doi:10.1128/AEM.58.5.1451-1458. 1992.
Deubel A,GranseeA,Merbach W. 2000. Transformation of organic rhizodepositions by rhizosphere bacteria and its influence on the availability of tertiary calcium phosphate[J]. Journal of Plant Nutrition and Soil Science,163(4):387-392. doi:10.1002/1522-2624(200008)163:4<387::AID-JPLN387>3.0.CO;2-K.
Elser J J. 2012. Phosphorus:A limiting nutrient for humanity?[J]. Current Opinion in Biotechnology,23(6): 833-838. doi:10.1016/j.copbio.2012.03.001.
Ghani A,Rajan S S S,Lee A. 1994. Enhancement of phosphate rock solubility through biological processes[J]. Soil Biology and Biochemistry,26(1):127-136. doi:10.1016/ 0038-0717(94)90204-6.
Gouda S,Kerry R G,Das G,Paramithiotis S,Shin H S,Patra J K. 2018. Revitalization of plant growth promoting rhizobacteria for sustainable development in agriculture[J]. Microbiological Research,206:131-140. doi:10.1016/j.micres.2017.08.016.
Kanehisa M,Goto S,Hattori M,Aoki-Kinoshita K F,Itoh M,Kawashima S,Katayama T,Araki M,Hirakawa M. 2006. From genomics to chemical genomics:New developments in KEGG[J]. Nucleic Acids Research,34:354-357. doi:10.1093/nar/gkj102.
Kim K Y,Jordan D,McDonald G A. 1997. Effect of phosphate-solubilizing bacteria and vesicular-arbuscular mycorrhizae on tomato growth and soil microbial activity[J]. Biology and Fertility of Soils,26(2):79-87. doi:10.1007/s003740050347.
Lagesen K,Hallin P,R?dland E A,Staerfeldt H H,Rognes T,Ussery D W. 2007. RNAmmer:Consistent and rapid annotation of ribosomal RNA genes[J]. Nucleic Acids Research,35(9):3100-3108. doi:10.1093/nar/gkm160.
Li L,Liao S T,Li W M,Xing D X,Luo G Q,Li Q R,Ye M Q,Xiao Y, Yang Q. 2018. Fingerprint of exhaust gases and database of microbial diversity during silkworm excrement composting[J]. Compast Science & Utilization,26(1):40-51. doi:10.1080/1065657X.2017.1344593.
Liu W G,He Y Q,Zhang K,Fan J B,Cao H. 2012. Isolation,identification and characterization of a strain of phosphate-solubilizing bacteria from red soil[J]. Acta Microbiologica Sinica,52(3):326-333.
Nosrati R,Owlia P,Saderi H,Rasooli I,Ali Malboobi M. 2014. Phosphate solubilization characteristics of efficient nitrogen fixing soil Azotobacter strains[J]. Iranian Journal of Microbiology,6(4):285-295.
Rice E W,Baird R B,Eaton A D,Clesceri L S. 1995. Standard methods for the examination of water and wastewater,phosphates[M]. Washington DC:American Public Health Association:150-152.
Rodríguez H,Fraga R,1999. Phosphate solubilizing bacteria and their role in plant growth promotion[J]. Biotechnology Advances,17(4-5):319-339. doi:10.1016/S0734-9750(99)00014-2.
Rodríguez H,Gonzalez T,Selman G. 2001. Expression of a mineral phosphate solubilizing gene from Erwinia herbi-cola in two rhizobacterial strains[J]. Journal of Biotechnology,84(2):155-161. doi:10.1016/S0168-1656(00)00347-3.
Sackett W G,Patten A G,Brown C W. 1908. The solvent action of soil bacteria upon the insoluble phosphates of raw bone meal and natural raw rock phosphate[J]. Central Bacteria,20:688-703.
Sane S A,Mehta S K. 2015. Isolation and evaluation of rock phosphate solubilizing fungi as potential biofertilizer[J]. Journal of Fertilizers & Pesticides,6(2):156-160. doi:10. 4172/2471-2728.1000156.
Vyas P,Gulati A. 2009. Organic acid production in vitro and plant growth promotion in maize under controlled environment by phosphate-solubilizing fluorescent Pseudomonas[J]. BMC Microbiology,9:174. doi:10.1186/1471-2180-9-174.
Wu F,Li J R,Chen Y L,Zhang L P,Zhang Y,Wang S,Shi X,Li L,Liang J S. 2019. Effects of phosphate solubili-zing bacteria on the growth,photosynthesis,and nutrient uptake of Camellia oleifera Abel.[J]. Forests,10(4):348. doi:10.3390/f10040348.
Zhu J,Li M,Whelan M. 2018. Phosphorus activators contri-bute to legacy phosphorus availability in agricultural soils:A review[J]. Science of the Total Environment,612:522-537. doi:10.1016/j.scitotenv.2017.08.095.
(責任编辑 罗 丽)
