草地贪夜蛾和斜纹夜蛾幼虫体内保护酶及解毒酶对2种杀虫剂的响应比较
2021-08-02李浩陈亚平鲁智慧郭建洋李亚红朱林云和淑琪桂富荣
李浩 陈亚平 鲁智慧 郭建洋 李亚红 朱林云 和淑琪 桂富荣
摘要:【目的】明確草地贪夜蛾[Spodoptera frugiperda(J. E. Smith)]及其近缘种斜纹夜蛾[Spodoptera litura (Fabricius)]幼虫体内保护酶和解毒酶对2种不同作用类型杀虫剂的响应,为草地贪夜蛾和斜纹夜蛾的田间防控及抗药性治理提供科学依据。【方法】采用叶片浸渍法测定甲维盐和氯虫苯甲酰胺对草地贪夜蛾和斜纹夜蛾3龄幼虫的毒力,并用2种杀虫剂亚致死浓度(LC25)和致死中浓度(LC50)处理过的小麦叶片分别饲喂2种害虫的3龄幼虫,比较取食6、12、18、24和48 h后幼虫体内保护酶[超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)]及解毒酶[谷胱甘肽S-转移酶(GST)、细胞色素P450(CYP450)和羧酸酯酶(CarE)]的活性变化。【结果】甲维盐对草地贪夜蛾和斜纹夜蛾的毒力高于氯虫苯甲酰胺。2类杀虫剂胁迫下2种害虫的CYP450活性均上升,且草地贪夜蛾的CYP450活性高于斜纹夜蛾,在甲维盐和氯虫苯甲酰胺低剂量(LC25)胁迫下草地贪夜蛾的CYP450活性均高于高剂量(LC50)胁迫处理,处理后48 h均达最高值(15.72±0.41和15.36±0.47 ng/mL);而草地贪夜蛾另2种解毒酶(GST和CarE)活性在甲维盐处理后低于斜纹夜蛾。甲维盐胁迫下2种害虫体内保护酶(SOD和POD)活性均降低,且草地贪夜蛾保护酶活性低于斜纹夜蛾;氯虫苯甲酰胺胁迫下草地贪夜蛾保护酶(SOD和POD)活性均上升,高剂量氯虫苯甲酰胺胁迫下2种害虫SOD和CAT活性均高于低剂量胁迫处理,且草地贪夜蛾SOD和CAT活性高于斜纹夜蛾。2种害虫体内保护酶和解毒酶活性对2类杀虫剂响应差异明显,且物种、药剂、浓度、时间、物种×浓度和药剂×浓度因素对2种害虫保护酶和解毒酶活性均有极显著影响(P<0.01)。2类杀虫剂胁迫下2种害虫的SOD和CAT活性间相关性较强。【结论】草地贪夜蛾对甲维盐的敏感性高于斜纹夜蛾,而对氯虫苯甲酰胺的敏感性低于斜纹夜蛾,且2种害虫均主要通过增强CYP450活性对杀虫剂进行解毒代谢。农业生产上推荐使用甲维盐作为防治草地贪夜蛾的药剂。
关键词: 草地贪夜蛾;斜纹夜蛾;保护酶;解毒酶;抗药性
中图分类号: S433.4 文献标志码: A 文章编号:2095-1191(2021)03-0559-11
Response comparison of protective and detoxification enzymes in Spodoptera frugiperda(J. E. Smith) and Spodoptera litura (Fabricius) larvae to two insecticides
LI Hao1, CHEN Ya-ping1, LU Zhi-hui1,GUO Jian-yang2, LI Ya-hong3,
ZHU Lin-yun1, HE Shu-qi1*, GUI Fu-rong1,4*
(1Plant Protection College, Yunnan Agricultural University/State Key Laboratory for Conservation and Utilization of Bio-resources in Yunnan, Kunming 650201, China; 2Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China; 3Yunnan Plant Protection and Quarantine Station, Kunming 650034, China;
4Yunnan Plateau Characteristic Agriculture Industry Research Institute, Kunming 650201, China)
Abstract:【Objective】The research aimed to clarify the response of different insecticides on the activities of protective enzymes and detoxification enzymes in the larvae of Spodoptera frugiperda(J. E. Smith)and Spodoptera litura (Fabricius) to two insecticides, and to provide theoretical basis for further study on the field control and and insecticide resistance mechanism of S. frugiperda and S. litura. 【Method】The toxicity of emamectin and chlorantraniliprole to the 3rd instar larvae of S. frugiperda and S. litura were assayed by leaf-dipping method by feeding wheat leaves treated with sublethal concentration(LC25) and median lethal concentration(LC50) of the pesticides respectively, and the activities of protective enzymes[superoxide dismutase(SOD), peroxidase(POD) and catalase(CAT)] and detoxification enzymes [glutathione S-transferase(GST), cytochrome P450(CYP450) and carboxylesterase(CarE)] in larvae after being treated for 6, 12, 18, 24 and 48 h were measured and analyzed. 【Result】The toxicity of emamectin to S. frugiperda and S. litura was higher than that of chlorantraniliprole. The activity of CYP450 in both pests increased after the two insecticide treatments, and was significantly higher in S. frugiperda than that in S. litura. The CYP450 activity in S. frugiperda was more active at low concentration(LC25) of emamectin and chlorantraniliprole than at high concentration(LC50), which was the highest at 48 h as 15.72±0.41(emamectin) and 15.36±0.47 ng/mL(cholrantraniliprole). However, the activities of two detoxification enzymes GST and CarE in S. frugiperda were lower than those in S. litura after emamectin treatment. The activities of protective enzymes SOD and POD in both pests decreased after treated with emamectin, and were lower in S. frugiperda than those in S. litura; while the activities of SOD and POD in S. frugiperda increased after treated with chlorantraniliprole. The activities of SOD and CAT were higher in both pests at LC50 chlorantraniliprole than at LC25, and were higher in S. frugiperda than in S. litura. The response activities of protective enzymes and detoxification enzymes in both pests were greatly affected by the two insecticides, and species, insecticide, concentration, time, species×concentration and insecticide×concentration had extremely significant effects on the activities of protective enzymes and detoxification enzymes(P<0.01). There was a strong correlation between the activities of SOD and CAT of both S. frugiperda and S. litura under two insecticides treatments. 【Conclusion】The susceptibility of S. frugiperda to emamectinis higher than that of S. litura, while the sensitivity to chlorantraniliprole is lower than that of S. litura, and the two pests enhance detoxification metabolism of insecticides by increasing CYP450 activity. In agricultural production, it is recommended to use emamectin as an agent for controlling S. frugiperda.
Key words: Spodoptera frugiperda(J. E. Smith.); Spodoptera litura(Fabricius); protective enzyme; detoxification enzyme; pesticide resistance
Foundation item:National Key Research and Development Program of China(2019YFD0300101,2019YFD0300-104);Major Science and Technology Special Project of Yunnan(2019ZG00910)
0 引言
【研究意义】草地贪夜蛾[Spodoptera frugiperda (J. E. Smith)]隶属于鳞翅目(Lepidoptera)夜蛾科(Noctuidae),原产于美洲热带和亚热带地区,是一种具有重大入侵性且危害严重的全球性杂食性农业害虫,幼虫可为害禾本科(玉米、小麦、水稻等)、十字花科(甘蓝、白菜等)和茄科(马铃薯、番茄等)等350多种寄主植物(Goergen et al.,2016;Montezano et al.,2018)。草地贪夜蛾的同属近缘本地种斜纹夜蛾[Spodoptera litura (Fabricius)]广泛分布于亚洲和大洋洲,且与草地贪夜蛾有较高的生态位重叠(赵胜园等,2019a)。草地贪夜蛾作为入侵物种,其与本地种斜纹夜蛾对杀虫剂的抗性水平及生理适应性差异至今鲜有研究报道。目前,草地贪夜蛾的防治手段仍以化学防治为主,甲氨基阿维菌素苯甲酸盐(Emamectin benzoate)、氯虫苯甲酰胺(Chlorantraniliprole)等化学农药对草地贪夜蛾具有良好的防效(Okuma et al.,2018;宋洁蕾等,2019)。探明不同作用类型杀虫剂对入侵种草地贪夜蛾和本地种斜纹夜蛾保护酶和解毒酶活性的影响,明确其对药剂的解毒代谢机制,对延缓害虫抗药性产生及保障农业生产安全具有重要意义。【前人研究进展】相关研究表明,昆虫体内的细胞色素P450(CYP450)、谷胱甘肽S-转移酶(GST)和羧酸酯酶(CarE)等主要解毒酶在应对杀虫剂及其他外源或内源有害物质的过程中发挥重要作用(Zhang et al.,2017;李长春等,2019;鲁智慧等,2020),解毒酶活性的改变与昆虫抗药性的产生有关(何超等,2020),解毒代谢增强是草地贪夜蛾对杀虫剂产生抗性的主要原因(Teixeira and Andaloro,2013)。张百重等(2020)、Zhang等(2020)研究发现用甲维盐、氯虫苯甲酰胺和Bt杀虫蛋白处理可诱导草地贪夜蛾幼虫体内CYP4G、CYP321A、CYP321B、CYP6AB和CYP6AE等亚家族的多个基因高表达,从而增强害虫对杀虫剂的抗性。Gui等(2020)研究23种常用杀虫剂对草地贪夜蛾转录组的影响,发现经杀虫剂处理后草地贪夜蛾体内与杀虫剂代谢相关的CYP450、GST、CarE和腺苷三磷酸结合盒转运蛋白(ABC转运蛋白)等家族中的多个基因均被显著诱导表达。昆虫体内解毒酶基因的过表达可能引起抗药性的产生,如对有机磷、拟除虫菊酯和氨基甲酸酯类杀虫剂产生抗性的草地贪夜蛾体内CYP450、GST和CarE编码基因过表达(Carvalho et al.,2013)。高祖鹏等(2020)研究发现乙基多杀菌素对草地贪夜蛾幼虫的毒杀效果高于氯虫苯甲酰胺,在不同浓度的乙基多杀菌素处理条件下,草地贪夜蛾幼虫体内的CarE和多功能氧化酶(MFO)活性有所提高。王芹芹等(2020)研究表明茚虫威对草地贪夜蛾MFO和GST活性具有显著诱导作用,且增效醚(PBO)和顺丁烯二酸二乙酯(DEM)对茚虫威有明显的增效作用,故推测MFO和GST活性增强与草地贪夜蛾抗药性发展相关。昆虫体内的保护酶系主要包括超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT),当受到包括杀虫剂在内的外源化学物质刺激时,3种保护酶的动态平衡被破坏,导致生物机体内氧自由基浓度过高,破坏生物功能分子,使细胞功能受到威胁(Senthil-Nathan,2013;唐芬芬等,2019),虫体通过升高保护酶活性来最大限度降低外源物造成的氧化损伤(黄训兵等,2021)。【本研究切入点】目前,草地贪夜蛾与本地近缘种斜纹夜蛾的抗药性差异比较鲜有报道。【拟解决的关键问题】以2种作用机制杀虫剂(甲维盐和氯虫苯甲酰胺)为代表,在采用叶片浸渍法测定这2种杀虫剂对草地贪夜蛾和斜纹夜蛾3龄幼虫毒力的基础上,分别以亚致死浓度(LC25)和致死中浓度(LC50)处理的小麦叶片饲喂2种害虫的3龄幼虫,用酶动力法测定其体内保护酶和解毒酶活性的差异,并分析物种—药剂—浓度—时间的关系,以明确不同作用类型杀虫剂对2种近缘种害虫体内保护酶和解毒酶活性的影响,为草地贪夜蛾和斜纹夜蛾的田间防控及抗药性治理提供科学依据。
1 材料与方法
1. 1 试验材料
1. 1. 1 供试虫源 草地贪夜蛾于2019年5月采自云南省元江县(东经101°58′,北纬23°35′,海拔421 m),斜纹夜蛾购自河南省济源白云实业有限公司,2种害虫均在人工气候箱(上海一恒科学仪器有限公司,MG-300A)内采用未施用化肥及农药的淮麦36小麦叶片饲养15代以上[饲养温度(27±0.5)℃,相对湿度(70±5)%,光周期L∶D=16 h∶8 h,下同]。选取3龄幼虫进行毒力测定及酶活性检测。
1. 1. 2 供試药剂 98%甲维盐原药和98%氯虫苯甲酰胺原药购自江苏泰越生物科技有限公司;SOD、POD、CAT、GST和CarE等试剂盒购自南京建成生物工程研究所,CYP450 ELISA试剂盒购自上海优选生物科技有限公司。
1. 2 试验方法
1. 2. 1 毒力测定 采用叶片浸渍法(IRAC)对2种杀虫剂进行毒力测定。以丙酮分别溶解甲维盐和氯虫苯甲酰胺原药配制成母液,用含0.1% Triton X-100的双蒸水按等比稀释成5个浓度梯度,每个浓度3次重复;以含0.1% Triton X-100双蒸水为对照。将小麦叶片(5.0 cm×0.5 cm)在不同浓度药液中浸渍15 s,取出晾干后放入养虫盒(18 cm×12 cm×8 cm)中,每个养虫盒放入大小一致、健康的3龄幼虫45头,置于人工气候箱中饲养,每处理3次重复。48 h后观察和统计各处理2种害虫的死亡情况,以毛笔轻触幼虫无反应视为死亡。
1. 2. 2 2种杀虫剂处理后草地贪夜蛾和斜纹夜蛾体内保护酶及解毒酶活性测定 样品药剂处理:用含0.1% Triton X-100的双蒸水分别将2种药剂稀释至相应的LC25和LC50,將新鲜小麦叶片在药液中浸渍15 s后取出,以在0.1% Triton X-100溶液中浸渍15 s的小麦叶片为对照,晾干后放入足量3龄幼虫的养虫盒内。每个离心管分别收集6、12、18、24和48 h存活幼虫10头为1个重复,每处理3次重复,立即浸入液氮,置于-80 ℃备用。酶活性测定按试剂盒说明操作。
酶源制备:分别取上述试虫10头(约0.03 g),加入适量的预冷匀浆介质后用高通量研磨仪粉碎,4 ℃下12000 r/min离心10 min,取上清液作为待测酶液。
酶活性测定:按照试剂盒说明使用Varioskan LUX多功能酶标仪(Thermo Fisher Scientific,美国)分别测定酶活性。
SOD活性测定:以SOD抑制率达50%时所对应的酶量为1个酶活性单位(U)。
SOD抑制率(%)=[(对照OD-对照空白OD)-
(测定OD-测定空白OD)]/
(对照OD-对照空白OD)×100
SOD活性=SOD抑制率/50%×反应体系稀释倍数/
待测样本蛋白浓度
POD活性测定:以每毫克组织蛋白在37 ℃每分钟催化1 μg底物的酶量定义为1个酶活性单位(U)。
POD活性=(测定OD-空白OD)/(12×比色光径)×
(反应液总体积/样本量)/反应时间/
待测样本蛋白浓度×1000
CAT活性测定:以每毫克组织蛋白每秒钟分解1 μmol H2O2的量定义为1个酶活性单位(U)。
CAT活性=(对照OD-测定OD)×271×[1/(60×取
样量)]/待测样本蛋白浓度
GST活性测定:以每毫克组织蛋白在37 ℃扣除非酶促反应,每分钟降低1 μmol/L GSH的量为1个酶活性单位(U)。
GST活性=(对照OD-测定OD)/(标准OD-空白
OD)/反应时间/(样本取样量×待测
样本蛋白浓度)×标准品浓度×反应
体系稀释倍数
CYP450活性测定:测定待测样品和标准品OD,将待测样品OD代入标准品标准曲线直线回归方程,计算样品中昆虫CYP450活性。
CarE活性测定:以每毫克组织蛋白在37 ℃反应每分钟催化吸光值增加1定义为1个酶活性单位(U)。
CarE活性=[(3 min 10 s测定OD-10 s测定OD)-
(3 min 10 s对照OD-10 s对照OD)]/
(待测样品蛋白浓度×样品取样量)/
反应时间×反应体系总体积
蛋白含量测定:待测样品蛋白浓度(μg/mL)=(测定OD-空白OD)/(标准OD-空白OD)×样品测试前稀释倍数×标准品浓度。
1. 3 统计分析
采用DPS V7.05分析得到甲维盐和氯虫苯甲酰胺的毒力方程及LC25和LC50。采用SPSS 24.0进行单因素方差分析(One-way ANOVA),分别比较草地贪夜蛾和斜纹夜蛾3龄幼虫体内同一时间不同剂量处理的保护酶和解毒酶活性差异显著性;独立样本T 检验比较同一药剂处理浓度2种害虫保护酶和解毒酶活性差异显著性;以物种、药剂、浓度和时间为4个水平处理因子,应用四因素方差分析(Four-way ANOVA)进行处理间试验数据的差异显著性分析,并采用R语言函数进行试验数据的主成分分析(PCA)和皮尔森(Pearson)相关分析。
2 结果与分析
2. 1 2种杀虫剂对草地贪夜蛾和斜纹夜蛾3龄幼虫的毒力测定结果
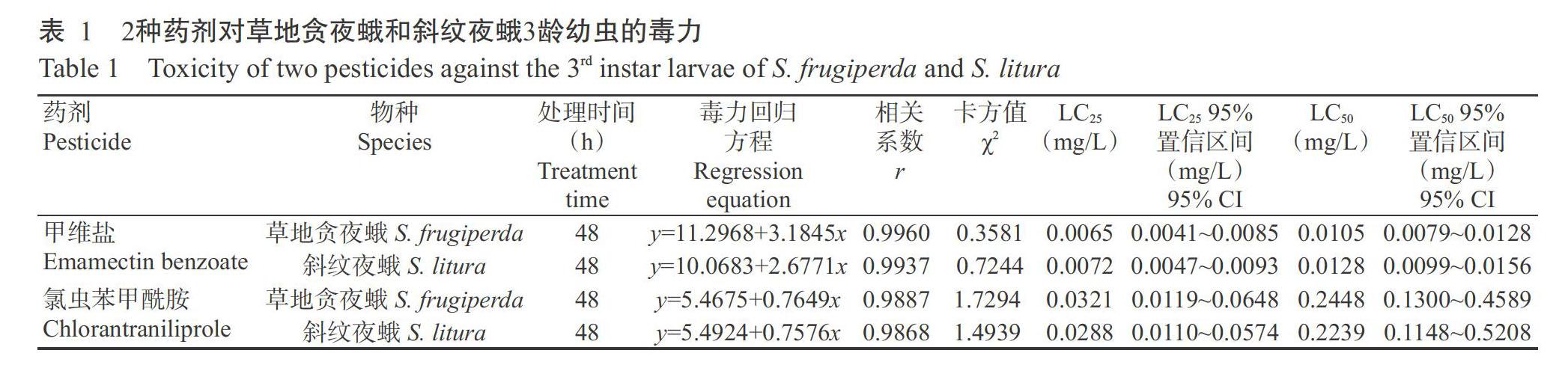
由表1可知,甲维盐对2种害虫的毒力高于氯虫苯甲酰胺,其中甲维盐对草地贪夜蛾和斜纹夜蛾3龄幼虫48 h的LC25和LC50分别为0.0065和0.0105 mg/L及0.0072和0.0128 mg/L,氯虫苯甲酰胺对草地贪夜蛾和斜纹夜蛾3龄幼虫48 h的LC25和LC50分别为0.0321和0.2448 mg/L及0.0288和0.2239 mg/L。同一处理时间下,甲维盐对草地贪夜蛾和斜纹夜蛾的LC25和LC50均小于氯虫苯甲酰胺,甲维盐对草地贪夜蛾幼虫的LC25和LC50均小于斜纹夜蛾,而氯虫苯甲酰胺对草地贪夜蛾幼虫的LC25和LC50均大于斜纹夜蛾,说明草地贪夜蛾对甲维盐的敏感性高于斜纹夜蛾,而对氯虫苯甲酰胺的敏感性低于斜纹夜蛾。
2. 2 甲维盐对草地贪夜蛾和斜纹夜蛾3龄幼虫体内保护酶及解毒酶活性的影响
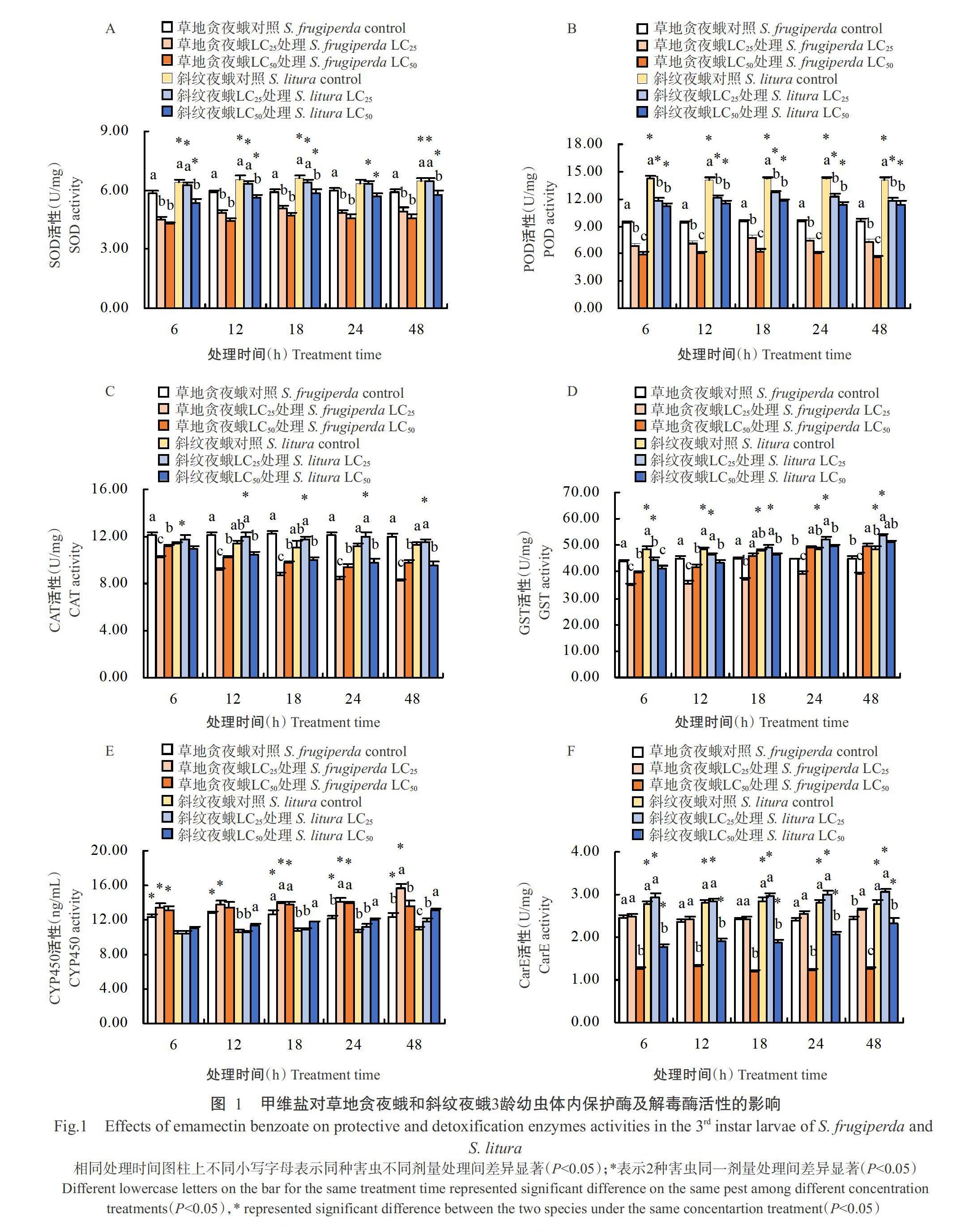
2. 2. 1 对保护酶活性的影响 甲维盐处理后2种害虫保护酶(除斜纹夜蛾CAT外)活性均呈降低趋势,高剂量(LC50处理)甲维盐胁迫下,2种害虫SOD(图1-A)和POD(图1-B)活性均低于低剂量(LC25处理)胁迫处理,且草地贪夜蛾SOD和POD活性低于斜纹夜蛾,LC50处理草地贪夜蛾SOD和POD活性分别在处理后6和48 h达最低值(4.27±0.11和5.59±0.23 U/mg),仅为对照的73.17%和58.41%。LC25处理后的草地贪夜蛾CAT(图1-C)活性低于LC50处理,且低于斜纹夜蛾,在处理后48 h达最低值(8.19±0.19 U/mg),仅为对照的68.17%,而斜纹夜蛾LC25处理的CAT活性高于LC50处理。
2. 2. 2 对解毒酶活性的影响 2种害虫的GST(图1-D)和CYP450(图1-E)活性均随甲维盐处理时间的延长整体呈升高趋势,且草地贪夜蛾CYP450活性高于斜纹夜蛾,而GST和CarE(图1-F)活性低于斜纹夜蛾。其中LC25处理后的草地贪夜蛾CYP450和CarE活性均高于LC50处理,处理48 h均达最高值(15.72±0.41 ng/mL和2.64±0.04 U/mg),为对照的1.27和1.10倍,而GST活性低于LC50处理,在24 h达最高值(39.33±0.93 U/mg);LC25处理后斜纹夜蛾GST和CarE活性均高于LC50处理,均在处理48 h达最高值(53.63±0.82和3.05±0.07 U/mg)。
2. 3 氯虫苯甲酰胺对草地贪夜蛾和斜纹夜蛾3龄幼虫体内保护酶及解毒酶活性的影响
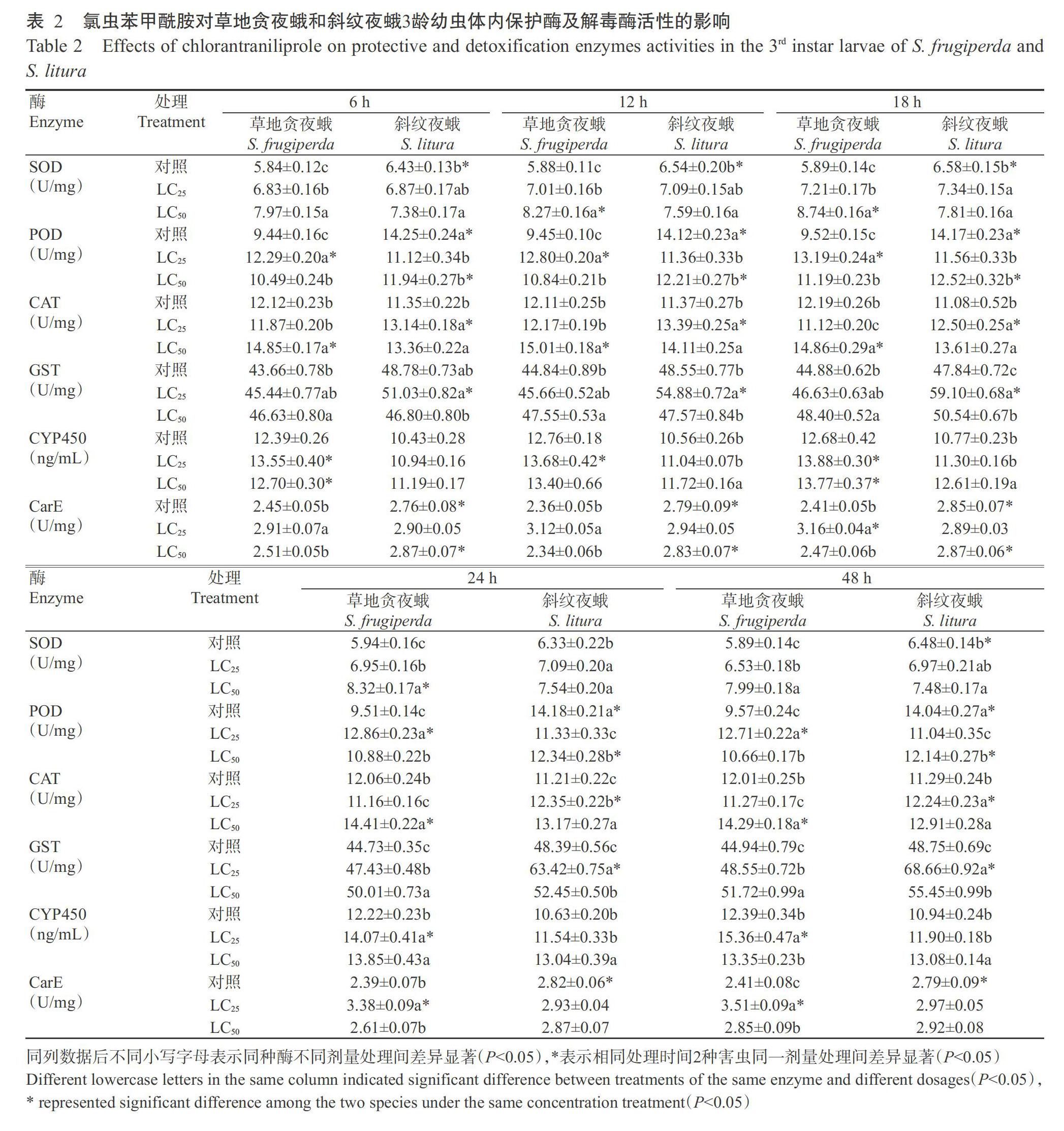
2. 3. 1 对保护酶活性的影响 氯虫苯甲酰胺胁迫下草地贪夜蛾保护酶(SOD和POD)及斜纹夜蛾保护酶(SOD和CAT)活性均上升(表2),高剂量氯虫苯甲酰胺胁迫下的2种害虫SOD和CAT活性均高于低剂量胁迫处理,且草地贪夜蛾SOD和CAT活性高于斜纹夜蛾,LC50处理后18和12 h草地贪夜蛾SOD和CAT活性分别达最高值(8.74±0.16和15.01±0.18 U/mg),而LC25处理后草地贪夜蛾POD活性高于LC50处理,且高于斜纹夜蛾,在处理后18 h达最高值(13.19±0.24 U/mg),为对照的1.39倍。
2. 3. 2 对解毒酶活性的影响 经氯虫苯甲酰胺处理后2种害虫解毒酶活性随处理时间的延长整体呈升高趋势,且草地贪夜蛾CYP450活性高于斜纹夜蛾,而GST活性低于斜纹夜蛾,其中,LC25处理后草地贪夜蛾的CYP450和CarE活性均高于LC50处理,处理48 h达最高值(15.36±0.47 ng/mL和3.51±0.09 U/mg),分别为对照的1.24和1.46倍,而GST活性低于LC50处理,处理后48 h达最高值(48.55±0.72 U/mg),为对照的1.08倍;LC25处理后斜纹夜蛾GST和CarE活性均高于LC50处理,处理后48 h达最高值(68.66±0.92和2.97±0.05 U/mg)。
2. 4 草地贪夜蛾和斜纹夜蛾酶活性主成分分析结果
物种×药剂因素下草地贪夜蛾和斜纹夜蛾保护酶及解毒酶活性的主成分分析见图2。第一主成分(PC1)的贡献度为54.9%,第二主成分(PC2)的贡献度为17.2%,二者的累积贡献率为72.1%。草地贪夜蛾甲维盐处理的保护酶和解毒酶活性在PC1的负方向,斜纹夜蛾甲维盐处理在PC2的正方向,两者间无重叠;而2种害虫氯虫苯甲酰胺处理均在PC1正方向且有重叠,与2种害虫甲维盐处理无重叠;说明2种害虫氯虫苯甲酰胺处理间的保护酶和解毒酶活性差异不明显,但两者均与2种害虫甲维盐处理差异明显。表明2种近缘种害虫体内的保护酶及解毒酶对甲维盐和氯虫苯甲酰胺响应差异明显。
2. 5 草地貪夜蛾和斜纹夜蛾酶活性变化的四因素方差分析结果
由表3可知,草地贪夜蛾和斜纹夜蛾幼虫体内SOD、POD、CAT、GST、CYP450和CarE活性修正模型F分别为40.06、95.07、37.07、60.40、24.57和60.08,处理间差异极显著(P<0.01,下同),所选模型具有统计意义。其中,物种、药剂、浓度、时间、物种×浓度、药剂×浓度对3种保护酶和解毒酶活性均有极显著影响;物种×药剂、物种×药剂×浓度对3种保护酶及CYP450和CarE活性均有极显著影响;浓度×时间对CAT和3种解毒酶活性有极显著影响;物种×药剂×时间对GST和CarE活性有极显著影响;物种×浓度×时间对GST和CYP450活性有极显著影响。
2. 6 草地贪夜蛾和斜纹夜蛾酶活性相关分析结果
2种害虫酶活性的皮尔森相关分析结果表明,经2种杀虫剂处理后,2种害虫体内的SOD与CAT活性间相关性较强(图3),其中,草地贪夜蛾幼虫体内保护酶SOD、POD和CAT间呈正相关,GST和CYP450活性与CarE呈正相关(图3-A);斜纹夜蛾POD和CAT活性与SOD活性呈正相关,CYP450和CarE活性与GST活性呈正相关(图3-B)。综合GST、CYP450和CarE活性,推断这3种与解毒代谢相关的酶在2种害虫应对不同杀虫剂时通过调节活性相互协调、配合,共同抵御杀虫剂胁迫,其中以杀虫剂胁迫下草地贪夜蛾CYP450和CarE及斜纹夜蛾GST和CarE活性变化相关性较强。
3 讨论
自2019年草地贪夜蛾入侵我国以来,国内学者相继开展了杀虫剂对其毒力及防效研究。大量研究表明,新型作用机制杀虫剂甲维盐和氯虫苯甲酰胺对草地贪夜蛾幼虫具有较强的毒杀效果,校正死亡率均超过90%(宋洁蕾等,2019;赵胜园等,2019b)。本研究中甲维盐对草地贪夜蛾和斜纹夜蛾的毒力均高于氯虫苯甲酰胺,与蒋兴川等(2019)、宋洁蕾等(2019)报道的结果一致,且草地贪夜蛾对甲维盐的敏感性高于斜纹夜蛾,而对氯虫苯甲酰胺的敏感性低于斜纹夜蛾。
外源毒物可使昆虫体内的O[-2]·、·OH和H2O2等活性氧自由基数量激增,对虫体产生毒害作用,而保护酶SOD、POD和CAT通过清除多余的活性氧自由基,使虫体不受外源毒物侵害(Bashan et al.,2009)。本研究中,经甲维盐处理后2种害虫3龄幼虫体内保护酶(除斜纹夜蛾CAT外)活性均呈降低趋势,而氯虫苯甲酰胺处理后草地贪夜蛾保护酶(SOD和POD)及斜纹夜蛾保护酶(SOD和CAT)活性均升高,表明SOD持续歧化O[-2]·,由CAT和POD分解H2O2,从而促使2种害虫能最大限度降低机体受到氯虫苯甲酰胺胁迫的氧化损伤(张文成等,2009)。同时,以高浓度氯虫苯甲酰胺处理后2种害虫的保护酶活性均高于甲维盐处理,表明保护酶活性升高可能是2种害虫对氯虫苯甲酰胺的敏感性低于甲维盐的原因之一。
为应对环境中的外源有毒物质如杀虫剂等压力,昆虫在长期的进化过程中已形成解毒代谢途径,其中体内的GST、CYP450和CarE等解毒酶在解毒代谢过程中发挥着重要作用(高祖鹏等,2020;Gui et al.,2020)。GST是昆虫体内重要的II相解毒酶,通过催化还原型谷胱甘肽(GSH)和有毒物质发生轭合反应,使有毒轭合物的水溶性增强而更易排出体外,最终达到解毒代谢的目的(Song et al.,2020)。陈羿渠等(2017)研究表明,氯虫苯甲酰胺亚致死剂量处理甜菜夜蛾(Spodoptera exigua)4龄幼虫体内中肠和脂肪体GST活性均升高,分别为对照的1.31和1.43倍;张振威等(2019)报道,舞毒蛾(Lymantria dispar)经甲维盐亚致死浓度处理后,幼虫体内的GST活性高于对照,且随着处理浓度的增加而升高。本研究以甲维盐和氯虫苯甲酰胺LC50处理后草地贪夜蛾GST活性总体均升高,且低于斜纹夜蛾,表明在高浓度甲维盐和氯虫苯甲酰胺胁迫下,草地贪夜蛾和斜纹夜蛾通过提高GST活性而增强解毒代谢作用,与戴瀚洋等(2015)、陈羿渠等(2017)关于甲维盐和氯虫苯甲酰胺对甜菜夜蛾幼虫GST活性影响的结果类似,同时表明杀虫剂胁迫下草地贪夜蛾GST活性低于斜纹夜蛾是草地贪夜蛾对甲维盐敏感性高于斜纹夜蛾的原因之一。CYP450是昆虫体内的重要代谢酶系之一,能代谢多种外源或内源化合物(Riveron et al.,2013)。欧善生等(2012)研究报道,棉铃虫(Helicoverpa armigera)经氯虫苯甲酰胺胁迫后,3~6龄幼虫体内CYP450活性均高于对照。本研究发现经甲维盐和氯虫苯甲酰胺处理后草地贪夜蛾CYP450活性均升高,且总体上高于斜纹夜蛾,表明草地贪夜蛾CYP450活性高于斜纹夜蛾是草地贪夜蛾对氯虫苯甲酰胺敏感性低于斜纹夜蛾的原因之一。Gui等(2020)通过基因组学分析揭示,入侵我国的草地贪夜蛾CYP450、解螺旋酶等多个基因家族出现显著扩增,其中CYP450家族多达425个基因,为本地种斜纹夜蛾的3倍,且有283个为草地贪夜蛾特有;在染色体水平基因组基础上进一步测定23种农药处理后的草地贪夜蛾转录组水平差异,发现草地贪夜蛾425个CYP基因中有107个基因差异表达明显。本研究结果表明,在甲维盐和氯虫苯甲酰胺胁迫下草地贪夜蛾CYP450活性升高是解毒代谢的关键。邢静等(2011)研究发现,以氯虫苯甲酰胺亚致死浓度处理3龄小菜蛾(Plutella xylostella)幼虫后,其体内CarE活性显著高于对照。蒋兴川等(2019)研究报道,甲维盐LC20处理后草地贪夜蛾3龄幼虫体内CarE活性随着处理时间的延长呈升高趋势。本研究中,甲维盐和氯虫苯甲酰胺LC25处理后草地贪夜蛾CarE活性均升高,且甲维盐处理后CarE活性均低于斜纹夜蛾,与邢静等(2011)、蒋兴川等(2019)的研究结果类似。任娜娜等(2014)研究表明,CarE在甲维盐、氯虫苯甲酰胺等新型作用类型杀虫剂的抗性发展中具有重要作用。Gui等(2020)研究显示,入侵我国的草地贪夜蛾CarE家族基因数78个,仅为本地种斜纹夜蛾的一半。可见,草地贪夜蛾CarE活性低于斜纹夜蛾可能是对甲维盐敏感性高的主要原因之一。
本研究首次比较入侵种草地贪夜蛾和本地种斜纹夜蛾对2种新型作用机制杀虫剂的酶活性响应差异,探究2种夜蛾对杀虫剂胁迫下的竞争优势,为研究草地贪夜蛾的抗药性机制和延缓抗药性产生打下基础,有关这2种杀虫剂对草地贪夜蛾和斜纹夜蛾的抗性选育和抗药性基因筛选等有待进一步研究。
4 结论
草地贪夜蛾对甲维盐的敏感性高于斜纹夜蛾,而对氯虫苯甲酰胺的敏感性低于斜纹夜蛾,且2种害虫均主要通过增强CYP450活性对杀虫剂进行解毒代谢。农业生产上推荐使用甲维盐作为防治草地贪夜蛾的药剂。
参考文献:
陈羿渠,向兴,贡常委,王学贵. 2017. 氯虫苯甲酰胺亚致死剂量对甜菜夜蛾主要解毒酶活性与生长繁殖的影响[J]. 中国农业科学,50(8):1440-1451. doi:10.3864/j.issn. 0578-1752.2017.08.008. [Chen Y Q,Xiang X,Gong C W,Wang X G. 2017. Effects of sublethal doses of chlorantraniliprole on the detoxification enzymes activities and the growth and reproduction of Spodoptera exigua[J]. Scientia Agricultura Sinica,50(8):1440-1451.]
戴瀚洋,孫洋,柏立新,赵静,肖留斌,谭永安. 2015. 亚致死浓度甲维盐胁迫对甜菜夜蛾幼虫解毒酶系活力及其相关基因表达量的影响[J]. 棉花学报,27(2):149-158. doi:10.11963/issn.1002-7807.201502008. [Dai H Y,Sun Y,Bai L X,Zhao J,Xiao L B,Tan Y A. 2015. Activities of detoxification enzymes and expressions of related genes in Spodoptera exigua larvae treated with sublethal concentrations of emamectin benzoate[J]. Cotton Science,27(2):149-158.]
高祖鹏,郭井菲,何康来,王振营. 2020. 乙基多杀菌素对草地贪夜蛾幼虫的毒力及对其解毒酶和乙酰胆碱酯酶活性的影响[J]. 害虫学报,63(5):558-564. doi:10.16380/j.kcxb.2020.05.004. [Gao Z P,Guo J F,He K L,Wang Z Y. 2020. Toxicity of spinetoram and its effects on the detoxifying enzyme and acetyl cholinesterase activities in Spodoptera frugiperda (Lepidoptera:Noctuidae) larvae[J]. Acta Entomologica Sinica,63(5):558-564.]
何超,沈登荣,尹立红,张睿,袁盛勇,田学军. 2020. 3种杀虫剂对井上蛀果斑螟存活、化蛹及羽化的影响[J]. 河南农业科学,49(9):105-111. doi:10.15933/j.cnki.1004-3268. 2020.09.013. [He C,Shen D R,Yin L H,Zhang R,Yuan S Y,Tian X J. 2020. Effects of three insecticides on survival,pupation and emergence of Assara inouei Yamanaka[J]. Journal of Henan Agricultural Sciences,49(9):105-111.]
黄训兵,李辉,涂雄兵,张泽华. 2021. 四种植物源化合物对亚洲小车蝗存活率、解毒酶和保护酶活性的影响[J]. 植物保护学报,48(1):158-164. doi:10.13802/j.cnki.zwbhxb. 2021.2021821. [Huang X B,Li H,Tu X B,Zhang Z H. 2021. Effects of four plant-derived compounds on the survival rate and activities of detoxification enzymes and protective enzymes in the grasshopper Oedaleus asiaticus[J]. Journal of Plant Protection,48(1):158-164.]
蒋兴川,沈怿丹,孙劲超,李秀霞,黄勇,董永成,操海群. 2019. 氯虫苯甲酰胺和甲维盐对草地贪夜蛾幼虫的毒力及解毒酶活性的影响[J]. 环境害虫学报,41(5):961-967. doi:10.3969/j.issn.1674-0858.2019.05.5. [Jiang X C,Shen Y D,Sun J C,Li X X,Huang Y,Dong Y C,Cao H Q. 2019. Effect of chlorantraniliprole and emamectin benzoa-te on toxicity and detoxification enzymes activity in Spo-doptera frugiperda larva[J]. Journal of Environmental Entomology,41(5):961-967.]
李长春,宁青,戴余军,王立华,李国元,彭宇. 2019. 拟环纹豹蛛谷胱甘肽S-转移酶基因的克隆及表达分析[J]. 江苏农业学报,35(5):1068-1074. doi:10.3969/j.issn.1000-4440. 2019.05.010. [Li C C,Ning Q,Dai Y J,Wang L H,Li G Y,Peng Y. 2019. Cloning and expression analysis of glutathione S-transferase gene in Pardosa pseudoannulata[J]. Jiangsu Journal of Agricultural Sciences,35(5):1068- 1074.]
魯智慧,和淑琪,郭晋,陈亚平,胡雪琼,李浩,谢琦,桂富荣. 2020. 取食不同寄主植物对草地贪夜蛾幼虫体内3类酶活性的影响[J]. 南方农业学报,51(10):2461-2469. doi:10.3969/j.issn.2095-1191.2020.10.018. [Lu Z H,He S Q,Guo J,Chen Y P,Hu X Q,Li H,Xie Q,Gui F R. 2020. Effects of host plants on activities of three groups of enzymes in Spodoptera frugiperda(Smith) larvae[J]. Journal of Southern Agriculture,51(10):2461-2469]
欧善生,梁沛,宋敦伦,史雪岩,高希武. 2012. 氯虫苯甲酰胺亚致死剂量对棉铃虫生长发育和解毒酶活性的影响[J]. 植物保护,38(4):1-8. doi:10.3969/j.issn.0529-1542.2012. 04.001. [Ou S S,Liang P,Song D L,Shi X Y,Gao X W. 2012. Effects of sublethal dosage of chlorantraniliprole on development and detoxifying enzymes activity of Helicoverpa armigera[J]. Plant Protection,38(4):1-8.]
任娜娜,谢苗,尤燕春,尤民生. 2014. 羧酸酯酶及其介导害虫抗药性的研究进展[J]. 福建农林大学学报(自然科学版),43(4):337-344. doi:10.13323/j.cnki.j.fafu(nat.sci.). 2014.04.005. [Ren N N,Xie M,You Y C,You M S. 2014. An overview on the study of insect carboxylesterases (COEs) and the COE-mediated resistance to insecticides[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition),43(4):337-344.]
宋洁蕾,李艳丽,李亚红,黄碧芬,康云昌,马庭矗,张澍雷,桂富荣. 2019. 不同杀虫剂对草地贪夜蛾的室内毒杀效果及毒力测定[J]. 南方农业学报,50(7):1489-1495. doi:10.3969/j.issn.2095-1191.2019.07.12. [Song J L,Li Y L,Li Y H,Huang B F,Kang Y C,Ma T C,Zhang S L,Gui F R. 2019. Measurements of indoor toxic effects and viru-lence of different insecticides against Spodoptera frugiperda[J]. Journal of Southern Agriculture,50(7):1489-1495.]
唐芬芬,杨伟克,朱峰,邵榆岚,张永红,白兴荣. 2019. BmNPV对家蚕抗氧化酶基因表达及其酶活性的影响[J]. 南方农业学报,50(10):2308-2313. doi:10.3969/j.issn.2095-1191.2019.10.22. [Tang F F,Yang W K,Zhu F,Shao Y L,Zhang Y H,Bai X R. 2019. Effects of BmNPV on the antioxidant enzyme gene expression and enzyme activity of Bombyx mori[J]. Journal of Southern Agriculture,50(10):2308-2313.]
王芹芹,崔麗,王立,黄伟玲,代黎明,袁会珠,芮昌辉. 2020. 茚虫威对草地贪夜蛾的毒力及解毒酶的诱导作用[J]. 植物保护,46(1):78-81. doi:10.16688/j.zwbh.2019557. [Wang Q Q,Cui L,Wang L,Huang W L,Dai L M,Yuan H Z,Rui C H. 2020. Toxicity of indoxacarb to Spodoptera frugiperda and induction of its detoxifying enzymes[J]. Plant Protection,46(1):78-81.]
邢静,梁沛,高希武. 2011. 亚致死浓度氯虫苯甲酰胺对小菜蛾药剂敏感度和解毒酶活性的影响[J]. 农药学学报,13(5):464-470. doi:10.3969/j.issn.1008-7303.2011.05.05. [Xing J,Liang P,Gao X W. 2011. Effects of sublethal concentrations of chlorantraniliprole on insecticide susceptibility and detoxifying enzyme activity in Plutella xylostella[J]. Chinese Journal of Pesticide Science,13(5):464-470.]
赵胜园,罗倩明,孙小旭,杨现明,姜玉英,吴孔明. 2019a. 草地贪夜蛾与斜纹夜蛾的形态特征和生物学习性比较[J]. 中国植保导刊,39(5):26-35. doi:10.3969/j.issn.1672-6820.2019.05.005. [Zhao S Y,Luo Q M,Sun X X,Yang X M,Jiang Y Y,Wu K M. 2019a. Comparison of morphological and biological characteristics between Spodoptera frugiperda and Spodoptera litura[J]. China Plant Protection,39(5):26-35.]
赵胜园,孙小旭,张浩文,杨现明,吴孔明. 2019b. 常用化学杀虫剂对草地贪夜蛾防效的室内测定[J]. 植物保护,45(3):10-14. doi:10.16688/j.zwbh.2019160. [Zhao S Y,Sun X X,Zhang H W,Yang X M,Wu K M. 2019b. Laboratory test on the control efficacy of common chemical insecticides against Spodoptera frugiperda[J]. Plant Protection,45(3):10-14.]
张百重,苏栩,卢留洋,甄丛爱,朱斌,李亚设,董文阳,汪耿,胥燕博,孔凡彬,刘润强,陈锡岭,高希武. 2020. 三种杀虫剂亚致死剂量对草地贪夜蛾细胞色素P450基因表达的影响[J]. 害虫学报,63(5):565-573. doi:10.16380/j.kcxb.2020.05.005. [Zhang B C,Su X,Lu L Y,Zhen C A,Zhu B,Li Y S,Dong W Y,Wang G,Xu Y B,Kong F B,Liu R Q,Chen X L,Gao X W. 2020. Effects of three insecticides at the sublethal dose on the expression of cytochrome P450 genes in Spodoptera frugiperda (Lepidoptera:Noctuidae)[J]. Acta Entomologica Sinica,63(5):565-573.]
张文成,王开运,牛芳,王东,任学祥. 2009. 虫螨腈胁迫对甜菜夜蛾保护酶系和解毒酶系的诱导效应[J]. 植物保护学报,36(5):455-460. doi:10.13802/j.cnki.zwbhxb.2009. 05.005. [Zhang W C,Wang K Y,Niu F,Wang D,Ren X X. 2009. Induction of chlorfenapyr on endogenous protective and detoxifying enzymes in beet armyworm,Spo-doptera exigua (Hübner)[J]. Journal of Plant Protection,36(5):455-460.]
張振威,赵清泉,郝昕,潘佳亮,马玲. 2019. 阿维菌素和甲维盐对舞毒蛾幼虫的毒力及解毒酶活性的影响[J]. 东北林业大学学报,47(5):118-122. doi:10.13759/j.cnki.dlxb. 2019.05.023. [Zhang Z W,Zhao Q Q,Hao X,Pan J L,Ma L. 2019. Effect of avermectin and emamectin benzoa-te on toxicity and detoxifying enzymes activity in Lymantria dispar larva[J]. Journal of Northeast Forestry University,47(5):118-122.]
Bashan N,Kovsan J,Kachko I,Ovadia H,Rudich A. 2009. Positive and negative regulation of insulin signaling by reactive oxygen and nitrogen species[J]. Physiological Reviews,89(1):27-71. doi:10.1152/physrev.00014.2008.
Carvalho R A,Omoto C,Field L M,Williamson M S,Bass C. 2013. Investigating the molecular mechanisms of organophosphate and pyrethroid resistance in the fall armyworm Spodoptera frugiperda[J]. PLoS One,8(4):e62268. doi:10.1371/journal.pone.0062268.
Goergen G,Kumar P L,Sankung S B,Togola A,Tamò M. 2016. First report of outbreaks of the fall armyworm Spo-doptera frugiperda(J. E. Smith)(Lepidoptera,Noctuidae),a new alien invasive pest in west and central Africa[J]. PLoS One,11(10):e0165632. doi:10.1371/journal.pone.0165632.
Gui F R,Lan T M,Zhao Y,Guo W,Dong Y,Fang D M,Liu H,Li H M,Wang H L,Hao R S,Cheng X F,Li Y H,Yang P C,Sahu S K,Chen Y P,Cheng L,He S Q,Liu P,Fan G Y,Lu H R,Hu G H,Dong W,Chen B,Jiang Y,Zhang Y W,Xu H H,Lin F,Slipper B,Postma A,Jackson M,Abate B A,Tesfaye K,Demie A L,Bayeleygne M D,Degefu D T,Chen F,Kuria P K,Kinyua Z M,Liu T X,Yang H M,Huang F N,Liu X,Sheng J,Kang L. 2020. Genomic and transcriptomic analysis unveils population evolution and development of pesticide resistance in fall armyworm Spodoptera frugiperda[J]. Protein & Cell. doi:10.1007/s13238-020-00795-7.
Montezano D G,Sosa-Gómez D R,Specht A,Roque-Specht V F,Sousa-Silva J C,Paula-Moraes S V,Peterson J A,Hunt T E. 2018. Host plants of Spodoptera frugiperda (Lepidoptera:Noctuidae) in the Americas[J]. African Entomology,26(2):286-300. doi:10.4001/003.026.0286.
Okuma D M,Bernardi D,Horikoshi R J,Bernardi O,Silva A P,Omoto C. 2018. Inheritance and fitness costs of Spodoptera frugiperda (Lepidoptera:Noctuidae) resistance to spinosad in Brazil[J]. Pest Management Science,74(6):1441-1448. doi:10.1002/ps.4829.
Riveron J M,Irving H,Ndula M,Barnes K G,Ibrahim S S,Paine M J I,Wondji C S. 2013. Directionally selected cytochrome P450 alleles are driving the spread of pyrethroid resistance in the major malaria vector Anopheles funestus[J]. Proceedings of the National Academy of Scien-ces of the United States of America,110(1):252-257. doi:10.1073/pnas. 1216705110.
Senthil-Nathan S. 2013. Physiological and biochemical effect of neem and other Meliaceae plants secondary metabolites against Lepidopteran insects[J]. Frontiers in Physio-logy,4:359. doi:10.3389/fphys.2013.00359.
Song X,Pei L,Zhang Y,Chen X,Zhong Q,Ji Y,Tang J,Feng F,Li B. 2020. Functional diversification of three delta-class glutathione S-transferases involved in development and detoxification in Tribolium castaneum[J]. Insect Molecular Biology,29(3):320-336. doi:10.1111/imb.12637.
Teixeira L A,Andaloro J T. 2013. Diamide insecticides:Global efforts to address insect resistance stewardship challenges[J]. Pesticide Biochemistry and Physiology,106(3):76-78. doi:10.1016/j.pestbp.2013.01.010.
Zhang B Z,Su X,Zhen C A,Lu L Y,Li Y S,Ge X,Chen D M,Pei Z,Shi M W,Chen X L. 2020. Silencing of cytochrome P450 in Spodoptera frugiperda(Lepidoptera:Noctuidae) by RNA interference enhances susceptibility to chlorantraniliprole[J]. Journal of Insect Science,20(3):12;1-7. doi:10.1093/jisesa/ieaa047.
Zhang X L,Liao X,Mao K K,Yang P,Li D Y,Alia E,Wan H,Li J H. 2017. The role of detoxifying enzymes in field-evolved resistance to nitenpyram in the brown planthopper Nilaparvata lugens in China[J]. Crop Protection,94:106-114. doi:10.1016/j.cropro.2016.12.022.
(責任编辑 麻小燕)
