基于Sirt1/PPARγ途径探究没食子酸对肾病综合征大鼠肾功能与足细胞损伤的影响
2021-08-02龙喜国
王 婷,冯 琦,龙喜国
0 引言
肾病综合征(Nephrotic syndrome,NS)是肾小球滤过膜损伤后基膜通透性增加的一种病理生理状态[1]。由于血液白蛋白大量异常地通过肾小球渗入尿液,导致了血液白蛋白低下、血脂急剧增加和水肿等现象[2]。而尿蛋白的形成与肾小球滤过屏障损伤有关,作为肾小球滤过的障碍,足细胞在肾病综合征期间尿蛋白的形成中起重要作用[3],因此,足细胞可以作为治疗肾病综合征的关键靶标。
没食子酸(Gallic acid)是一种天然多酚类化合物,其具有多种生物学活性,包括抗氧化、抗诱变、抗炎、抗癌以及保护心脏等[4-6]。目前,已有研究表明,没食子酸不仅能够保护质膜的完整性,而且可以增加肝脏和肾脏的再生和修复能力,并对甲氨蝶呤引起的大鼠肾组织损伤具有保护作用[7]。因此,本研究通过阿霉素诱导建立肾病综合征大鼠模型,探讨没食子酸对肾组织损伤和肾小球足细胞损伤中的干预作用及可能机制。
1 材料与方法
1.1 动物 60只雄性SPF 级Sprague-Dawley(SD)大鼠,体重180~220 g,购自新疆医科大学实验动物研究中心。室温20~24 ℃,相对湿度40%~70%,适应性普通饲料1周,自由饮水摄食。
1.2 主要材料与试剂 肾小球足细胞株(MPC5)购于上海弘顺生物科技有限公司,阿霉素(ADR)购自山西普德药业股份有限公司,尿蛋白定量检测试剂盒购自南京建成生物工程研究所,CCK-8试剂盒、HE染色和免疫组化染色试剂均购自上海碧云天生物研究所;胎牛血清、青霉素、链霉素与RPMI-1640培养基购自美国Sigma公司,Annexin V-FITC/PI细胞凋亡检测试剂盒购自美国BD公司,ECL化学发光液和BCA蛋白质测定试剂盒购自北京索莱宝生物科技公司,抗体过氧化物酶体增殖物激活受体γ(PPARγ)、Nephrin、Podocin、Sirtl以及GAPDH购自美国Abcam公司,辣根过氧化物酶标记的山羊抗兔购自北京博奥森生物公司。
1.3 方法
1.3.1 大鼠分组、造模及给药处理 60只雄性SD大鼠适应性饲养1周后,取8只作为对照组,剩余52只建模。建模方法:大鼠在建模的第1、8天通过尾静脉注射剂量分别为 4 mg/kg和1 mg/kg的阿霉素,对照组大鼠给予等量生理盐水。注射后每隔1周收集1次24 h尿样本,测定尿蛋白含量,当24 h尿蛋白达到100 mg以上时,说明肾病综合征模型大鼠造模成功。在造模成功的47只大鼠中随机选择32只,并随机分为模型组、没食子酸低剂量组(50 mg/kg)、没食子酸高剂量组(100 mg/kg)和醋酸泼尼松组(6 mg/kg),每组8只。其中没食子酸低、高剂量组大鼠分别以50 mg/kg和100 mg/kg灌胃,1次/d;醋酸泼尼松组大鼠按照6 mg/kg灌胃醋酸泼尼松,1次/d;对照组和模型组同时以生理盐水灌胃,1次/d。共持续干预8周,实验期间自由饮食饮水。
1.3.2 尿蛋白及血清生化指标测定 尿蛋白指标测定:将尿液置于离心机中,4 ℃下1 000 r/min离心10 min,取上清液,根据检测试剂盒使用说明测定尿蛋白浓度,加入提前混合好的检测试剂,37 ℃水浴孵育30 min取出,用酶标仪测定吸光度值计算蛋白浓度,并综合尿量计算24 h尿蛋白含量。血清生化指标测定:最后一次给药后24 h,处死各组大鼠,收集腹主动脉血,静置2 h后,在4 ℃离心机中以3 500 r/min离心10 min,取上清。根据检测试剂盒说明书检测血清中总胆固醇(TC)、三酰甘油(TG)、血清白蛋白(ALB)、血尿素氮(BUN)和血肌酐(Scr)的水平。
1.3.3 组织处理染色 肾组织HE染色:取大鼠肾组织,一部分固定在10%中性福尔马林液中,另一部分在液氮中快速冷冻后保存在-80 ℃。对肾组织进行HE染色,将固定的肾组织经梯度酒精脱水、常规石蜡包埋后,切成厚度为3 μm的薄片,苏木精染色5 min,流水冲洗,伊红染色液染色3 min,使用乙醇脱水后自然晾干,二甲苯透明10 min,中性树胶封片,在光学显微镜下观察并拍照。免疫组织化学染色:将固定好的肾组织进行常规石蜡包埋,切片机切成3 μm 的石蜡组织切片。切片进行脱蜡处理,滴加柠檬酸缓冲液高温高压抗原修复,用3%H2O2室温处理30 min。滴入山羊血清室温封闭30 min,然后滴加一抗Nephrin(1∶500)并置于4 ℃孵育过夜。次日PBS冲洗,滴加HRP标记山羊抗兔IgG二抗(1∶1 000),37 ℃孵育30 min。PBS冲洗后加入DAB溶液显色,苏木精溶液中复染。经乙醇梯度脱水、透明后,自然晾干后,采用中性树胶封片,光学显微镜采集图像。
1.3.4 实时荧光定量PCR TRIzol法提取肾组织总RNA,Nanodrop测定提取的RNA纯度和浓度,按照cDNA合成试剂盒说明进行逆转录获得cDNA。根据SYBR Green qPCR Master Mix试剂盒说明进行qRT-PCR检测基因mRNA表达,以GAPDH作为内参基因。扩增程序为:95 ℃预变性5 min(1个循环);95 ℃变性30 s(1个循环),55 ℃退火15 s,72 ℃延伸30 s(45个循环)。采用2-ΔΔCt法计算基因mRNA的相对表达水平,使用Primer Premier 5.0软件设计引物,引物序列由上海生工生物有限公司合成,具体序列:Sirtl上游引物:5′-TCATCTGTGAAAGTGATGACGA-3′,下游引物:5′-CTGCCACAGTGTCATATCATCA-3′;PPAR-γ上游引物:5′-TCTGTGGACCTCTCTGTGAG-3′,下游引物:5′-GCTCTTGTGACGGATGT-3′;GAPDH上游引物:5′-ACAGCAACAGGTGGTGGAC-3′,下游引物:5′-GCCGATCCACACGGAGTAC-3′。
1.3.5 Western blot 将肾组织剪碎并加入RIPA裂解缓冲液进行裂解,在4 ℃下以10 000 r/min离心15 min,收集上清液,BCA蛋白测定法测定总蛋白浓度。取50 μg蛋白样品通过10% SDS-PAGE分离并转移到聚偏二氟乙烯膜上,在5%脱脂奶粉中封闭2 h,滴加一抗兔抗PPARγ(1∶200)、兔抗Sirtl(1∶200)以及GAPDH(1∶1 000)在4 ℃下孵育过夜。次日,TBST清洗3次,滴加辣根过氧化物酶标记山羊抗兔IgG(1∶2 000)室温孵育1 h,TBST洗涤3次,通过滴加增强的ECL化学发光液显色曝光,通过Image-Pro Plus 6.0软件对各蛋白条带进行分析。
1.3.6 细胞培养与处理 在足细胞中添加含10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的RPMI1640培养液,在37 ℃、5%CO2培养箱中培养,每隔2 d换液1次,待细胞融合度至80%左右进行消化传代。将足细胞浓度调整为1×105个/ml,取200 μl接种于96 孔板中,实验分为对照组、高糖模型组和不同浓度没食子酸(10、25、50 μmol/L)给药组,对照组细胞采用11.1 mmol/L葡萄糖培养液培养48 h,模型组细胞采用30 mmol/L葡萄糖培养液培养48 h,没食子酸给药组细胞分别采用含终浓度为10、25、50 μmol/L的没食子酸培养液培养12 h 后,更换为30 mmol/L的葡萄糖培养液继续培养 48 h。
1.3.7 细胞活性检测 将对数生长期的足细胞以5×103个/孔的密度接种于96孔板上,置于37 ℃、5%CO2培养箱中培养24 h后,按照“1.3.6”项进行分组与处理。每孔滴加10 μl CCK-8溶液,继续培养4 h,每组设置6个复孔,采用酶标仪于450 nm处读取吸光度值。
1.3.8 细胞凋亡检测 按照“1.3.6”处理各组足细胞,之后收集细胞,通过胰蛋白酶消化并离心,PBS洗涤后,制成细胞悬液,使用Annexin V-FITC/PI细胞凋亡检测试剂盒检测各组细胞的凋亡情况,加入500 μl 1×binding buffer重悬细胞,在细胞悬浮液加入5 μl Annexin V-FITC,加入10 μl PI,混匀后室温避光孵育15 min,采用流式细胞仪检测各组细胞的凋亡情况。
1.3.9 免疫荧光染色 将对数生长期足细胞以1×104个/孔的密度铺于24孔板内的无菌玻片上,置于37 ℃、5%CO2培养箱培养 24 h 后,按照“1.3.6”项进行分组处理后,PBS洗涤细胞,滴加10%中性甲醛溶液室温固定20 min,自来水冲洗,滴加0.2% TritonX-100透膜处理15 min,然后加入 10%山羊血清,室温封闭30 min,滴加一抗抗体在4 ℃下孵育过夜,次日弃去一抗,滴加荧光二抗,暗室室温孵育1 h后洗去未结合的二抗,滴加 DAPI 室温染色 10 min,洗涤后封片,于荧光显微镜下观察Nephrin和Podocin表达情况。
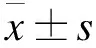
2 结果
2.1 各组大鼠生化指标比较 与对照组比较,模型组大鼠尿蛋白含量明显增高(P<0.05),血清中TC、TG、BUN水平增加(P<0.05),而ALB水平降低(P<0.05);与模型组比较,没食子酸高、低剂量组和醋酸泼尼松组大鼠尿蛋白含量减少(P<0.05),TC、TG水平降低(P<0.05),见表1。
表1 各组大鼠生化指标比较(n=8)
2.2 各组大鼠肾组织病理学分析 HE染色显示,对照组大鼠肾组织结构正常,未见病理改变;模型组大鼠可见肾小管结构紊乱,出现萎缩或扩张,肾间质增宽,且有大量炎细胞浸润;经低、高剂量的没食子酸和醋酸泼尼松处理的大鼠,肾组织病变减轻,且高剂量没食子酸和醋酸泼尼松处理的大鼠肾组织损伤程度较小,肾小管结构恢复较好,见图1。

图1 HE染色检测肾组织病理变化(400×)
2.3 各组大鼠肾组织Nephrin表达检测 结果显示,对照组大鼠肾小球中Nephrin呈强阳性表达,模型组大鼠肾小球中Nephrin表达较对照组明显减弱,没食子酸低、高剂量组和醋酸泼尼松组大鼠肾小球中Nephrin表达较模型组明显增强,见图2。
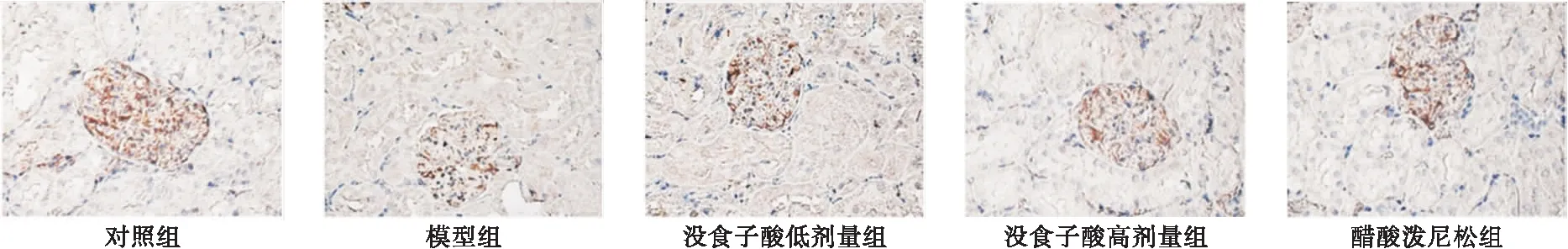
图2 免疫组化染色检测肾组织Nephrin蛋白表达(400×)
2.4 各组大鼠肾组织中SIRT1、PPAR-γ mRNA和蛋白表达比较 结果显示,与对照组比较,模型组的肾组织中SIRT1 mRNA和蛋白表达水平升高,而PPARγ mRNA和蛋白表达水平则显著降低(P<0.05)。在没食子酸高剂量组和醋酸泼尼松组大鼠肾组织中,SIRT1 mRNA和蛋白表达水平较模型组降低,PPARγ mRNA和蛋白表达水平较模型组显著升高(P<0.05),见表2、图3。
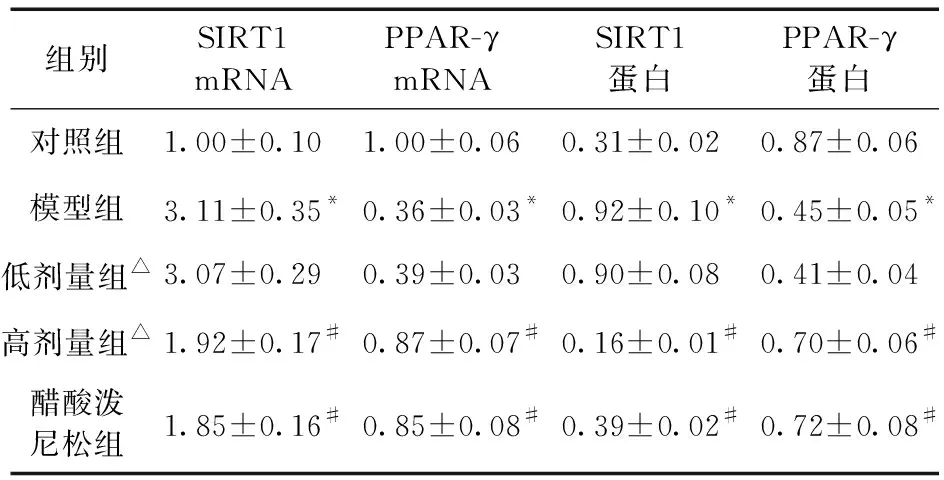
表2 各组大鼠肾组织中SIRT1、PPAR-γ mRNA和蛋白表达比较(n=8)
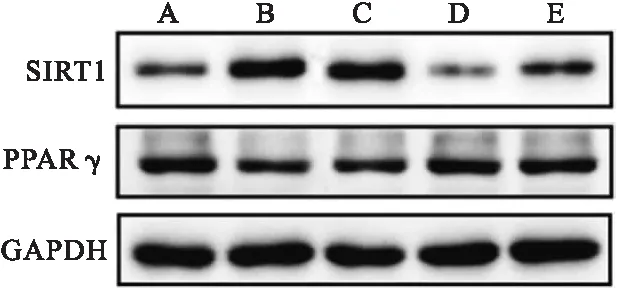
图3 Western blot检测各组大鼠肾组织SIRT1和PPAR-γ蛋白表达
2.5 各组足细胞存活率比较 结果显示,与对照组比较,高糖模型组足细胞存活率显著下降(P<0.05)。没食子酸各组细胞存活率均明显高于高糖模型组细胞存活率(P<0.05),且随着没食子酸浓度的增加,存活率逐渐增加,见表3。
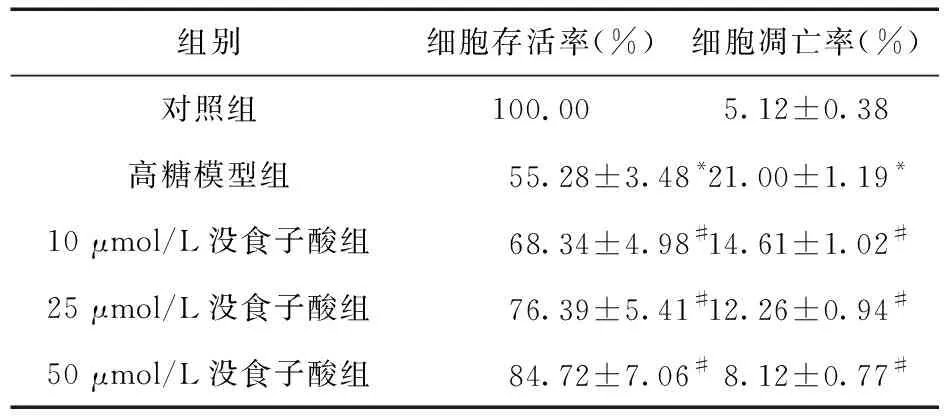
表3 各组足细胞存活率与凋亡率比较(n=6)
2.6 各组足细胞凋亡率比较 结果显示,高糖模型组足细胞的凋亡率较对照组升高(P<0.05)。与高糖模型组比较,没食子酸各组细胞凋亡率显著下降,且随着没食子酸浓度的增加,细胞凋亡率逐渐下降,见图4、表3。

图4 流式细胞术检测各组足细胞凋亡
2.7 各组足细胞中Nephrin和Podocin表达检测 结果显示,观察到对照组细胞中Nephrin和Podocin表达荧光较强,高糖模型组Nephrin和Podocin表达荧光强度明显弱于对照组,没食子酸各组随着药物浓度升高,Nephrin和Podocin表达荧光强度均逐渐增强,见图5。
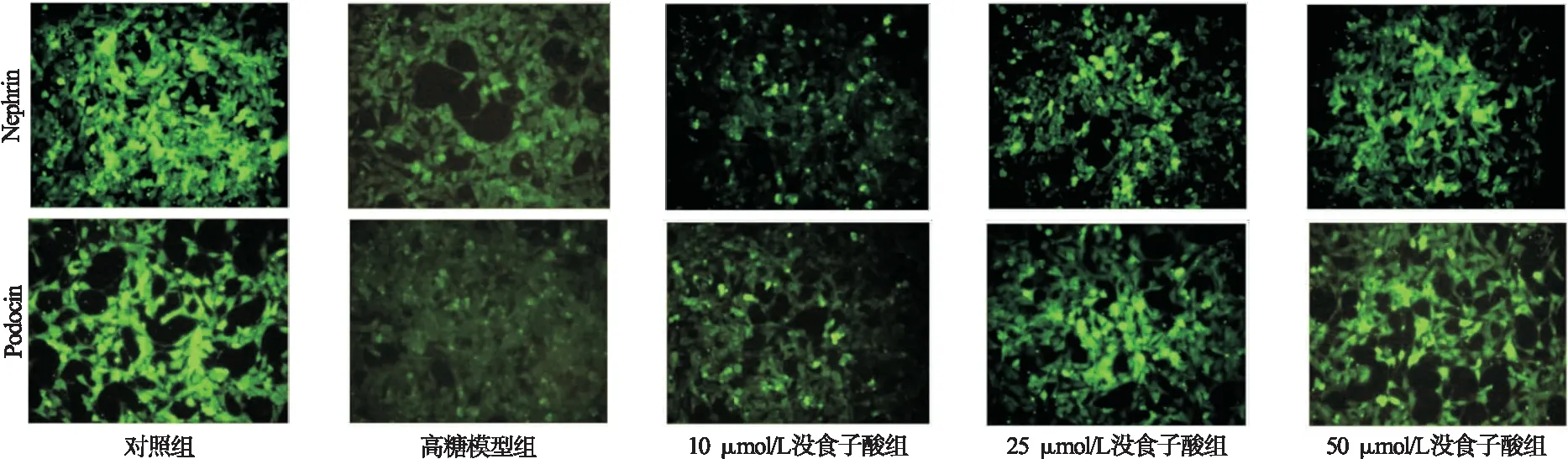
图5 免疫荧光染色检测各组细胞中Nephrin和Podocin表达(100×)
3 讨论
目前,NS主要的常规疗法包括免疫抑制剂、抗炎药和细胞毒性剂,其不良反应大,如真菌感染和器官毒性,使NS的治疗受到严重限制[8]。因此,鉴定用于治疗NS的有效药物或新疗法对于该病的预防或治疗至关重要。
采用阿霉素诱发的NS是目前常用的动物造模方法,在本研究中,通过阿霉素诱导的大鼠尿蛋白含量明显增高,血清中TC、TG、BUN水平明显增加,ALB水平降低,说明大鼠肾功能受到损伤。以往研究表明,没食子酸具有改善肾脏损伤的作用。Baradaran等[9]发现,含有没食子酸的芦荟对庆大霉素诱导的雄性大鼠肾组织毒性具有保护作用;Nabavi等[10]研究表明,没食子酸可保护大鼠肾脏免受氧化应激损伤。在本研究中,没食子酸干预的大鼠中尿蛋白量明显减少,TC、TG水平也降低,HE染色显示大鼠肾组织损伤程度减少,说明没食子酸具有改善NS大鼠肾功能的作用。
NS的特征是肾小球滤过功能障碍。足细胞位于肾小球基底膜的外表面,在维持肾小球滤过屏障以及裂膜结构的完整性中起着重要作用[11]。足细胞损伤或丢失是尿蛋白形成以及NS发生发展的关键因素。足细胞损伤机制复杂,主要包括氧化应激、炎症反应、微循环障碍、内质网应激等[12]。本研究通过高糖诱导足细胞损伤,观察没食子酸对足细胞存活与凋亡的影响。结果表明,经过没食子酸干预的足细胞在经过高糖刺激后,细胞存活率升高而凋亡率下降。在与肾脏功能相关的分子介质中,Nephrin和Podocin是肾小球滤过屏障的重要组成部分,这2种基因表达改变与肾病密切相关。足蛋白包括肾素和Podocin在足细胞的裂隙膜中起主要作用,并且是维持肾小球滤过屏障选择性通透性的必需元素[13]。有研究表明,糖尿病肾病中Nephrin和Podocin基因表达的改变会导致尿蛋白、肾小球硬化以及肾功能恶化[14]。本研究表明,Nephrin在肾病综合征大鼠肾组织中表达减少,同时,Nephrin和Podocin在高糖刺激的足细胞中表达受到抑制,而经过没食子酸干预后,大鼠肾组织中Nephrin表达增加,足细胞中Nephrin和Podocin的荧光强度增加。
PPARγ是核转录因子超家族的成员之一,参与脂质代谢、炎症反应、脂肪细胞分化和免疫反应等。研究表明,PPARγ在肾脏疾病中起重要的调节作用,在糖尿病肾病中,PPARγ 激动剂罗格列酮可显著降低尿蛋白水平[15]。此外,激活PPARγ可减少NS大鼠肾小球巨噬细胞浸润和炎性因子的表达,并减轻足细胞损伤以起到保护肾脏的作用[16]。沉默信息调节因子 1(Sirt1)是第3类组蛋白去乙酰化酶Sirtuin 家族成员之一,通过去乙酰化作用,在氧化应激、脂肪代谢、激素反应和细胞凋亡中发挥作用[17]。本研究结果显示,在NS大鼠肾组织中SIRT1 mRNA和蛋白表达水平升高而PPARγ mRNA和蛋白表达水平降低,经没食子酸干预后,SIRT1表达受到抑制,同时PPARγ表达激活。由此说明,没食子酸可能通过调控SIRT1/PPAR-γ通路发挥肾病综合征大鼠肾功能的保护作用。
综上所述,没食子酸能够显著改善NS大鼠肾功能下降,减轻肾脏病理损害,并且减轻高糖刺激下的足细胞损伤,这可能是其治疗肾病综合征的机制之一。但没食子酸对于足细胞损伤作用的关键信号通路目前并不清楚,以期进行后续研究,以进一步阐明没食子酸治疗NS的具体分子机制。
